A flavonoidok, az apigenin és a kvercetin gátolják a melanoma növekedését és az áttétet
Onkológiai és Idegtudományi Tanszék, „G. D'Annunzio ”Egyetem, Chieti, Olaszország
Immunopatológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Immunopatológiai laboratórium, Consorzio Mario Negri Sud, Via Nazionale, I ‐ 66030 Santa Maria Imbaro, Chieti, Olaszország. Fax: +39 872 578240 Keresse meg a szerző további cikkeit
Tumor- és érsejtbiológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Tumor- és érsejtbiológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Szövettani Tanszék, Katolikus Egyetem, Róma, Olaszország
Immunológiai Tanszék, Regina Elena Intézet, Róma, Olaszország
Onkológiai és Idegtudományi Tanszék, „G. D'Annunzio ”Egyetem, Chieti, Olaszország
Immunopatológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Onkológiai és Idegtudományi Tanszék, „G. D'Annunzio ”Egyetem, Chieti, Olaszország
Immunopatológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Onkológiai és Idegtudományi Tanszék, „G. D'Annunzio ”Egyetem, Chieti, Olaszország
Onkológiai és Idegtudományi Tanszék, „G. D'Annunzio ”Egyetem, Chieti, Olaszország
Immunopatológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Immunopatológiai laboratórium, Consorzio Mario Negri Sud, Via Nazionale, I ‐ 66030 Santa Maria Imbaro, Chieti, Olaszország. Fax: +39 872 578240 Keresse meg a szerző további cikkeit
Tumor- és érsejtbiológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Tumor- és érsejtbiológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Szövettani Tanszék, Katolikus Egyetem, Róma, Olaszország
Immunológiai Tanszék, Regina Elena Intézet, Róma, Olaszország
Onkológiai és Idegtudományi Tanszék, „G. D'Annunzio ”Egyetem, Chieti, Olaszország
Immunopatológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Onkológiai és Idegtudományi Tanszék, „G. D'Annunzio ”Egyetem, Chieti, Olaszország
Immunopatológiai laboratórium, Érgyógyászati és Farmakológiai Tanszék, Consorzio Mario Negri Sud, Santa Maria Imbaro, Chieti, Olaszország
Onkológiai és Idegtudományi Tanszék, „G. D'Annunzio ”Egyetem, Chieti, Olaszország
Absztrakt
ANYAG ÉS MÓDSZEREK
Sejtek
A B16-BL6 sejtvonal egér melanoma variáns, amely nagyon áttétes a szinogén C57BL/6N egerek tüdejében (Talmadge és Fidler, 1982), a szülő B16 sejtvonal közül kiválasztva (Hart, 1979). A tumorsejteket egyrétegű sejtekben tenyésztettük 10% hő-inaktivált FCS-sel (GIBCO) és 2 mM glutaminnal kiegészített DMEM-ben (GIBCO, Paisley, Egyesült Királyság). Az injekcióhoz a sejteket növekedési fázisban gyűjtöttük be. A nagy affinitású ösztrogénkötő helyeket a B16-BL6 sejtekben dextránnal bevont széneljárással vizsgáltuk. Ezenkívül az ösztrogén receptor fehérjék jelenlétét immunhisztokémiai úton vizsgáltuk antiösztrogén receptor antitestekkel (Neomarkers, Union City, CA) a B16-BL6 sejtek citocentrifugált készítményeiben. Mindkét módszer nem fedte fel ezeket a receptorokat. A II. Típusú ösztrogénkötő helyeket a leírt hidroxi-apatit módszerrel vizsgáltuk (Piantelli et al., 1995).
Kábítószerek és vegyszerek
Kvercetin (3,3 ′, 4 ′, 5,7-pentahidroxi-flavon), apigenin (4 ′, 5,7-trihidroxi-flavon), hesperidin (3 ′, 5,3-hidroxi-4-metoxi-flavanon), rutin (3-ramnozil-glükozid) (-) - epigallokatechin-3-gallát (EGCG; [2R, 3R] -2- [3,4,5-trihidroxifenil] -3,4-dihidro-1 [2H] -benzopirán-3,5, 7-triol-3- [3,4,5-trihidroxi-benzoát]), resveratrol (3,4 ', 5-trihidroxi-3ford-Stilbene), kurkumin (1,7-bisz [4-hidroxi-3-metoxi-fenil] -1,6-heptadién-3,5-dion), tamoxifen (ford-2 - [4- (1,2-difenil-1-butenil) fenoxi] -N, N-Dimetil-etil-amin) és ciszplatin (cisz-Diammin-diklór-platinát) a Sigma-tól (Deisenhofen, Németország) szereztük be. Az Ipriflavone (izoflavon) ajándékot kapott Chiesi (Parma, Olaszország).
In vitro sejtproliferáció
A sejteket 10 4/cm 2 -en, 24-lyukú lemezek (Falcon, Becton Dickinson, Oxnard, CA) 16 mm-es üregeibe szélesztettük. 18 óra elteltével a táptalajt friss tápközegre cseréltük, amely a vizsgálandó vegyületeket tartalmazza. Az EGCG kivételével az összes vegyületet abszolút etanol törzsoldatból vettük, és a kontroll sejteket azonos mennyiségű hordozóval kezeltük. A végső etanolkoncentráció sem a kontrollban, sem a kezelt mintákban nem haladta meg a 0,5% -ot (v/v). Az EGCG-t vízben oldjuk. A kezeléseket 24 óra elteltével megismételtük. Három példányos tenyészet négyszeres hemocitometriai számlálását végeztük a vegyületek 72 órás expozíciója után. A timidin-beépülési vizsgálatokhoz a sejteket 10 4/cm2-nél szélesztettük 96 üregű mikrotiterlemezekre (Falcon, Becton Dickinson) 10% FCS-táptalajba. 18 óra elteltével a táptalajt eltávolítottuk, és a sejteket 0,2% FCS tápközegben tartottuk 72 órán át, hogy a sejtciklus leállását kiválthassuk. A táptalajt ezután friss 10% -os FCS tápközeggel helyettesítettük, amely a vizsgálandó vegyületeket vagy vivőanyagot tartalmazta a fentiek szerint. A timidin beépülésének szintjét a korábban leírtak szerint határoztuk meg (Caltagirone et al., 1997).
A tumor növekedési vizsgálata
A nőstény C57BL/6N egereket (6-8 hetesek) Charles River-től (Calco, Olaszország) szereztük be. Az állatokat az egyes kísérletekben életkoruk és súlyuk szerint egyeztettük. A tumorsejteket (5x104) 0,1 ml PBS-ben i. az egerek gastrocnemius izomba, amelyeket véletlenszerűen 6-8 állatból álló kísérleti csoportba osztottak, vivőanyagot vagy napi i.p. kezelések a megadott dózisokban. A kvercetint, az apigenint, a resveratrolt, a kurkumint és a tamoxifent szonikálással szuszpendáltuk 20% polietilénglikolt (PEG 400) és 2% Tween-80 (pH 7,2) tartalmú PBS-ben (Gerritsen). et al., 1995). Az EGCG-t és a ciszplatint H2O-ban oldjuk. A kezeléseket a daganatsejtek injekciójának napján kezdtük meg a ciszplatin kivételével valamennyi vegyület esetében. A ciszplatint iv. 3 nappal a tumorsejt-injekció után 3 napos időközönként, összesen 3 dózisban. A daganat növekedését hetente háromszor mértük egy tolómérővel, és a daganat térfogatát a képlet alapján becsültük meg: hossz × szélesség 2/2 (Giavazzi et al., 1986; Alessandri et al., 1987; Chirivi et al., 1994). A láb átlagos térfogata a daganatsejt-injekció beadásának napján 0,05 ± 0,01 cm 3 volt. Valamennyi állatot az Európai Közösség irányelveinek megfelelően kezeltük.
Tüdő-kolonizációs vizsgálat
Az egereknek 5 × 104 tumorsejtet injektáltunk 0,1 ml PBS-ben az oldalsó farokvénában. A kezeléseket i.p. naponta, 1 órával a tumorsejt injekció beadása előtt. Az egereket méhnyak diszlokációval elpusztítottuk 14-18 nappal a tumorsejt injekció után. A tüdőket Bouin oldatában rögzítettük, és a fekete daganatos sejtek telepeit 2 különböző operátor számolta.
Szerveloszlás vizsgálata
A B16-BL6 sejtek tenyészeteit előzetesen 5- [125 I] -jód-2′-dezoxiuridinnal (Amersham, Aylesbury, Egyesült Királyság) jelöltük 0,3 mCi/ml koncentrációban 24 órán át. Jelölt daganatos sejteket 5x104 koncentrációban 0,1 ml PBS-ben injektáltunk iv. vivőanyagot kapó egerekben vagy i.p. kezelés 1 órával a sejtinjekció előtt. 10 perc múlva, 2, 4, 8 és 24 órával a tumorsejt injekció után az egereket leöltük, a tüdőt eltávolítottuk és háromszor 70% -os etanollal mostuk. A tüdő, a máj, a lép, a vesék, a vér és a hólyag vizelet radioaktivitását gamma-számlálóval határoztuk meg (Fidler, 1970)
In vitro inváziós vizsgálat
A kemo-inváziós vizsgálatot a korábban leírtak szerint hajtották végre (Albini et al., 1987). Röviden: 13 mm átmérőjű polikarbonát szűrőket (polivinil-pirrolidon-mentes, 5 μm pórusméret; Nucleopore, Pleasanton, CA) 15 μg/szűrő Matrigel (Becton Dickinson, Milánó, Olaszország) alapmembránnal bevonva Boyden kemotaxis kamrákba helyeztük. 3x105/0,8 ml DMEM-ben szuszpendált sejteket adunk a felső kamrához a vizsgálandó vegyületekkel vagy anélkül. Az alsó kamra 0,2 ml szérummentes kondicionált táptalajt tartalmazott, 18 órás tenyészetből, 30x104 Swiss 3T3 sejtekből, 1: 2 arányban hígítva, kemo-vonzerőként. A Boyden-kamrákat 37 ° C-on inkubáltuk 6 órán át; majd a szűrők felső felületén lévő sejteket mechanikusan eltávolítottuk, a szűrőket metanolban rögzítettük és hematoxilinnal és eozinnal festettük. Azokat a sejteket, amelyek behatoltak a szűrők alsó felületére, fénymikroszkóppal megszámláltuk 5 mezőn (nagyítás × 400). Minden állapotot három példányban teszteltünk. A B16-BL6 sejtek életképessége meghaladta a 90% -ot, párhuzamos tenyészetekben Trypan-kék festéssel értékelve.
Statisztikai analízis
A kezelések intramuszkuláris tumor növekedésére gyakorolt hatását az ANOVA ismételt mérésekkel értékelte. Post hoc Ezután az összehasonlításokat Scheffe teszttel végeztük, 5% -os szignifikancia szinten, a kezelések hatékonyságának összehasonlítása céljából. Kétfarkú diákok tPárosítatlan összehasonlítások tesztjét alkalmazták a kezeléseknek a tüdőben lévő kolóniák kialakulására és a B16-BL6 invazív aktivitásra gyakorolt hatásainak jelentőségének felmérésére.
EREDMÉNYEK
A polifenolos vegyületek gátolják a B16-BL6 melanoma sejtek növekedését in vitro
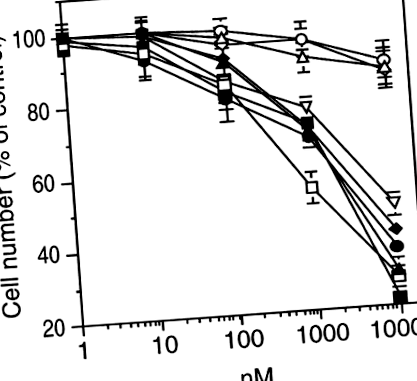
A in vitro Kiértékeltük a B16-BL6 melanoma sejtek növekedését polifenolos vegyületek (10–9–10–5 M) jelenlétében. A kvercetin, az apigenin, az EGCG, a resveratrol, a kurkumin és a tamoxifen koncentrációfüggő módon gátolta a B16-BL6 sejtek növekedését (1. ábra). A sejtnövekedés 50% -os (IC50) gátlásához szükséges koncentrációkat az I. táblázatban közöljük. Ezzel szemben a rutin, a hesperidin és az ipriflavone hatástalanok voltak (1. ábra). A tamoxifen gátló hatása exogén ösztrogének hozzáadásával nem fordítható meg (az adatokat nem mutatjuk be). Ezzel a megfigyeléssel egyetértésben azt tapasztaltuk, hogy a B16-BL6 sejtek ösztrogén receptor negatívak voltak. A sejtszaporodást gátló vegyületek a timidin beépülésével értékelve a B16-BL6 DNS-szintézist is gátolták, hasonló IC50-értékekkel, mint a sejtek számának csökkentésére (az adatokat nem közöljük).
A polifenolos vegyületek gátolják a B16-BL6 melanoma sejtek növekedését in vitro. A sejteket 10 4/cm2-nél szélesztettük egy 24-lyukú lemez 16 mm-es üregébe. 18 óra elteltével a táptalajt friss tápközegre cseréltük, amely a vizsgálandó vegyületeket tartalmazza. A kezeléseket 24 óra elteltével megismételtük. Három példányos tenyészet négyszeres hemocitometriai számlálását végeztük a vegyületek 72 órás expozíciója után. A kontrollérték 160 000 ± 10 000 sejt/üreg volt. Zárt háromszögek, kvercetin; nyitott négyzetek, apigenin; zárt körök, kurkumin; zárt négyzetek, tamoxifen; fordított nyitott háromszögek, EGCG; zárt gyémántok, resveratrol; nyitott háromszögek, ipriflavone; nyitott körök, rutin; nyitott gyémántok, hesperidin. Három kísérletben három példányban elvégzett eredményeket átlag ± SD-ként fejezzük ki.
| Apigenin | 1.5 |
| Quercetin | 3.5 |
| EGCG | 8.9 |
| Tamoxifen | 2.8 |
| Kurkumin | 3.6 |
| Resveratrol | 5.0 |
- Az eredményeket három kísérlet átlagában fejezzük ki három példányban. SD-k voltak
A polifenolos vegyületek gátolják a B16-BL6 melanoma sejtek növekedését in vivo
A polifenolos vegyületek gátolják a B16-BL6 melanoma sejtek növekedését in vivo. B16-BL6 sejteket (5 × 104) injektáltunk a gastrocnemius izomba. Az egereket i.p. minden nap a vizsgálandó vegyületekkel vagy hordozóval (kontroll). Az eredményeket átlag ± SD-ként fejezzük ki (n = 8 egér/csoport), és 3 kísérletet jelentenek. a) Zárt körök, vezérlés; nyitott négyzetek, 25 mg/kg apigenin; nyitott háromszögek, 50 mg/kg apigenin; zárt négyzetek, 25 mg/kg kvercetin; zárt háromszögek, 50 mg/kg kvercetin. b) Zárt körök, vezérlés; nyitott gyémántok, 50 mg/kg resveratrol; nyitott négyzetek, 50 mg/kg tamoxifen; nyitott háromszögek, 50 mg/kg EGCG. Az adatok ANOVA-ja azt mutatta, hogy mind a kezelések, mind a kezelések ideje (nap) jelentős hatással voltak a tumor térfogatára (o apigenin = kvercetin = tamoxifen> resveratrol> kontroll.
Az apigenin növeli a ciszplatin gátló hatását a B16-BL6 melanoma sejtek növekedésére in vivo. A kísérletet a 2. ábrán leírtak szerint hajtottuk végre. A ciszplatint iv. 3 nappal a tumorsejt-injekció után 3 napos időközönként, összesen 3 adagban. Az eredményeket átlag ± SD-ként fejezzük ki (n = 8 egér/csoport), és 3 kísérletet jelentenek. Zárt körök, vezérlés; nyitott négyzetek, 25 mg/kg apigenin; nyitott gyémántok, 2 mg/kg ciszplatin; nyitott háromszögek, 25 mg/kg apigenin + 2 mg/kg ciszplatin. Az adatok ANOVA-ja azt mutatta, hogy mind a kezelések, mind a kezelések ideje (nap) jelentős hatással voltak a tumor térfogatára (o
A kvercetin és az apigenin hatásosan gátolja a B16-BL6 sejtek tüdőtelepítését
Megvizsgáltuk a B16-BL6 tumor növekedését gátló vegyületek képességét a tüdő kolonizáció gátlására. A kezeletlen és kezelt egerek tüdejének makroszkopikus megjelenése egyértelműen azt mutatta, hogy 50 mg/kg kvercetin csökkentette a tüdő áttétek számát iv. B16-BL6 sejtek injekciója (4. ábra). Amikor a kezelések hatásait kvantitatívan értékeltük, azt tapasztaltuk, hogy a kvercetin és az apigenin, mind 50, mind 25 mg/kg-nál, szignifikánsan csökkentette a telepek számát, míg a tamoxifen csak a legmagasabb dózisban volt hatásos (II. Táblázat). Ezenkívül a 2. táblázatban bemutatott 3 kísérlet mindegyikében a kvercetin és az apigenin 50 mg/kg dózisban szignifikánsan hatékonyabb volt, mint a tamoxifen azonos dózisban (o
A kvercetin gátolja a B16 ‐ BL6 sejtek tüdőtelepítését. Sejteket (5 × 104) 6 egér oldalsó farokvénájába injektáltunk. A kvercetint i.p. minden nap 50 mg/kg dózisban. Vivőanyaggal (felső sor) és kvercetinnel (alsó sor) kezelt egerek tüdeje. Méretarány = 1 cm.
| 1 | 86 ± 192 2 Az eredményeket átlag ± SD és a kontroll% -ában fejezzük ki (zárójelben). | 65 ± 123 3 o | 29 ± 54 4 o | 61 ± 133 3 o | 34 ± 44 4 o | 73 ± 15 | 48 ± 104 4 o | 83 ± 18 | 85 ± 20 | 82 ± 19 | 74 ± 13 |
| (100) | (75) | (34) | (71) | (40) | (85) | (56) | (96) | (99) | (95) | (86) | |
| 2 | 123 ± 19 | 93 ± 103 3 o | 42 ± 124 4 o | 91 ± 123 3 o | 43 ± 54 4 o | 105 ± 20 | 66 ± 94 4 o | 121 ± 13 | 117 ± 14 | 115 ± 12 | 110 ± 11 |
| (100) | (77) | (34) | (74) | (35) | (85) | (54) | (98) | (95) | (93) | (89) | |
| 3 | 77 ± 16 | 61 ± 63 3 o | 30 ± 74 4 o | 58 ± 83 3 o | 34 ± 64 4 o | 66 ± 10 | 42 ± 74 4 o | 77 ± 18 | 72 ± 13 | 77 ± 15 | 76 ± 14 |
| (100) | (79) | (39) | (75) | (44) | (86) | (54) | (100) | (93) | (100) | (99) |
- 1 A kísérleteket a 4. ábrán leírtak szerint hajtottuk végre. A kolóniákat 2 különböző operátor számlálta 14 nappal a tumorsejt injekció után.
- 2 Az eredményeket átlag ± SD és a kontroll% -ában fejezzük ki (zárójelben).
- 3 o 4 o
A kvercetin és az apigenin hatásosan gátolja a B16-BL6 sejtek invázióját in vitro
A quercetin, az apigenin, az EGCG, a resveratrol és a tamoxifen (10–5 M) hatásait a B16-BL6 sejtek inváziójára vizsgálták. in vitro. A kvercetin, az apigenin és a tamoxifen, de nem az EGCG vagy a resveratrol, szignifikánsan (o
A kvercetin és az apigenin gátolja a B16-BL6 sejtek invázióját in vitro. B16-BL6 sejteket (3 × 105) adtunk a Boyden-kamra felső rekeszébe a jelzett vegyületekkel vagy anélkül (10–5 M). Az alsó kamra 50% -os svájci 3T3 felülúszóval kiegészített táptalajt tartalmazott kemo-attraktánsként. 6 óra elteltével azokat a sejteket, amelyek behatoltak a szűrők alsó felületére, fénymikroszkóp alatt 5 mezőben (× 400) megszámoltuk. A három kísérletben elvégzett 4 kísérlet eredményeit átlag ± SD-ként fejezzük ki. *o
- Fehérje fogyasztása a haj növekedéséhez - Britt Reuter
- Az LCHF használatának megkezdése; 1. rész Takarítási nap; Az emberi potenciál tudománya
- A CP-31398 gátolja a p53-mutált májrák sejtek növekedését in vitro és in vivo SpringerLink
- Az étrendi fehérje hatása a máj növekedésére, frakcionált fehérjeszintézisére és lebomlási sebességére
- Az akut inzulinkezelés hatása az A vaszkuláris endoteliális növekedési faktor koncentrációjára