A bal gyomor artéria és a hüvelyes gasztrektómia hatása az elhízás okozta zsírszövet makrofág infiltrációra és gyulladásra étrend okozta elhízott patkányokban
Yi Shen
1 Geriátriai Tanszék, Tongji Kórház, Tongji Egyetem, Orvostudományi Kar, Sanghaj, P.R. Kína
Yang Liu
1 Geriátriai Tanszék, Tongji Kórház, Tongji Egyetem, Orvostudományi Kar, Sanghaj, P.R. Kína
Shao-Qiu Zheng
2 Intervenciós és érsebészeti osztály, Sanghaji Tizedik Népi Kórház, Tongji Egyetem, Orvostudományi Kar, Sanghaj, Kína
Jiang Han
3 Általános Sebészeti Osztály, Pudong New Area District Zhoupu Kórház, Sanghaj, Kína
Er-Li Pei
4 Jangpu Kórház Általános Sebészeti Osztálya, amely a Shanghai Tongji Egyetem Orvostudományi Karához tartozik, Sanghaj, Kína
Zhi-Hong Li
3 Általános Sebészeti Osztály, Pudong New Area District Zhoupu Kórház, Sanghaj, Kína
Xiao-Yun Xie
2 Intervenciós és érsebészeti osztály, Sanghaji Tizedik Népi Kórház, Tongji Egyetem, Orvostudományi Kar, Sanghaj, Kína
Zhi-Qiang Li
5 Neurológiai tanszék, Shanxi Orvostudományi Akadémia, Shanxi Dayi Kórház, Taiyuan, Shanxi, Kína
Ming Luo
1 Geriátriai Tanszék, Tongji Kórház, Tongji Egyetem, Orvostudományi Kar, Sanghaj, P.R. Kína
Absztrakt
Háttér
Az olyan bariatrikus eljárások, mint a bal gyomorartér lekötése (LGAL) és a hüvelyes gasztrektómia (SG), fontos eljárásként jelentek meg a kóros elhízás kezelésében. Ebben a tanulmányban összehasonlítottuk az LGAL és az SG hatását az elhízás okozta zsírszöveti makrofág infiltrációra és gyulladásra étrend okozta elhízott patkányokban.
Anyag/módszerek
Az elhízás kiváltása érdekében Sprague-Dawley (SD) patkányokat 16 héten keresztül magas zsírtartalmú étrenddel (HFD) táplálták. SG, GLAL vagy ennek megfelelő álműtéteket végeztek altatott patkányokban. A gyulladásos faktor expresszióját a szérumban, az epididymális és a retroperitoneális zsírszövetekben 4 héttel a műtét után elemeztük. A makrofágok beszivárgását és a fenotípus transzformálását Western blot elemzéssel és immunfluoreszcenciával is értékeltük.
Eredmények
Az LGAL és az SG egyaránt erősen csillapította a magas zsírtartalmú étrend (HFD) által kiváltott zsírfelhalmozódást a retroperitoneális és epididymális szövetekben. A gyulladásos citokinek, például a tumor nekrózis faktor (TNF) -agr;, az interleukin (IL) -6 és a monocita kemoattraktáns fehérje (MCP) -1 expresszióját az LGAL és SG után az M2 makrofágok aktiválódásának elősegítésével, a folyamatos expozíció ellenére elősegítették. a HFD-nek. Ezenkívül mind az LGAL, mind az SG fokozott makrofág infiltrációt eredményezett, de nem járult hozzá a makrofágok fenotípus transzformációjához M1.
Következtetések
Az LGAL és az SG egyaránt csökkentette a HFD táplálás okozta zsírfelhalmozódást. A gyulladásos válasz enyhítésére tervezett terápiák az M2 makrofágok aktivációjának elősegítésével értékesek lehetnek.
Háttér
Az elhízás, amelyet krónikus és alacsony fokú gyulladás jellemez, a makrofágok beszűrődése kíséri a zsírszövetbe, végül hozzájárul az anyagcsere-diszfunkcióhoz, mint például az inzulinrezisztencia (IR) és a 2-es típusú diabetes mellitus (T2DM) [1–3]. Az immunsejtek, például a makrofágok beszivárgása és a zsírszövetben történő felhalmozódása eredményeként a gyulladásos prokaminok jelentősen előálltak; ezért bekövetkezik az elhízással járó gyulladás. Feltételezik, hogy a makrofágok kritikus szerepet játszanak az elhízással szorosan összefüggő zsírszöveti gyulladásban [4]. Egyre több bizonyíték bizonyítja, hogy a makrofágok aktiválása hozzájárul az M1- vagy M2-szerű makrofágokká történő differenciálódáshoz, amelyek teljesen eltérő génexpressziós profilokkal rendelkeznek. Korábban bebizonyosodott, hogy az M1 makrofágok közvetlen gyulladásos választ kezdeményeznek olyan proinflammatorikus citokinek előállítására, mint a tumor nekrózis faktor (TNF) -α, interleukin (IL) -6, monocita kemoattraktáns fehérje (MCP) -1 és argináz (ARG) 1, és végül hozzájárulnak az ezt követő inzulinrezisztencia kiváltásához [5,6]. A sovány zsírszövetből származó M2 makrofágokat azonban megemelt CD206, argináz-1, MglI és IL-10 jellemzi, és részt vesznek a szövetek javításában vagy átalakításában [7–9].
A bariatrikus eljárások, mint például a bal gyomorartér lekötése (LGAL), valamint a hüvelyes gasztrektómia (SG), fontos eljárásokként jelentek meg a kóros elhízás kezelésében, és hozzájárulnak a metabolikus funkció javításához és a tartós fogyáshoz [10–12]. Az SG, mint egy viszonylag kevésbé invazív bariatrikus eljárás, amely eltávolítja a gyomor körülbelül 80% -át, korlátozó tulajdonságokkal rendelkezik és figyelemre méltóan csökkenti az ételbevitelt [12,13]. Számos jelentés feltárta, hogy az LGAL képes szabályozni a testtömeget állatmodellekben [14,15]. Az azonban továbbra is vitatott, hogy az LGAL és az SG összehasonlítható mértékű súlycsökkenést és anyagcsere-javulást eredményez-e. Az LGAL és az SG hatása a gyulladásos válaszra, az inzulinjelzésre és a zsírszövetekbe történő makrofág infiltrációra, valamint a fogyás és az anyagcsere javulásának hátterében álló mechanizmusok továbbra sem ismertek. Ebben a tanulmányban összehasonlítottuk a posztoperatív eredményeket, mint például a fogyás, a gyulladásos citokinek, az inzulin jelátviteli út relatív fehérje, a zsíros makrofág infiltráció és a fenotípus transzformáció az étrend által kiváltott, elhízott patkányok kohorszaiban, amelyek LGAL-on és SG-n mentek keresztül.
Anyag és módszerek
Állatok és etikai nyilatkozat
Az egészséges hím, 8 hetes Sprague-Dawley (SD) patkányokat az SLAC Laboratory Animal Co.-tól (Shanghai, Kína) szereztük be, és egyedileg az állattartó létesítményben 24–26 ° C ellenőrzött éghajlaton és kb. 55 % 12 órás világos-sötét cikluson. A hím patkányokat véletlenszerűen kiosztották egy kontrollcsoportba vagy egy HFD csoportba, amelyet kontroll étrendi rágcsáló chow-val és magas zsírtartalmú diétás rágcsáló chow-val tápláltak (60% zsírtartalmú energia, Research Diets, SLAC Laboratory Animal Co.). 16 hetes zsírtartalmú étrendnek való kitettség után a HFD kohorsz patkányait véletlenszerűen a HFD Sham, HFD L és HFD SG csoportokba sorolták, és megfelelő műtéten estek át. Az összes patkányt 4 hét múlva leöltük a műtét után. Valamennyi patkányt az Országos Egészségügyi Intézet laboratóriumi állatok gondozására és felhasználására vonatkozó útmutatójának megfelelően kezeltük. A kutatást a Tongji Kórház Állattenyésztési és Hasznosítási Bizottsága hagyta jóvá, és az állati eljárások szigorúan követték a Tongji Kórház Etikai Bizottságának irányelveit.
Műtéti beavatkozások
Az elhízott patkányokat a műtét előtti éjszakán böjtölték. Az SG, LGAL vagy a megfelelő színlelt műtéteket 4% szevoflurán intraperitoneális injekcióval altatott patkányokon végeztük, amint arról korábban beszámoltunk. Röviden, az SG eljáráshoz a gyomor körülbelül 80% -át eltávolítottuk az antrumból a fundusig tartó nagyobb görbület mentén, amint arról korábban beszámoltunk. Az LGAL eljárás 3 cm-es középvonalú kivágásból és a bal gyomorartér lekötéséből állt, amint arról korábban beszámoltunk. A színlelt művelet 3 cm-es középvonal kimetszésből és gyomor expozícióból állt. A műtét után a patkányoknak azonnal szubkután injekciókat adtak steril normál sóoldatból, és 3 napig folyékony étrendet adtak nekik.
Szérum gyulladásos faktor vizsgálatok
A szérum TNF-α, IL-6 és MCP-1 szintjét enzimhez kapcsolt immunszorbens assay (ELISA) kit (Sigma-Aldrich, St Louis, MO, USA) segítségével mértük. Minden eljárást a gyártó utasításainak megfelelően hajtottak végre.
Kvantitatív valós idejű PCR (qPCR)
A teljes RNS-t a retroperitoneális és epididimális zsírszövetből TRIzol reagenssel (Molecular Research Center, Inc., Cincinnati, OH, USA) extraháltuk a gyártó utasításainak megfelelően. A cDNS-t teljes RNS-ből állítottuk elő Moloney Murine Leukemia Virus reverz transzkriptáz (Invitrogen, Carlsbad, CA, USA; Thermo Fisher Scientific, Inc., Waltham, MA, USA) felhasználásával. Az RT-PCR-hez használt primer szekvenciákat a
IL-6, előre: 5′-GGCGGATCGGATGTTGTGAT-3 ′,
TNF-α, előre: 5′-GCGGCCACAGAAAACACTC-3 ′,
MCP-1, előre: 5′-CTGAGTTGACTCCTACTGTGGA-3 ′,
ERK, előre: 5′-ACTGCTGGGCATAACGCTTTT-3 ′,
JNK, előre: 5′-CGCCAGTCGTGGAGGAAAA-3 ′,
NFκB, előre: 5′-ACACCTCTGCATATAGCGGC-3 ′,
béta-aktin, előre: 5′-GCCCTGAGGCTCTTTTCCAG-3 ′,
A szemikvantitív PCR-t egy Applied Biosystems 7300 qPCR rendszerrel (Applied Biosystems; Thermo Fisher Scientific, Inc.) végeztük hőkezeléssel, a korábban leírtak szerint. Az mRNS mennyiségét belső standardként GAPDH-ra normalizáltuk.
Western blottolás
Az összes fehérjét kivontuk és mennyiségileg meghatároztuk a sejtből vagy a retroperitoneális és epididymális zsírszövetből. Ezután minden mintából 30–50 μg fehérjét izoláltunk 10% -os SDS-PAGE alkalmazásával (halmozó gél, 50 V; elválasztó gél, 100 V), és átvittük a nitrocellulóz membránra (100 V, 75 perc). A membránokat blokkoltuk és primer antitestekkel, majd szekunder antitestekkel inkubáltuk. A torma peroxidázzal jelölt másodlagos antitesteket kemilumineszcenciával detektáltuk, és a fehérje sávok szürkeárnyalatát a Gel-pro Image Analysis Software (Media Cybernetics, Rockville, MD, USA) elemezte. A p-IRS (Cell Signaling Technology, Danvers, MA, USA), a p-Akt (Cell Signaling Technology, Danvers, MA, USA) és a béta-Actin (Cell Signaling Technology, Danvers, MA, USA) elleni elsődleges antitestek a következők voltak: ebben a tanulmányban használták.
Olajvörös festési protokoll a zsírszövethez
A metszeteket szárítottuk és 50% -os etanollal mostuk, majd 8 percig olajvörös etanol-festék oldattal tettük közzé. A differenciálást 50% -os etanollal és csapvízzel állítottuk le. Hematoxilint alkalmaztak a sejt ellenfestésére, a csapvíz visszaváltozott a kékre és a glicerin zselatin pecsétre.
Immunfluoreszcencia vizsgálat
A retroperitoneális és epididymális zsírszövetekből származó zsír (szövet) szövetekben a makrofág infiltrációkat immunfluoreszcenciával detektáltuk F4/80 és DAPI (kék) festéssel. Az F4/80 antitest a makrofágok markere. A 4,6-diamidino-2-fenil-indolt (DAPI) sejtmagokra festettük. A metszeteket anti-F4/80 antitesttel (1: 100; Invitrogen, Carlsbad, CA, USA) inkubáltuk egy éjszakán át 4 ° C-on, és 30 percig szekunder antitesttel inkubáltuk, majd képeket készítettünk.
Statisztikai analízis
Az adatokat átlag ± SEM formában mutatjuk be. A kétfarkú t tesztet a csoportok közötti különbségek értékelésére a GraphPad Prism 5.0 szoftver (GraphPad Software, Inc., La Jolla, CA, USA) alkalmazásával végeztük. A 0,05-nél kisebb p-értéket szignifikánsnak tekintették.
Eredmények
LGAL és SG csillapított, magas zsírtartalmú étrend okozta zsírfelhalmozódás és gyulladásos faktor expresszió retroperitoneális és epididymális zsírban
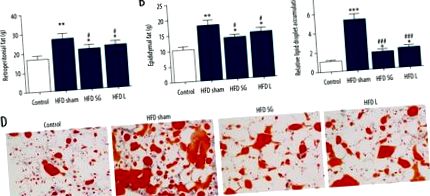
A retroperitoneális és epididymális zsír súlya szignifikánsan megnőtt az étrend által kiváltott elhízott patkányokban a kontroll csoporthoz képest, míg az LGAL és SG csökkentette ezt a súlyt (1A., 1B. Ábra). Az olajvörös festés azt is kimutatta, hogy a műtéti kezelés gátolja a HFD által kiváltott lipidcseppek lerakódását a zsírrészekben (1C. Ábra, 1D. Ábra).
A műtéti kezelés megfordította a magas zsírtartalmú étrend (HFD) által kiváltott retroperitoneális és epididymális zsír zsír felhalmozódását. A patkányokat 18 hétig HFD-vel etették, majd 4 hétig gyomor bal artéria lekötésével és hüvelyes gasztrektómiával kezelték. A retroperitoneumból és az epididymisből származó teljes zsírszövetet elválasztottuk és lemértük (A, B). A retroperitoneum (A) és az epididymis teljes zsírszövetének tömege (B). Az adatokat átlag ± SD-ként adjuk meg. * p # p 2. ábra). Az LGAL és SG kezelések összehasonlításakor az IL-6 csökkenése az LGAL csoportban volt a legkézenfekvőbb, de a TNF-α és MCP-1 expresszió az LGAL és SG kezelésekben nem különbözött szignifikánsan a HFD csoportokétól. Az ELISA f azt mutatta, hogy a HFD szignifikánsan indukálta a gyulladásos faktor IL-6, TNF-α és MCP-1 expresszióját a normál étrendhez képest. Az LGAL és SG kezelés szignifikánsan elnyomta a HFD által kiváltott IL-6, TNF-α és MCP-1 fokozott gyulladásos faktort is (3. ábra).
A gyulladásos tényezők kifejeződése retroperitoneális és epididymális zsírszövetben. A patkányokat 18 hétig HFD-vel etették, majd a gyomor bal artériájának lekötését és a hüvelyes gyomoreltávolítást 4 hétig. Az Rt-PCR kimutatásához a retroperitoneum és az epididymis zsírszövetét eltávolítottuk. (A – C) Az IL-6 expressziós szintje (A), TNF-α (B) és az MCP-1 (C) retroperitoneális zsírból különböző csoportokban. Az adatokat átlag ± SD-ként adjuk meg. *** p ## p ### p # p ## p ### p # p 4A, 4B ábra). F4/80 festéssel végzett immunfluoreszcencia vizsgálat azt mutatta, hogy a műtéti kezelés elősegíti a HFD által indukált F4/80 expressziót. Az LGAL és az SG fokozhatja a makrofágok beszivárgását a retroperitoneumból származó zsírszövetben (4C. Ábra, 4D. Ábra). Az eredmények azt mutatják, hogy az LGAL és az SG egyaránt szignifikánsan növelte az ARG-1 expressziót az mRNS-ben a HFD csoporthoz képest. Az iNOS expresszió nem változott az epididymis zsírszövetében (4E. Ábra, 4F). A makrofágok beszivárgása az epididymális zsírszövetben is megnőtt a műtét után, amint azt az F4/80 festés immunfluoreszcencia vizsgálata mutatja (4G. Ábra, 4H). Az eredmények együttvéve azt sugallják, hogy mindkét sebészeti kezelés fokozza a makrofágok beszivárgását és elősegíti az M2 makrofágok aktiválódását.
A bal artéria gyomor ligálásának és hüvelyes gasztrektómiájának hatása a p-IRS-1 és p-Akt fehérje expressziójára. (A) A Western blot detektálás a p-IRS-1 és a p-Akt expresszióját mutatja a retroperitoneális szövet zsírszövetében. (B) A Western blot detektálás a p-IRS-1 és a p-Akt expresszióját mutatja az epididymális zsírszövetben.
Köztudott, hogy az inzulin erősítheti a perifériás glükózfelvételt, különösen a zsírszövetben, és korlátozhatja a máj glükóztermelését. Miután az inzulin kötődött az inzulinra reagáló sejtek receptoraihoz, a tirozin maradványok foszforilációját az inzulin receptor szubsztrátokon (IRS) a tirozin kináz váltja ki. A foszforilezett IRS 1 (p-IRS 1) részt vesz a fehérjék dokkolásában, ezáltal aktiválja a jelátviteli kaszkádokat, majd Akt foszforilezés következik. A 4. típusú glükóz transzporter (GLUT4) Akt foszforilezéssel aktiválódik, az ezt követő glikogénszintézissel [17]. A glükózfelvétel fő sebességkorlátozó lépése a GLUT által közvetített glükóztranszport [18,19]. A GLUT4, amely elsősorban izom- és zsírszövetekben expresszálódik, kulcsfontosságú szerepet játszik a glükóz homeosztázisában. Ezek az eredmények azt mutatják, hogy az LGAL és az SG egyaránt javítja az inzulinérzékenységet. Kimutatták azt is, hogy az IRS és az Akt foszforilezésének gyulladáscsökkentő hatása van [20].
Az LGAL és az SG csökkentette az ERK, a JNK és az NF-κB jelátvitel által közvetített gyulladásos jel aktiválódását
A Western blot-analízis azt találta, hogy a HDF elősegítette az NF-κB, JNK és ERK foszforilációját a retroperitoneális és epididymális zsírszövetekben a normál étrendhez viszonyítva. Az LGAL és az SG szignifikánsan csökkentette az NF-κB, JNK és ERK foszforilációját (6. ábra). Egyre több bizonyíték mutatja, hogy a JNK és az ERK részt vesz a gyulladásban. A JNK és az ERK szignalizáció aktiválása fontos szerepet játszik a gyulladásos válaszok modulációjában és a makrofág fenotípus szabályozásában [20]. Az aktivált B-sejtek nukleáris faktor kappa-könnyűlánc-fokozója (NF-KB) kulcsfontosságú transzkripciós faktor, amelyet különféle ingerek gyorsan aktiválnak, növelve a proinflammatorikus citokinek (pl. MCP-1 és TNF-a) és az indukálható nitrogén-oxid expresszióját szintáz (iNOS), és részt vesz a gyulladásban [21]. A makrofágok részt vesznek az elhízás okozta zsírszöveti gyulladásban. A különféle extracelluláris jelek stimulálják az intracelluláris utakat és megváltoztatják a makrofágok szekréciós profilját, végül hozzájárulnak a gyulladás csillapításához vagy fokozásához [22]. Ez arra utal, hogy az LGAL és az SG elősegítheti az M2 makrofágok aktiválódását és megváltoztathatja a szekréciós profilt a gyulladásos szignálok szabályozásával.
A bal artéria gyomor-lekötésének és hüvelyes gasztrektómiájának hatása a gyulladásra és az inzulin jelzésére a relatív fehérje expresszióra. (A) A Western blot az ERK, JNK és NFκB expresszióját mutatja retroperitoneális zsírszövetben. (B) A Western blot kimutatás megmutatja az ERK, JNK és NF-κB expresszióját az epididymális zsírszövetben.
Vita
Az elhízás alacsony fokú gyulladáshoz és inzulinrezisztenciához kapcsolódik, és részt vesz a glükóz és a lipid anyagcserében [22]. A legfrissebb eredmények azt sugallják, hogy a bariatrikus műtét a leghatékonyabb elhízáskezelés, mind hatásainak nagyságában, mind tartósságában [23,24]. Egyes bizonyítékok azt mutatják, hogy az LGAL és az SG csökkentheti az elhízást [25,26]. Ezért a jelen tanulmány célja az LGAL és SG hatása volt a gyulladásos tényezők expressziójára a zsírszövetben. Meg kell tisztáznunk a gyulladás és az inzulinrezisztencia szerepét a molekuláris és sejtes mechanizmusokhoz képest.
Megállapítottuk, hogy a HFD elősegíti a lipidfelhalmozódást mind a retroperitoneális, mind az epididymális zsírszövetekben. Az LGAL és az SG megfordítja ezt a jelenséget. Ez arra utal, hogy az LGAL és az SG ugyanolyan súlycsökkentő hatással bír. Az SG-nek minimális a malabszorpció kockázata a tápanyagáramlás változatlan útja miatt a hüvelyes gyomoreltávolítás után, de az SG-vel összehasonlítva az LGAL-nak több előnye van a fájdalom és a vérzés csökkentésében. Ezek az eredmények összhangban vannak a korábbi jelentésekkel [27].
További kutatások azt is megállapították, hogy a műtéti kezelés fokozta az inzulin jelátvitelt a PI3K/AKT inzulin receptor jelzésén keresztül, amelyet a HFD indukció elnyomott. A műtéti kezelés jelentősen csökkentette az NFκB, JNK és ERK foszforilációját, ami csökkent gyulladásos génexpressziót eredményezett [32].
Következtetések
Adataink azt mutatják, hogy az LGAL és az SG egyaránt gátolhatja a HFD által kiváltott krónikus gyulladást a zsírszövetben az M2 makrofágok elősegítésével és a gyulladásgátló szignál útjának elnyomásával. Eredményeink azt is jelzik, hogy a bariatrikus műtét növelheti az inzulinérzékenységet. A biztonság és a sérülés súlyosságának fényében az LGAL nagyobb klinikai alkalmazási lehetőséggel rendelkezik a fogyás terén.
Lábjegyzetek
A támogatás forrása: Ezt a munkát a Kínai Nemzeti Természettudományi Alapítvány (támogatás száma: 81200244) támogatta Xiao-Yun Xie, a Kínai Nemzeti Természettudományi Alapítvány (támogatás száma: 81570738) Xiao-Yun Xie számára, Hunan tartomány tudományos és technológiai osztályának ( Támogatás: 2015JC3130) Zhi-Hong Li, Chenzhou város Tudományos és Technológiai Irodája (CZ2013081 támogatás), Zhi-Hong Li, Shanghai Pudong New Area District Tudományos Fejlesztési Alap, (PKJ2015-Y39 támogatás száma) Jiang számára Han és a Shanghai Pudong New Area District Zhoupu Kórház főtárgyépítési alapja (támogatás száma: ZP-xk-2015B-4) Jiang Han számára
- A súlycsökkenés jelentésének összehasonlíthatósága a gyomor bypass és hüvelyes gastrectomia után BOLD adatok felhasználásával
- A gyomortérfogat és a fogyás összefüggése 5 évvel a hüvelyes gasztrektómia után SpringerLink
- Endoszkópos hüvelyes gasztroplasztika, laparoszkópos hüvelyes gasztrektómia és laparoszkópos szalag a súlyhoz
- Erica drámai gyomorhüvelyi műtétének átalakulása
- A határok EGCG csökkenti az elhízást és a fehér zsírszövet nyereségét részben az egerek AMPK-aktiválásával