A CREG1 serkenti a barna adipocita képződést és javítja az étrend okozta elhízást egerekben
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Ezek a szerzők egyformán járultak hozzá ehhez a munkához. Keressen további cikkeket a szerzőtől
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Táplálkozási és Élelmiszertudományi Tanszék, Bölcsészettudományi Kar, Tezukayama Gakuin Egyetem, Sakai, Japán
Ezek a szerzők egyformán járultak hozzá ehhez a munkához. Keressen további cikkeket a szerzőtől
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Integratív Élettani Tanszék, Nagoya Egyetem Orvostudományi Kar, Nagoya, Japán
Táplálkozási és Élelmiszertudományi Tanszék, Bölcsészettudományi Kar, Tezukayama Gakuin Egyetem, Sakai, Japán
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Levelezés: Chubu Egyetem, Orvosi és Orvostudományi Főiskola, Orvostudományi Tanszék, 1200 Matsumoto ‐ cho, Kasugai 487-8501, Japán. E-mail: [email protected]
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Ezek a szerzők egyformán járultak hozzá ehhez a munkához. Keressen további cikkeket a szerzőtől
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Táplálkozási és Élelmiszertudományi Tanszék, Bölcsészettudományi Kar, Tezukayama Gakuin Egyetem, Sakai, Japán
Ezek a szerzők egyformán járultak hozzá ehhez a munkához. Keressen további cikkeket a szerzőtől
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Integratív Élettani Tanszék, Nagoya Egyetem Orvostudományi Kar, Nagoya, Japán
Táplálkozási és Élelmiszertudományi Tanszék, Bölcsészettudományi Kar, Tezukayama Gakuin Egyetem, Sakai, Japán
Orvostudományi Tanszék, Élet- és Egészségtudományi Főiskola, Chubu Egyetem, Kasugai, Japán
Levelezés: Chubu Egyetem, Orvosi és Orvostudományi Főiskola, Orvostudományi Tanszék, 1200 Matsumoto ‐ cho, Kasugai 487-8501, Japán. E-mail: [email protected]
ABSZTRAKT
RÖVIDÍTÉSEK
ANYAGOK ÉS METÓDUSOK
Állatok
Glükóz- és inzulin-tolerancia tesztek
Az intraperitoneális glükóz-tolerancia tesztet (IPGTT) 1,5 mg glükóz/testtömeg-gáz alkalmazásával hajtották végre, miután 17 órán át visszatartotta az ételt, ahogyan Wang korábban leírta et al (24) Az inzulin-tolerancia tesztet (ITT) 0,75 U inzulin/testtömeg-kg alkalmazásával végeztük 4 órás éhezés után. A vércukorszintet glükométerrel (NovoAssist Plus; Novo Nordisk, Bagsværd, Dánia) határoztuk meg glükózinjekció előtt (0 perc) és 30,60,90, valamint 120 perccel az injekció beadása után.
Lipidmérés
A szérum trigliceridszintet és az összkoleszterinszintet triglicerid E-teszt és teljes koleszterin E-teszt készletek (Wako Pure Chemicals, Osaka, Japán) alkalmazásával mértük. Az összes májlipidet extraháltuk az előzőekben leírtak szerint (25), és az extraktumokban lévő lipidszinteket a kereskedelmi készletek segítségével meghatároztuk.
Közvetett kalorimetria
A vad típusú (WT) és a Creg1-Tg egerekben a Vo2 értékét közvetett kalorimetriával értékeltük, amint azt korábban leírtuk (25). 23 hetes korban az egereket egyenként elhelyezték egy 4-kamrás Oxymax Lab Animal Monitoring Systemben (Columbus Instruments, Columbus, OH, USA), és 1 napig akklimatizálták őket, mielőtt bármilyen kísérletet megkezdtek volna. Minden egér Vo2- és CO2-termelési sebességét 5 percenként, 24 órán keresztül mértük normál mérési körülmények között, majd a β3-adrenerg receptor-specifikus agonista dinátrium 5 - [(2R) ‐2 - [[(2R) -2- (3-klórfenil) -2-hidroxi-emil] amino] propil] -l, 3-benzodioxol-2,2-dikarboxilát-hidrátot (CL316,243) (MilliporeSigma, Burlington, MA, USA) intraperitoneálisan injektáltunk egy adag 1 mg/testtömeg-kg. A kísérlet során egereket kaptunk ad libitum élelmiszerhez (HF diéta) és vízhez való hozzáférés.
Adeno-társított víruskísérlet
A megfelelő DNS-szekvenciák a rövid hajtű-RNS (shRNS) szekvenciáit CREG1 (5'-CACCGCCACTATCTC-CACAATAAAGCGAACTTTATTGTGGAGATAGTGGC-3 'és 5' -AAAAGCTACGCTGACTATGTCTTTATTCGTAA-AGACATAGTCAGCGTAGC-3 ') összeforrasztjuk és ligáljuk a shRNS expressziós vektorba pAAV-U6-ZsGreenl (Takara Bio, Kiotó, Japán). A CREG1 rekombináns adeno-asszociált vírus (AAV) 6-expresszáló shRNS-jét a gyártó utasításainak megfelelően állítottuk elő. Negatív kontrollként a LacZ rekombináns AAV6-expresszáló shRNS-jét is létrehoztuk. Az AAV részecskéket az AAVpro tisztító készlet (Takara Bio) segítségével tisztítottuk. A vírustitereket (vírusgenomok milliliterenként) kvantitatív PCR-rel határoztuk meg. Az AAV vektorok beadási kísérleteiben a hím C57BL/6J egereket (8 hét) izofluránnal altattuk. Az interscapularis régiót borító bőrt bemetszettük, és mindegyik interscapularis BAT (iBAT) párna 2 injekciót kapott 20 µl AAV6 vektoroldatból (4 × 1012 vírusgenom milliliterenként). Ezeket az egereket 2 hétig tartottuk, és az elemzéshez mintát vettünk.
Adipocita differenciálódás
Gén-expresszió elemzés
A teljes RNS-t Trizol reagenssel (Thermo Fisher Scientific) extraháltuk a gyártó protokollja szerint. Az mRNS expressziós szintjének számszerűsítéséhez a szövetekből vagy tenyésztett sejtekből származó RNS-eket a gyártó utasításainak megfelelően nagy kapacitású cDNS reverz transzkripciós készletek (Thermo Fisher Scientific) alkalmazásával fordítottuk át, és valós idejű RT-PCR elemzést végeztünk Light-Cycler és FastStart DNS Master és Sybr Green I (Roche, Bázel, Svájc). Minden gén-expressziós adatot normalizáltunk a 36B4 szinthez viszonyítva. Az alkalmazott oligonukleotid primer készleteket a asztal 1.
| 36b4 | TCATCCAGCAGGTGTTTGACA | CCCATTGATGATGGAGTGTGG |
| Adipoq | TGTTGGAATGACAGGAGCTGAA | CACACTGAACGCTGAGCGATAC |
| Cd137 | GAGCTAACGAAGCAGGGTTG | GGGAGAGAAGCTCACCACAG |
| Cidea | ATCACAACTGGCCTGGTTACG | TACTACCCGGTGTCCATTTCT |
| Idézett1 | ATGCCAACCAGGAGATGAAC | AGGATGCAGGTTGAAGGATG |
| Creg1 | GACCTGCAGGAAAATCCAGA | AACAAACAGCGAATCCCTTG |
| Elovl3 | TCCGCGTTCTCATGTAGGTCT | GGACCTGATGCAACCCTATGA |
| Fabp4 | CCGCAGACGACAGGA | CTCATGCCCTTTCATAAACT |
| Fgf21 | GTGTCAAAGCCTCTAGGTTTCTT | GGTACACATTGTAACCGTCCTC |
| Igf2r | GCACCAAGATGAAGCAGTCA | ACATCCGGTAGCTGTTGGTC |
| Ppargcla | TAGGCCCAGGTACGACAGC | GCTCTTTGCGGTATTCATCC |
| Prdm16 | GACATTCCAATCCCACCAGA | CACCTCTGTATCCGTCAGCA |
| Tbx1 | CGACAAGCTGAAACTGACCA | GTGACTGCAGTGAAGCGTGT |
| Ucp1 | GTGAAGGTCAGAATGCAAGC | AGGGCCCCTTCATGAGGTC |
- 36b4, riboszomális fehérje laterális szár P0 alegység; Ppargcla, PPARG 1 alfa koaktivátor.
Szövettani elemzés
A rögzített szöveteket paraffinviaszba ágyazottuk, 6 µm vastagságban metszettük, és hematoxilinnal és eozinnal (H&E) festettük. A lipidfestéshez a szöveteket 4% paraformaldehidben és PBS-ben rögzítettük, és 8 µm-nél metszett, Olajvörös O-val festett Tissue-Tek Optimal Vágási Hőmérsékletű Vegyületbe (Sakura Finetek, Tokió, Japán) ágyazottuk. A festett lipidcseppek által elfoglalt helyet a véletlenszerűen kiválasztott képek × 20 mezők (4–5 kép/egér) és az ImageJ (National Institutes of Health, Bethesda, MD, USA) segítségével számítottuk ki. Az UCP1 festéshez soros 4 µm vastag metszeteket vágunk, paraffinizálunk, xilolon és etanolon keresztül rehidratálunk, és 3% H2O2-val kezeljük abszolút metanolban 20 percig az endogén peroxidáz aktivitás blokkolásához. Az antigén visszaszerzéséhez a tárgylemezeket 0,01 M nátrium-citrátba (pH 6,0) merítettük és 20 percig 96 ° C-ra melegítettük laboratóriumi mikrohullámú sütőben vagy Liberate Antitest Binding Solution-ban (Polysciences, Warrington, PA, USA) szobahőmérsékleten 10 percig. . A tárgylemezeket 5-10% normál szamár szérummal PBS-ben 60 percig blokkoltuk, és egy éjszakán át 4 ° C-on inkubáltuk nyúl poliklonális anti-UCP1 elsődleges antitesttel (ab23841; Abcam) 1: 200 arányban hígítva PBS-ben, amely normál szamár szérumot tartalmazott 2,5-10% -ban. . Az elsődleges antitestkötést torma-peroxidázzal konjugált anti-nyúl IgG-vel (414341; Nichirei Corporation, Tokió, Japán) inkubálva 1 órán át szobahőmérsékleten inkubáljuk. A címkézést 3,3′-diaminobenzidin szubsztrátkészlet segítségével tettük láthatóvá a peroxidáz számára (SK-4100; Vector Laboratories). Az ellenfestést Mayer hematoxylinnel (Wako Pure Chemicals) végeztük. Az immunfluoreszcencia elemzések során a tárgylemezeket 10% normál szamár szérummal és tisztított anti-egér CD16/32 antitesttel (1:50; 93,101301 klón; BioLegend, San Diego, Kalifornia, USA) blokkoltuk PBS-ben 60 percig, majd inkubáltuk ( egy éjszakán át 4 ° C-on) kecske anti-CREG1 primer antitesttel (1:50; C-17, sc-11728; Santa Cruz Biotechnology, Dallas, TX, USA) és nyúl poliklonális anti-UCP1 antitesttel (1:50; ab23841; Abcam). A festést úgy tettük láthatóvá, hogy metszeteket inkubáltunk Alexa 488-konjugált anti-nyúl IgG-vel (1: 500; abl50061; Abeam) és Alexa 594-konjugált anti-kecske IgG-vel (1: 500; Thermo Fisher Scientific) 60 percig szobahőmérsékleten. A metszeteket ellenfestettük DAPI-t tartalmazó VectaShield Mounting Medium alkalmazásával.
Fehérje elemzés
Statisztikai analízis
Az adatokat átlag ± félként fejezzük ki. Az egérvizsgálatok 2 csoportja közötti különbségeket, beleértve a testtömeg, valamint az IPGTT, az ITT és az indirekt kalorimetria eredményeinek különbségeit, ismételt mérésekkel, kétirányú ANOVA alkalmazásával elemeztük. Fisher PLSD post hoc tesztet alkalmaztak, amikor szignifikáns különbségeket találtak. Más statisztikai összehasonlításokat kétfarkú Student-ek segítségével végeztünk t teszt. Értékei P
EREDMÉNYEK
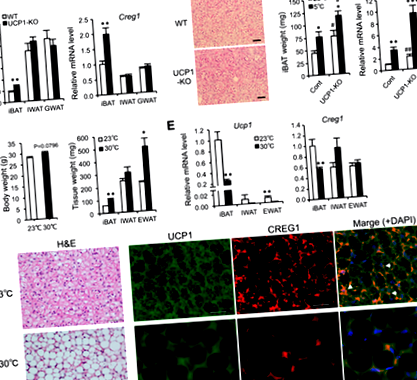
Creg1 kifejezés pozitívan kapcsolódik a BAT kialakulásához
Creg1 kifejezés pozitívan korrelál a Ucp1 expresszió primer adipocita kultúrában
Barna adipocita képződés in Creg1- a csendes iBAT-ot megmenti az exogén CREG1 ellátás
A CREG1 kötődik az RXR-α-hoz, valamint az IGF2R-hez
Nemrégiben beszámoltunk arról, hogy a CREG1 a barna adipogenezist stimuláló mechanizmusaként a CREG1 Ucp1 transzkripció a T3-mal és az RA-val együttműködve, ami a CREG1 és a THR vagy az RXR közötti lehetséges funkcionális kapcsolatra utal (22). Ezért megvizsgáltuk, hogy a CREG1 közvetlenül kötődik-e a THR-hez vagy az RXR-hez. Miénkben in vitro kísérletek, amelyekben a CREG1 és az IGF2R közötti kötést megerősítették, amint arról beszámoltunk (30), az RXR-α, de nem a THR-α kötődött a CREG1-hez (Ábra. 4A, B). A CREG1 kötődését pRb-vel sem tudtuk kimutatni, bár a Veal egy korábbi tanulmánya et al. (17) beszámolt interakciójukról in vitro. Az RXR-α CREG1-hez való kötődését immunprecipitációs elemzéssel igazoltuk (4. ábraC). Az RXR-α és a THR-α közötti kötődést immunprecipitációs kísérletben is megerősítették, amint arról korábban beszámoltunk (31) (4. ábraC). Ezek az eredmények arra utalnak, hogy a CREG1 az RXR-α-val hat, amely együttműködhet a THR-ekkel egy heterodimer komplex kialakításán keresztül a célgének átírására, mint pl. Ucp1 részt vesz a barna adipogenezisben.
A fokozott CREG1 expresszió a zsírszövetekben stimulálja a barnulást és javítja a DIO-t
Emellett elvégeztük az UCP1 és a CREG1 expressziójának immunológiai elemzését a zsírszövetekben. A szövettani festés feltűnő változásokat mutatott ki a Tg egerekben a WT egerekhez képest az iBAT barna adipocita morfológiájában, valamint az IWAT és RWAT barnulása erős UCP1 immunreaktivitással párosulva (Ábra. 6.A, B). Az adipocita méretek kisebbek voltak a Tg egerek minden zsírszövetében, mint a WT egerekben (6. ábraC), amely területenként nagyobb számú barna adipocitát mutat a Tg egerekben, mint a WT egerekben. Sőt, a Western blot eredmények azt mutatták, hogy a TRE egerek szérum- és zsírszövetében a CREG1 szint megközelítőleg kétszerese volt a WT egerekben mért szinteknek (6. ábraD, E). Az UCP1 fehérje expressziója a zsírszövetekben szintén szignifikánsan magasabb volt a Tg egerekben, mint a WT egerekben (6. ábraD, F), amely egyetért az immunhisztológiai elemzés eredményeivel (6. ábraA, B). Ezek az eredmények azt mutatják, hogy a CREG1 növekedése a zsírszövetekben lényegesen stimulálja a barnulást és az UCP1 expressziót egerekben.
A fokozott CREG1 expresszió felgyorsítja a barna adipogenezist az elsődleges adipocita kultúrában
VITA
KÖSZÖNETNYILVÁNÍTÁS
A szerzők köszönetet mondanak Y. Yamashitának, Y. Ohminak, A. Nozakinak és Y. Endo-nak (mind a Chubu Egyetemtől) a technikai támogatásért, és Dr. Y. Kamei-nek (Kiotói prefektúra Egyetem) az adipocita protein 2 promóterért. Ezt a munkát az Oktatási, Kulturális, Sport-, Tudományos és Technológiai Minisztérium (MEXT) támogatásával támogatták a Magánegyetemek Stratégiai Kutatási Alapítványának (S1201007), a tudományos kutatáshoz nyújtott támogatás (Kakenhi) a Japán Tudománytámogató Társaságtól (24580499 és 15K07846 támogatás HY-nek, 15K07446 TK-nak és 16K21453 MH-nak) és Chubu Egyetem A-támogatás (HY-nek). A szerzők nem jelentenek összeférhetetlenséget.
A SZERZŐ HOZZÁJÁRULÁSAI
H. Yamashita megalkotta a kísérleteket; T. Kusudo és H. Yamashita tervezték a kísérleteket; minden szerző elvégezte a kísérleteket és elemezte az adatokat; és H. Yamashita megírta a kéziratot.
- A magas zsírtartalmú étrendben a magas zsírtartalmú étrend okozta transzfat főzet hatása elhízás egerekre Journal of Food
- Az étrend által kiváltott zsírbetegség megváltoztatja a gyulladás szérumprofilját a C57BL6N egerekben, amelyet a
- A fokhagymaolaj elnyomja a magas zsírtartalmú étrend okozta elhízást patkányokban az UCP-1 és
- A fokhagymaolaj elnyomja a magas zsírtartalmú étrend okozta elhízást patkányokban az UCP-1 és
- Az étrend okozta elhízás - áttekintés a ScienceDirect témákról