Az ózonterápia gyengíti az NF-κB által közvetített helyi gyulladásos választ és a Th17 sejtek aktiválódását a pikkelysömör kezelésében.
Jinrong Zeng
1 Bőrgyógyászati Osztály, Harmadik Hsziangya Kórház, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Li Lei
1 Bőrgyógyászati Osztály, Harmadik Hsziangya Kórház, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Qinghai Zeng
1 Bőrgyógyászati Osztály, Harmadik Hsziangya Kórház, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Yuying Yao
2 XiangYa Orvostudományi Kar, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Yuqing Wu
2 XiangYa Orvostudományi Kar, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Qinxuan Li
2 XiangYa Orvostudományi Kar, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Lihua Gao
1 Bőrgyógyászati Osztály, Harmadik Hsziangya Kórház, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Hongjiao Du
1 Bőrgyógyászati Osztály, Harmadik Hsziangya Kórház, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Yajie Xie
1 Bőrgyógyászati Osztály, Harmadik Hsziangya Kórház, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Jinhua Huang
1 Bőrgyógyászati Osztály, Harmadik Hsziangya Kórház, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Wenbin Tan
3 Orvostudományi Kar Sejtbiológiai és Anatómiai Tanszéke és
4 Orvostechnikai Tanszék, Műszaki és Számítástechnikai Főiskola, University of South Carolina, Columbia, South Carolina
Jianyun Lu
1 Bőrgyógyászati Osztály, Harmadik Hsziangya Kórház, Közép-Déli Egyetem, Changsha, Hunan, Kína;
Társított adatok
Absztrakt
Bevezetés
Az ózont erősen oxidáló tulajdonsága miatt először klinikailag sterilizáló szerként alkalmazták. Széles körben alkalmazták több mint 50 különféle kóros állapot kezelésére, ideértve a 15-18 fertőző bőrbetegségeket, 19, 20 allergiás betegségeket, a pikkelyes erythema betegségeket 21, 22, a sebgyógyulást és a fekély helyreállítását 23. Az ózon hatásmechanizmusai megalapozhatják az antimikrobiális hatásokat, az immunszabályozást, az antioxidáns védekezést, az epigenetikai módosítást, a bioszintézist, a fájdalomcsillapítókat és az értágulatokat 24. A bőrgyógyászatra vonatkozó jelenlegi ózongyógyászati készítmények a következő első osztályozásba tartoznak: ózon hidroterápia, helyi ozonált olaj, ózon autohemoterápia (OAHT) és ózon gáz üreg/akupunkt injekció 24. A legújabb vizsgálatok kimutatták, hogy az ózonkoncentrációk pontos szabályozása különféle citokinek, például IFN-γ, IL-6 és TNF-α 25 termelését indukálhatja. Az ózon indukálhatja és aktiválhatja a szervezet antioxidáns enzimrendszerét, hogy szabad gyököket eltávolító szereket állítson elő, eltávolítsa a gyulladásos reakciók által generált szabad gyökök egy részét, és zavarja a gyulladásos faktorok termelését a betegség kialakulása során Az ózonterápia pontos mechanizmusait azonban a betegségek kezelésében tovább kell tisztázni.
Ebben a tanulmányban egy rövid távú ózonkezelés terápiás hatékonyságát értékeltük pikkelysömörben szenvedő betegeknél. Megvizsgáltuk a helyi ózonterápia lehetséges mechanizmusait a pikkelysömörhöz az imikimod- (IMQ) indukálta pikkelysömör-szerű egér modell alkalmazásával. Megállapítottuk, hogy az ózonterápia gyengítette a gyulladásos reakciókat a pikkelysömörben az NF-κB útvonal gátlásával. Eredményeink azt mutatják, hogy az ózonterápia biztonságos és hatékony kezelés a pikkelysömörben, és érdemes további klinikai értékelésekre és alkalmazásokra.
Anyagok és metódusok
Betegek
Ezt a tanulmányt a Kínai Hunan, Changsha Közép-Déli Egyetem, Harmadik Hsziangya Kórház intézményi felülvizsgálati testülete (IRB) hagyta jóvá. Összesen 10 psoriasisos vulgaris diagnosztizált pszoriázisos beteget vontak be a vizsgálatba, és az írásbeli beleegyező űrlapokat minden alany aláírta. A betegekkel kapcsolatos klinikai információkat az 1. kiegészítő táblázat tartalmazza. A betegség aktivitásának értékelésére PASI-pontszámokat használtak. A vizsgálatba való felvétel kritériumai 18 és 60 év közötti, patológiás vizsgálatokkal diagnosztizált vulgaris pikkelysömörrel rendelkezőkre vonatkoztak. A kizárási kritériumok között szerepel az ózonozott vízre vagy olajra való allergia; terhesség vagy szoptatás; súlyos szisztémás betegségek; és az előző 2 hétben kortikoszteroidokat, D3-vitamin-származékokat, immungátlókat, biológiai terápiát vagy orális retinoidokat kapott.
A BALB/c egereket a Hunan SJA Laboratory Animal Co., Ltd.-től szereztük be. 6 hetes korukban a nőstény egereket egy hétig adaptív módon etették és minden kísérlethez felhasználták. Valamennyi állatot a Közép-Dél Egyetem állatkísérleti központjában nevelték és kezelték, szigorúan a vonatkozó törvényeknek és intézményi irányelveknek megfelelően. Valamennyi állatkísérletet a Közép-Déli Egyetem Harmadik Hsziangya Kórházának Gyógyszer-állattartó és -használati Bizottsága hagyta jóvá és felügyelte.
Helyi ózonterápia
Valamennyi résztvevőt ozonizált vizes zuhannyal (3,0 ± 1,5 mg/l, HZ-2601B, Hunan Health Care Technology, Changsha, Kína) kezeltük 15 percig, naponta egyszer, majd helyi ozonozott olajjal (20160522, hozzávetőleges peroxid értéke 2000–2400 mmol-ekvivalens/kg, Hunan Health Care Technology, Changsha, Kína) naponta kétszer, 14 napig.
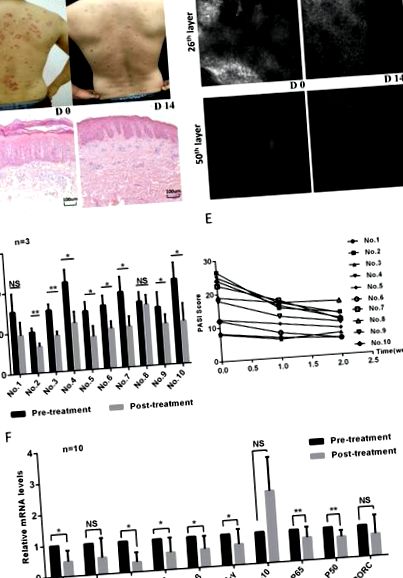
A bőrelváltozások klinikai fényképeinek és reflexiós konfokális mikroszkóp képeinek értékelése
Minden alany csak ingyenes ózonterápiát kapott; a kezelés során nem kaptak más kezelést és gyógyszert. A beavatkozás 14 napig tartott. A klinikai fényképeket, a PASI-pontszámokat és az RCM-képeket ugyanazok a hivatásos orvosok értékelték a betegség súlyosságának értékelése érdekében a kezelések előtt és után. A PASI-pontszámok a bőrelváltozások, az erythema, a pikkelyezés és a megvastagodás területét tartalmazták az irodalom szerint 27. Mindegyik alanyot három különböző bőrelváltozás helyének RCM képeivel értékeltük. A bőr összes RCM-beolvasott vastagsága minden rétegben 51 réteg × 3,05 µm (függőlegesen) volt. RCM alatt az epidermális vastagságot és az infiltrált gyulladásos sejteket is értékeltük a kezelés előtt és után.
IMQ-indukált egérmodell a pikkelysömörről és az ózonintervencióról
A BALB/c nőstény (6-8 hetes) egereket megfelelő körülmények között etettük. Az egereket naponta egy 5% -os IMQ krémmel (Sichuan Med-Shine Pharmaceutical Co., Ltd., H20030128, Sichuan, Kína) kenjük be borotvált hátbőrükön 7 egymást követő napon. A kontrollcsoport egereit ugyanolyan mennyiségű vivőanyag-krémmel kezeltük. Az összes IMQ egeret véletlenszerűen három csoportra osztottuk: a nemintervenciós csoportra (IMQ csoport), az ózonkezelő csoportra (IMQ + ózon) és a hordozó krémmel kezelt csoportra (IMQ + jármű). Az ózonkezelő csoportot ozonizált vízzel kezelték (HZ-2601B, Hunan Health Care Technology Co., Ltd., Changsha, Kína) naponta egyszer 15 percig, majd helyi ózonozott olajjal kezelték (20160522, Hunan Health Care Technology Co ., Ltd., Changsha, Kína). A hordozó krémmel kezelt csoport ugyanolyan gyakorisággal kapott csapvizet és bázisolajat. A beavatkozás 7 napig tartott. A fenotípusos jellemzők értékeléséhez klinikai fényképeket és PASI-pontszámokat gyűjtöttünk. A 7. napon az összes egeret feláldoztuk a bőrelváltozások, lépszövetek és nyirokcsomók összegyűjtésére.
CD4 + T-sejtek izolálása
A perifériás vér mononukleáris sejtjeit (PBMC) a betegek perifériás vérétől a kezelés előtt és után centrifugálással választottuk el sűrűséggradiens táptalaj alkalmazásával (GE Healthcare, Chicago, IL, USA). A CD4 + T-sejteket pozitív szelekcióval izoláltuk Miltenyi gyöngyökkel, a gyártó utasításainak megfelelően (Miltenyi Biotec, Bergisch Gladbach, Németország). Ezután az izolált CD4 + T-sejteket gyűjtöttük a későbbi kísérletekhez. Az egérkísérletben a CD4 + T-sejteket a lép egyesített egysejtű szuszpenzióiból tisztítottuk a Miltenyi Biotec (Bergisch Gladbach, Németország) egér CD4 + T-sejt izoláló készletével.
Áramlási citometria
A teljes RNS-t a sejtekből vagy a bőrszövetekből TRIzol alkalmazásával extraháltuk a gyártó utasításai szerint (Thermo Fisher Scientific, Waltham, MA, USA). Az mRNS-t reverz átírással írtuk le PrimeScript® RT reagenskészlettel (Takara Biomedical Technology Co., Ltd., Kusatsu, Shiga, Japán), minden reakcióban 1 μg teljes RNS-sel. A valós idejű PCR reakcióelegye 2 μl cDNS-t, 10 μL SYBR Premix Ex Taq ™ -ot (Takara Biomedical Technology Co., Ltd., Kusatsu, Shiga, Japán) és 400 nM érzéki és antiszensz primereket tartalmazott térfogata 20 μL. A qPCR-t egy LightCycler® 96 (Roche, Rotkreuz, Svájc) termocikluson végeztük. A génexpresszió mennyiségét a 2-ACt módszerrel számoltuk ki, és gliceraldehid-3-foszfát-dehidrogenázra (GAPDH) normalizáltuk. Az alapozókat a 2. kiegészítő táblázat mutatja.
Western Blotting
A CD4 + T-sejteket lizáltuk, és a fehérjéket nukleáris extrakciós reagenssel extraháltuk (Boster Biological Technology, Pleasanton, CA, USA). A fehérjéket a Bradford-reagenssel (Thermo Fisher Scientific, Waltham, MA, USA) számszerűsítettük, majd 12% -os vertikális dodecil-szulfát-poliakrilamid gélelektroforézissel. A fehérjéket ezután egy polivinilidén-difluorid (PVDF) membránba vittük át (Sigma-Aldrich, St. Louis, MO, USA). A PVDF membránt 5% sovány tejben blokkoltuk 1 órán át szobahőmérsékleten, majd P65 (GB11142, 1: 1000, Wuhan Servicebio Technology Co., Ltd., Wuhan, Kína) vagy P50 (ab7971, 1: 5000, Abcam, Cambridge, MA, USA) 12-16 órán át 4 ° C-on, majd inkubálás egér nyúlellenes IgG antitesttel (H&L) (GenScript, Piscataway, NJ, USA). A fehérjéket fokozott kemilumineszcencia (ECL) Western blot detektáló készlettel detektáltuk (Thermo Fisher Scientific, Waltham, MA, USA). A P65 és P50 mennyiségi meghatározását densitometriával normalizáltuk GAPDH-ra.
Szövettani elemzés
Az összes beteg és egér bőrszöveteit formalinban rögzítették és paraffinba ágyazták (Wuhan Servicebio Technology Co., Ltd., Wuhan, Kína). A metszeteket (6 um) hematoxilinnal és eozinnal festettük és szobahőmérsékleten tároltuk. Megvizsgáltuk az epidermális vastagságot és az infiltrálódó gyulladásos sejteket.
Immunhisztokémiai festés
A metszeteket (6 µm) P50 (katalógusszám: BS1249, Bioworld Technology Co., Ltd., Nanjing, Kína), P65 (katalógusszám: 10745-1-AP, Proteintech, Rosemont, IL, USA) és TLR2 antitestekkel festettük. (katalógusszám: ab213676, Abcam, Cambridge, MA, USA) a gyártói utasításoknak megfelelően. A képelemzést fluoreszcens mikroszkóp és Leica Qwin Std elemző szoftver segítségével végeztük (Leica, Wetzlar, Németország).
Nagy áteresztőképességű szekvenálás
Az önkontrollos egérmodellekből származó bőrelváltozások bal és jobb oldalának transzkriptóm profilját kaptuk, valamint a kontrollcsoport és az IMQ csoport egér háti bőrének elváltozásait. Röviden: ezekből a bőrmintákból teljes RNS-t extraháltunk; az mRNS-t dúsítottuk, fragmentáltuk és felhasználtuk a cDNS-szintézishez. A cDNS-fragmenseket PCR-rel amplifikáltuk, és a szekvenáló könyvtár méretét és minőségét meghatároztuk egy Agilent 2100 Bioanalyzer segítségével (Agilent, Santa Clara, CA, USA). A könyvtárat HiSeq X Ten nagy áteresztőképességű szekvenáló platform (Illumina Inc., San Diego, Kalifornia, USA) segítségével szekvenáltuk. A kiválasztott minták között a differenciálisan expresszált géneket a Kyoto Encyclopedia of Genes and Genomes (KEGG) útvonal-dúsítási elemzéssel elemeztük.
Statisztikai analízis
A helyi ózonkezelés jelentősen gátolja a TLR2/NF-κB jelátvitelt. a) A TLR2, P50 és P65 expressziós szintjét a Ctrl, IMQ, IMQ + Vehicle és IMQ + Ozone csoportok bőrelváltozásaiban immunhisztokémiai analízissel értékeltük. b) A TLR2, P50 és P65 expressziós szintje IMQ által kiváltott önkontroll egér bőrelváltozásokban és c) emberi pikkelysömör elváltozások az ózonkezelés előtt és után.
A Th17 differenciálódás gátlása helyi ózonkezeléssel
A pikkelysömör krónikusan kiújuló gyulladásos bőrbetegség. Megállapítottuk, hogy az ózonterápia a bőrelváltozások gyulladásos reakciójának gátlásával képes szabályozni a pikkelysömör progresszióját. Tanulmányok azt találták, hogy az ózonozott olaj nemcsak reaktív oxigént szállít, hanem hosszú ideig fenntartja a terápiásán aktív ózonozott származékokat is. Korábbi tanulmányaink azt találták, hogy az ózonozott olaj biztonságos és hatékony a stabil vulgaris pikkelysömör kezelésében, hatékonysága megegyezik a közepesen ható glükokortikoidokéval 39. Ebben a tanulmányban bebizonyítottuk, hogy a betegek pszoriázisos bőrelváltozásai jelentősen enyhülnek, és hogy az olyan gyulladásos biomarkerek, mint az IL-17a, IL-6, TNF-α, TGF-β és IFN-γ az ózonkezelést követően jelentősen csökkentek. Megmutattuk azt is, hogy az ózonterápia jelentősen gátolhatja a gyulladással kapcsolatos útvonalakat, például az NF-κB, TLR, TNF és IL-17, egy psoriasisos állatmodellben. Ezek az adatok betekintést nyújtanak az ózonterápia pszoriázisos elváltozásokra gyakorolt terápiás hatásainak hátterébe.
A Th17 sejtek aktiválása döntő jelentőségű a pikkelysömör vulgaris elváltozásainak gyulladásos válaszában 51. Eredményeink azt mutatják, hogy az ózonkezelés jelentősen gátolhatja a Th17 sejtek számának és aktív funkciójának IMQ-indukálta növekedését. Az NF-κB jelátviteli út aktiválása indukálhatja a Th17 sejtek aktiválódását 52. Ezért a Th17 sejtek aktivációjának ózon által közvetített szuppressziója valószínűleg az NF-κB útvonalak gátlásának tudható be. A Th17 sejteken kívül más immunsejtek, például Th1, Th2, dendritikus sejtek (DC), természetes gyilkos (NK) sejtek és makrofágok is részt vesznek a pikkelysömör 53 gyulladásos válaszában. Eredményeink azonban azt mutatják, hogy az ózonkezelés minimális hatást gyakorol ezekre a sejtekre. Ezért az ózon valószínűleg specifikus hatással van a Th17-sejtek szabályozására a pikkelysömör kezelése során.
Az ózonozott víz és olaj mellett beszámoltak arról, hogy az ózon autohemoterápia és az ózon gázüreg/akupont injekció javítja a szervezet antioxidáns kapacitását és szabályozza a gyulladást 54 - 56. Hogy ezek a kezelések alkalmazhatók-e a pikkelysömörben, azt még meg kell határozni. Az ózon más szerekkel együtt is alkalmazható a mellékhatások csökkentése és a hatékonyság növelése érdekében. Például az orvosi ózon és a szteroidok kombinált intradiszkuláris és periganglionikus injekciójának kumulatív hatása van, ami fokozott általános eredményeket eredményez a porckorongsérv okozta fájdalom kezelésében 57. A helyi ózonterápiának van néhány mellékhatása, például irritáló fájdalom. Ritkán okoz szisztémás mellékhatásokat. Ebben a tanulmányban vannak bizonyos korlátozások. Például nincsenek adatok a kezelés hosszú távú hatékonyságáról vagy a kiújulási arányra gyakorolt hatásáról. Arra a kérdésre, hogy az ózonkezelés szabályozó szerepet játszik-e a keratinociták szaporodásában és differenciálódásában, valamint a pikkelysömör értágításában, még nem kaptunk választ.
- Boise ózonterápiás meridián természetgyógyász orvos a Karlfeldti Központ
- Ózonterápia előnyei és mellékhatásai - TipsHire A legjobb termékértékelések egy kattintással elérhetőek
- Az endogén zsírszövet stromális progenitor sejtjei hozzájárulnak a pericitákhoz és az adipocitákhoz, amelyek
- Kellemes és hatékony vízterápia fogyáshoz - Legjobb receptek - Sabi Gist
- Az elhízás kezelése a foglalkozási terapeuták szerepe Scandinavian Journal of Occupational Therapy