Kalcifikus aorta szelep betegség: molekuláris mechanizmusok és terápiás megközelítések
Daniel Alejandro Lerman
1. Edinburghi Royal Infirmary Hospital (NHS Lothian), Edinburghi Egyetem, Egyesült Királyság
Sai Prasad
1. Edinburghi Royal Infirmary Hospital (NHS Lothian), Edinburghi Egyetem, Egyesült Királyság
Nasri Alotti
2. Zalai Megyei Kórház, Pécsi Tudományegyetem, Magyarország
Absztrakt
Az aorta szelep szórólapjainak fokozatos megvastagodása és az aorta gyűrű szűkülete fokozott mechanikai stresszhez vezet a bal kamrán, és csökkenti a szívteljesítményt, ami további szövődményeket eredményez. [1–3] Az érintett populáció aránya növekszik, amikor a ország vagy régió emelkedik. A 65 évesnél idősebb emberek körülbelül 2–4% -ánál alakul ki meszesedő aorta szűkület, az ebben a korcsoportban élők 25% -ánál jelentkeznek a betegség jelei, ami a kardiovaszkuláris események kockázatának 50% -os növekedéséhez vezet. Ezenkívül fennáll annak a kockázata, hogy 80 év alatt a szívelégtelenség, az aorta szeleppótlás vagy a halál progressziója halad 5 év alatt. [4]
Anatómia és szövettan
A normális aorta szelep fenntartja az egyirányú véráramlást a bal kamrából az aortába. Ez egy rugalmas membrán, amely minden szívveréssel naponta több mint 100 000 alkalommal nyílik és záródik. Az egészséges aorta szelep három szórólapból áll, és a bal kamrai kiáramló traktus és az aorta gyökér találkozásánál helyezkedik el.
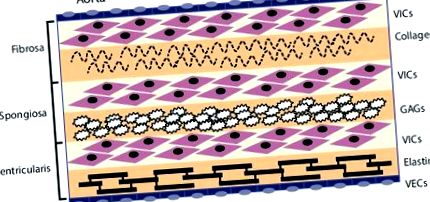
A szelep endoteliális sejtjei (VEC) a szelep külső felületét szegélyezik, és gátként funkcionálnak a gyulladásos sejtek beszivárgásának és a lipidek felhalmozódásának korlátozásában. A szelep három középső rétege a fibrosa, a spongiosa és a ventricularis. Ezek a rétegek szelep interstitialis sejteket (VIC) tartalmaznak, mint domináns sejttípust. A fibrosa a szelep aorta oldalán áll legközelebb, I. és III. Típusú fibrilláris kollagént tartalmaz, és terhelő funkciót tölt be. A spongiosa glikozaminoglikánokat (GAG) tartalmaz, amelyek kenik a fibrosa és a ventricularis rétegeket, amikor nyírják és deformálódnak a szívciklus során. A kamrai elasztin szálakat tartalmaz a radiális igénybevétel csökkentése érdekében. Forrás: Rajamannan, 2011. [10]
A szelep-interstitialis sejtek (VIC) ezekben a rétegekben találhatók, és különálló alcsoportjaik vannak, amelyek szabályozzák a homeosztázist a szelepes szórólapokon belül. [10–12] Az aorta szelep közös tricuspid anatómiája mellett veleszületett bicuspid szelep az általános populáció 0,5–1,4% -ában található meg, ami differenciális biomechanikai erőket eredményez - mind a szelepen, mind az aorta falán. [13–15]
Kórélettani és meszesedési mechanizmus
Az elmúlt évtizedekben a meszes aorta szelep betegség (CAVD) etiológiája jelentősen megváltozott. A reumás szívbetegségek alacsonyabb előfordulása és a megnövekedett élettartam az iparosodott országokban a reumás és a degeneratív meszesedés mintázatának elmozdulását eredményezte, mint a CAVD és az azt követő meszes aorta szűkület leggyakoribb oka. [16–18] A CAVD a harmadik leggyakoribb szívbetegség a nyugati világban, [19] koszorúér-betegség és magas vérnyomás következtében. Előfordulása időseknél (≥65 év) 2–4% között mozog, ha csak súlyos aorta szűkületet veszünk figyelembe, és 25% -ra növekszik, ha az aorta szklerózist is figyelembe vesszük. [9] Az idős emberek relatív kisebbségében azonban kialakul az aorta szelep meszesedése, ami arra utal, hogy az életkoron kívüli kóros hatások is szerepet játszanak.
A kalcifikus aorta-szűkület a szívműtétek második leggyakoribb oka, és Észak-Amerikában évente körülbelül 15 000 halálesetet okoz. [18] A kalcifikus aorta szűkület jól ismert betegségtag, és számos haemodinamikai paramétert képesek vagyunk felmérni a szív katéterezésével vagy ultrahangvizsgálatával, valamint a szív számítógépes tomográfiájával és a szív mágneses rezonancia képalkotásával. [20] A CAVD-ben a meszesedő csomók kezdetben a csúcsok tövében figyelhetők meg, és jelenlétük fokozatosan kiterjed a nyílás felé. Általában mind a három csípő érintett, de egy vagy több domináns lehet. Amikor a szűkületes aorta nyíláson keresztül a vér áramlása jelentősen korlátozottá válik, a pangásos szívelégtelenség és a hirtelen szívhalál súlyos tüneteivel járó hemodinamikai károsodás léphet fel. A súlyos tüneti aorta stenosis az I. osztályú indikáció a műtéti szeleppótlásra az American Heart Association és az American College of Cardiology szelepi szívbetegségekre vonatkozó irányelvei szerint. [21]
A CAVD-t jelenleg aktívan szabályozott és progresszív betegségnek tekintik, amelyet a sejtváltozások kaszkádja jellemez, amelyek kezdetben fibrotikus megvastagodást okoznak, majd az aorta szelepes szórólapok kiterjedt meszesedését követik. Ez viszont jelentős aorta szelep szűkülethez és esetleges bal kamrai kiáramlás elzáródáshoz vezet (lásd 2. ábra), [10,22] amelynél a műtéti pótlás az egyetlen életképes kezelési lehetőség. Jelenleg nincs jóváhagyott farmakológiai kezelés a CAVD progressziójának megállítására. [23] Emberi minták felhasználásával végzett leíró vizsgálatok kimutatták ennek a betegségnek a jellemző jegyeit, ideértve a korai érelmeszesedést, a sejtproliferációt és az oszteoblaszt expressziót. [24–26]
V: A szövettani változások előrehaladása a meszes aorta szűkületének folyamata során. B: Tricuspid aorta szelep, amely a kalcium növekvő lerakódását és az aorta annulus csökkenését mutatja. BMP = csont morfogenetikus fehérje; LDL = kis sűrűségű lipoprotein; TNF = tumor nekrózis faktor; TGF = transzformáló növekedési faktor. Forrás: Otto, 2008. [22]
CAVD és az ateroszklerózis hagyományos kockázati tényezői
Az aortaszelep szűkületét először Lazare Riviere írta le 1663-ban. [27] Az 1900-as évek elején olyan jeles patológusok, mint Monckeberg, a CAVD-t reumatikus lázzal vagy öregedéssel járó passzív degeneratív folyamatként írták le, amelynek során a szérum kalcium a szelep felületéhez kapcsolódik és a szórólaphoz kötődik, és csomókat képez. [28]
Az utóbbi évtizedekben számos tanulmány vonta be a szív- és érrendszeri érelmeszesedés hagyományos rizikófaktorait a CAVD kialakulásába. Az ateroszklerózis egy összetett és multifaktoriális folyamat, amely lipidekből, [29,30] makrofágokból, [31] szaporodó simaizomsejtekből [32] és apoptózisból álló elváltozást eredményez. [33] Az endoteliális nitrogén-oxid szintáz szabályozza [34–38], és idővel az ér átmérőjének elzáródását okozza. Az összkoleszterin, az alacsony sűrűségű lipoprotein (LDL) koleszterinszint, a megnövekedett lipoprotein (a), a megnövekedett trigliceridszint, a magas sűrűségű lipoprotein koleszterinszint csökkenése, a férfi nem, a cigarettázás, a magas vérnyomás és a diabetes mellitus számoltak be arról, hogy növelik az aorta stenosis előfordulását és valószínűleg hozzájárulnak az endothel diszfunkciójához és a betegtájékoztató károsodásához. [2,3,39–43] Az LDL és az ateroszklerózis jelenléte a meszes szelepekben a műtéti kóros vizsgálatokban alátámasztja a közös sejtmechanizmus hipotézisét. [44,45] a családi hiperkoleszterinémiában szenvedő betegeknél agresszív perifériás érrendszeri betegség, koszorúér-betegség és aorta szelep elváltozások alakulnak ki, amelyek az életkor előrehaladtával kalcifikálódnak. [39,46–48]
Az aorta szelep szűkületéhez hozzájáruló molekuláris és sejtes folyamatok nincsenek teljesen jellemezve, de betekintést nyújthatnak az új terápiás megközelítések kidolgozásába.
A szívszelepek a szelepes endoteliális sejtek és a VIC-k heterogén populációját tartalmazzák, amelyek fenntartják a szelep homeosztázisát és a betegtájékoztató szerkezeti integritását. A VIC-k, a szívbillentyűzetben a leggyakoribb sejttípus kulcsszerepet játszanak a CAVD progressziójában. [73] Különböző VIC-fenotípusokat azonosítottak a beteg emberi szívbillentyűkben, [74] beleértve a nyugalmi fibroblaszt-szerű VIC-eket is, amelyek kóros jelek alapján aktivált miofibroblaszt-szerű VIC-kké differenciálódhatnak; és osteoblast-szerű VIC-k, amelyek felelősek a kalcium aktív lerakódásáért a CAVD-ben. [53,62,74] Ezenkívül számos tanulmány kimutatta a VIC-ek osteogén differenciálódási képességét. [26,67,75]
CAVD és nyírófeszültség
Noha az érelmeszesedéses koszorúér-betegség és a CAVD közös jellemzőkkel bír, a reológiában eltérések vannak. Ez a különbség legalább részleges magyarázatot adhat a patofiziológia és a terápiára adott válasz különbségeire. [76–80] A CAVD-t a kamrai oldalon pulzáló nyírófeszültség, az aorta oldalán pedig alacsony és viszonzó nyírófeszültség jellemzi, [81] a koszorúér normális körülmények között tartós lamináris véráramlásnak van kitéve. [82] A szűkület előrehaladtával a fal nyírófeszültsége az aorta szelepen drámai módon megnő. [76] Ahamed és munkatársai kimutatták, hogy az in vitro nyíróstressz aktiválhatja a látens transzformáló növekedési faktor (TGF) -β1-et, [82] ami egy kritikus pro-fibrotikus növekedési faktor, amely fibrózist és meszesedést indukálhat. [83] Azt is kimutatták, hogy az aktív TGF-β1 eluálható az egerek nyaki artériájában érváltozásokra képződött trombákból, ahol a részleges elzáródás magas helyi nyíróstresszhez vezethetett [82]. Ezt követően Albro és mtsai. függetlenül megerősítette, hogy a nyírófeszültség aktiválhatja a látens TGF-β1-et a szinoviális folyadékban. [83] Ezek az adatok összefüggés lehetőségét vetik fel a keringő látens TGF-β1 nagy nyírófeszültség alatt történő aktiválása és a CAVD kialakulása között. Mivel a vérlemezkék hozzájárulnak
A keringő TGF-β1 szint kiindulási értékének 45% -a [84], és 40–100-szor több látens TGF-β1 van, mint bármely más sejtben, [85] lehetséges, hogy a nyírófeszültségnek két külön hatása van - a látens TGF-β1 felszabadulásának indukálása a vérlemezkékből és aktiválja a felszabadult látens TGF-β1-et. Ez a mechanizmus hozzájárulhat a CAVD progressziójához, mivel az aorta szelep szűkülete növeli a nyírófeszültséget, ami a vérlemezke TGF-β1 és TGF-β1 aktivációjának nagyobb felszabadulását eredményezi. Ez pedig a szelep progresszív szűküléséhez és fibrózisához, és ezáltal még nagyobb nyírófeszültséghez vezethet.
A meszesedő szelepeknek kezdetben makrofág és T-sejt infiltrátumuk van az endothelialis sérülés következtében. [74] A csontmorfogenetikus fehérjét (BMP) -2 és a BMP-4-et ezután miofibroblasztok és preoszteoblasztok expresszálják ezek mellett a limfocita infiltrátumok mellett. [74] Ezenkívül a szívbillentyűk expresszálják az oszteoblasztikus differenciálódás markereit, beleértve az alfa 1 magmegkötő faktort és az oszteokalcint. [26] Ezek a szelepek az osteogenezishez hasonló módon meszesednek, a vizsgált kóros minták többségében nyilvánvaló a lamelláris csont. [85] A veleszületetten kétfejű aorta szelepek egyenletesen mutatják a meszesedés jeleit az egyének 30 éves korának elérésével [86], ami részben annak a sajátos mechanikai stresszornak tudható be, amelynek ezek a szelepek vannak kitéve. [87] A közelmúltban megoldódott a kétfejű aorta szelep meszesedésének hátterében álló molekuláris mechanizmus. A NOTCH1 transzkripciós szabályozóban bekövetkezett mutációk aorta szelep anomáliákat és súlyos meszesedést eredményeztek az oszteoblaszt-stimulátor futtatásához kapcsolódó 2. transzkripciós faktor (RUNX2) károsodott repressziója miatt. [88]
A legfrissebb bizonyítékok arra utalnak, hogy a CAVD egy aktív gyulladásos folyamat eredménye, amely befolyásolja a szelepet, és osteoblastikus átalakuláshoz vezet a VIC-ek csontképződésével a nukleáris faktor-κB (RANK) receptoraktivátorának aktiválásával. [89]
Szabályozási utak
Egyre több bizonyíték áll rendelkezésre arról, hogy a szívbillentyű fejlődését szabályozó szabályozási utak a szelep patogenezisében is aktívak lesznek az élet későbbi szakaszaiban. A CAVD magában foglalja a VIC aktiválását a transzkripciós faktorok fokozott expressziója mellett, amelyek a fejlődő embrióban a valvulogenezis legkorábbi eseményeit szabályozzák. [90] A szelepfejlődési utak mellett a beteg szelepekben is aktívak a porc és a csontvonalak fejlődését elősegítő szabályozó fehérjék. [91] Így a szelep fejlődését szabályozó molekuláris szabályozási utak ismerete valószínűleg informatív lesz a szelep patogenezisének molekuláris mechanizmusainak meghatározásában.
Etiológia
A CAVD többtényezős etiológiával rendelkezik. Számos tényező középpontjában áll a szelepet érintő és meszesedéshez vezető gyulladásos folyamat [74,85], ideértve az LDL-ek lerakódását, [44,45] osteoblastikus transzformációt a szelepes interstitialis sejtek csontképződésével, a kötőszövet szintézisét és a szövetek átalakulását. Mikroszkópos szinten az aorta szórólapok tartalmaznak rendezetlen kollagénrostokat, krónikus gyulladásos sejteket, extracelluláris csontmátrixfehérjéket, lipidfehérjéket és csontásványokat. [5] A szelep meszesedése a VIC-ek transz-differenciálódása után következik be egy myofibroblast stádiumon keresztül oszteoblaszt sejtekké. [71,92]
Az aorta szeleppótláson átesett felnőttek felének kétfejű aorta szelepe van társítva, és szinte mindegyikükre új szelepet kell behelyezni. [93] Az egyes szív-szisztoláknál fellépő nyírófeszültség nagyobb a kétfejű szelepben, mint a három szórólap szerkezetében, és ezek a szelepek korábban kalcifikálódnak. [93]
Érdekes módon a RANK ligandum (RANKL) oszteoblaszt sejtek általi expressziója aktívan részt vesz az oszteoklaszt sejtek aktiválásában és differenciálódásában. [89] A RANKL szint normálisan emelkedik az életkor előrehaladtával, és megjósolhatja az emberek kardiovaszkuláris eseményeit, míg az oszteoprotegerin (a RANK fiziológiás inhibitora) hiány vaszkuláris meszesedéshez vezethet állatmodellekben. [94,95] Ez a tanulmány egy in vitro modellt emel ki a aorta szelep meszesedése. [95]
A meszesedés molekuláris mechanizmusai
Az aorta szelep szűkülete és a meszesedés folyamata sok hasonlóságot mutat az érelmeszesedéssel, és mindkét állapot patológiája hasonló kockázati tényezőkkel és hisztopatológiával rendelkezik. [2] A VIC-ek és a meszes aorta-szűkület útjainak aktiválása mechanikai és nyíróstressz, endotheliális károsodások és az LDL-ek lerakódásának eredménye, gyulladásos eseményeket vált ki és vonzza a gyulladásos sejteket (monociták, makrofágok és T-sejtek).
Ezek a sejtek citokineket, köztük a TGF-β-t termelnek, amelyek szabályozzák a sejtek szaporodását és differenciálódását; tumor nekrózis-faktor α, amelynek elsődleges funkciója az immunsejtek szabályozása; és az interleukin 2, amelyet aktivált T-limfociták termelnek növekedési faktor aktivitással. [1]
A gyulladásos folyamat által aktivált VIC-ket myofibroblastoknak nevezik. [5] Ezek a sejtek angiogén aktivitást fejlesztenek, és mátrix metalloproteinázokat termelnek, amelyek a szövetek átalakításában vesznek részt, és támogatják a VIC aktiválódását és transzformációját.
In Vitro Studies
Nemrégiben publikált tanulmányaink kimutatták, hogy a sertés VIC-ek spontán meszesedése során a kulcsmolekulák felemelkedtek a kalcium, a kollagén és az alkalikus foszfatáz (ALP) aktivitásának növekedésével. Az in vitro meszesedést standard festés és enzimaktivitás vizsgálatokkal határoztuk meg. A sertés VIC-ekben a meszesedést nátrium-foszfáttal indukálták. A sejtek mind a vaszkuláris simaizomsejtek, mind az oszteoblasztok expresszióját expresszálták, ami a fenotípus transzdifferenciálódására utal. Az α-aktin, a RUNX2, a TGF-β és az RhoA szabályozását és a kalponin csökkentését szabályozták, a RANKL expresszióban nem volt változás. A nátrium-foszfát fokozta a noduláris képződést a 7. napig, és a sertés VIC-ek ALP-aktivitását a 14. napig. Az eredmények arra utalnak, hogy a sertés VIC-k jó modell lehet a CAVD folyamatának tanulmányozásához. [100]
A denosumab mint a VIC kalcifikációjának potenciális gátlója in vitro
A denosumab egy humán IgG2 monoklonális antitest, amelyet úgy terveztek, hogy megcélozza a RANKL-t [101], amely az oszteoblasztok és az oszteoklasztok membránján expresszálódik. A denosumabot csontritkulás kezelésére használják. Ezenkívül a RANKL receptort blokkoló mechanizmusa miatt semlegesíti a RANK receptorok aktiválódását az oszteoklaszt előtti sejtek membránján. További kutatásokra van szükség a RANK receptor és a denosumab közötti kölcsönhatás kezeléséhez a sertés VIC-ben.
Köszönetnyilvánítás
Köszönetet mondunk Dr. Neil Mackenzie támogatásáért, aki sajnos egy kanadai jégmászás után bekövetkezett zuhanás után elhunyt (RIP).
- Elhízás elleni gyógyszerek korábbi, jelenlegi és jövőbeli betegségmodellek; Mechanizmusok
- Aorta szelepcsere - helyreállítás - NHS
- Aorta szelep regurgitáció PeaceHealth
- A mechanikus aorta szívbillentyűvel való élethez való alkalmazkodás fenomenográfiai tanulmány - PubMed
- Terápiás alacsony szénhidráttartalmú étrend