A butirátot előállító baktériumok megakadályozzák a zsírtartalmú étrend okozta elhízást egerekben
Absztrakt
Háttér
Az elhízás világszerte nagy probléma, és súlyosan befolyásolja a közbiztonságot. A bél mikrobiota metabolitjaként az endogén vajsav részt vesz az energia- és anyagcserében. Figyelembe véve a meglévő súlycsökkentő beavatkozásokhoz kapcsolódó súlyos mellékhatásokat és a súlygyarapodást, sürgősen új stratégiákra van szükség az elhízás megelőzéséhez és kezeléséhez.
Eredmények
A jelen tanulmányban megterveztük Bacillus subtilis Az SCK6 fokozott vajsavtermelést mutatott. Az eredetihez képest Bacillus subtilis Az SCK6 törzs, a genetikailag módosított BsS-RS06550 törzs magasabb vajsavtermeléssel rendelkezik. Az egereket véletlenszerűen négy csoportba osztották: normál étrend (C) csoport, magas zsírtartalmú étrend (HFD) csoport, HFD + Bacillus subtilis SCK6 (HS) csoport és egy HFD + BsS-RS06550 (HE) csoport. Az eredmények azt mutatták, hogy a BsS-RS06550 csökkentette a HFD egerek testsúlyát, testtömeg-növekedését és táplálékfelvételét. A BsS-RS06550 jótékony hatással volt a vércukorszintre, az inzulinrezisztenciára és a máj biokémiájára. A 14 hetes kísérlet után székletmintákat gyűjtöttünk a nem célzott folyadékkromatográfia-tömegspektrometriás elemzéshez, hogy azonosítsuk és számszerűsítsük a metabolitokban bekövetkező jelentős változásokat. Tizenhat potenciálisan jelentős metabolitot szűrtek át, és kimutatták, hogy a BsS-RS06550 potenciálisan szabályozza a glutation, a metionin, a tirozin, a fenilalanin és a purin metabolizmusának rendellenességeit és a másodlagos epesav bioszintézist.
Következtetések
Ebben a tanulmányban sikeresen terveztünk Bacillus subtilis Az SCK6 fokozott vajsavtermelést eredményez. E munka eredményei azt mutatták, hogy a genetikailag módosított élő BsS-RS06550 baktérium elhízás elleni hatásokat mutatott, amelyek összefüggésben állhattak az elhízással járó metabolitok szintjének szabályozásával. Ezek az eredmények azt mutatják, hogy a BsS-RS06550 használata ígéretes stratégia lehet az elhízás csillapítására.
Háttér
Az elhízás világszerte egyre elterjedtebb, és számos krónikus betegséghez vezet, beleértve a metabolikus szindrómát, a 2-es típusú cukorbetegséget és a szív- és érrendszeri betegségeket [1, 2]. Az elhízás tehát jelentős közegészségügyi kihívás, amely hatalmas gazdasági terhet ró mind a családokra, mind a társadalomra [3]. Ezenkívül az elhízás gyakorisága serdülőknél és felnőtteknél feltárja a hatékony kezelési stratégiák sürgős szükségességét [4, 5].
Tanulmányok kimutatták, hogy a testmozgás és az étrendi beavatkozás hatékony módszer a súlygyarapodás ellenőrzésére és enyhítésére [6, 7]. A legtöbb beteg számára azonban nehéz fenntartani a hosszú távú testmozgást vagy az ésszerű és egészséges táplálkozási szokásokat [8]. Az orvosi terápia és a műtét is lehetőség, bár ezek a megközelítések komoly mellékhatásokkal is járnak [9, 10]. Ezért az elhízás csillapításához újszerű megközelítésekre van szükség.
Az anyagcserezavarok az elhízás egyik legkritikusabb jellemzője, a metabolitok és az anyagcsere útvonalak szorosan összefüggenek az elhízás előfordulásával és kialakulásával [11,12,13,14]. Az elmúlt években a kutatók kimutatták, hogy a bél mikrobiota metabolitjaiként a rövid láncú zsírsavak (SCFA-k) az energiaellátás és az immunszabályozás [15], különösen a vajsav (BA) hatására befolyásolják a betegség élettani folyamatait, amelyek enyhíthetik elhízás és inzulinrezisztencia magas zsírtartalmú étrenddel (HFD) táplált egerekben [16]. Ezenkívül a BA csökkentheti az étvágyat és megakadályozhatja a zsírmájat a bél-agy idegi körön keresztül [17]. A BA és az azt termelő mikrobiota szintje elhízott egyéneknél jelentősen csökken az egészséges alanyokhoz képest, és a BA ellátása potenciális stratégia lehet az elhízás kezelésében [18, 19].
Jelenleg az orális butirát egy általánosan alkalmazott BA-kiegészítő, de alacsony a biológiai hozzáférhetősége. Ezenkívül a legtöbb BA-t termelő bélmikrobiota anaerob baktérium, amely korlátozhatja a BA termelési kapacitását, különösen a megszállott egyéneknél [20]. A probiotikumokat általában gyógyszerhordozóként használják [21, 22]. Bacillus subtilis (B. subtilis) tiszta genetikai háttérrel rendelkező élelmiszeripari probiotikum, amelyet takarmány-adalékként is alkalmaztak a növekedési teljesítmény és az immunitás javítása érdekében [23]. A genetikailag módosított probiotikumokat egyre inkább terápiás gyógyszerként alkalmazzák az elhízás kezelésére [24, 25]. Jelen tanulmányban, B. subtilis Az SCK6-ot (SCK6) genetikailag módosították a BA termelésének fokozása érdekében. A vizsgálat célja a géntechnológiával módosított gyógyszerek lehetséges megelőzőinek vizsgálata volt Bacillus subtilis SCK6 törzs (BsS-RS06550) HFD-vel táplált egerekben.
Eredmények
A genetikai módosítása Bacillus subtilis SCK6 a BA termelés fokozása érdekében
Kimutatták, hogy az SCK6 ideális gazda a kiváló fehérje expresszió és transzformációs képessége miatt [26, 27]. A teljes genomszekvenálási adatok alapján csak egy BA bioszintetikus út létezik B. subtilis, a BA kináz útvonal [28]. Az elmúlt években egy új BA szintetikus utat, a butiril CoA: ecetsav CoA transzferáz (BCoAT) útvonalat azonosítottak a legtöbb BA-t termelő mikrobiotában a belekben [29]. A BA termelésének javítása érdekében a BCoAT kódoló gént beillesztettük az SCK6 genomjába, hogy kifejezzük az új BA szintézis útvonalat. Figyelembe véve, hogy a baktériumok biomassza szintén fokozó tényező lehet a BA termelésében, a gén skfA, sporulációs ölő faktort kódoló, megszakadt a növekedési sebesség növelése érdekében [30]. Az SCK6-hoz képest a BsS-RS06550 lényegesen nagyobb BA-mennyiséget termelt, körülbelül 3,80-szor nagyobb (1a. Ábra: 0,238 ± 0,014 g/l vs 0,984 ± 0,027 g/l, o 1. ábra
A BsS-RS06550 jótékony hatása a HFD által kiváltott elhízásra egerekben
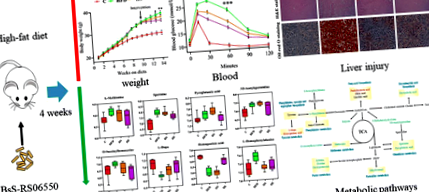
A kísérleti terv 4 csoportot tartalmazott (n = 8 minden csoportnál): normál étrend (C) csoport, magas zsírtartalmú étrend (HFD) csoport, HFD + Bacillus subtilis SCK6 (HS) csoport és egy HFD + BsS-RS06550 (HE). Amint a 2a. Ábra mutatja, az egerek testtömege a HFD, HS és HE csoportokban nem mutatott különbséget a beavatkozás előtt, míg a BsS-RS06550 kiegészítés jelentősen csökkentette a testtömeg-növekedést a HFD-indukálta egerekben (HE vs HFD 14 héten belül) 34,60 ± 0,63 g vs 37,90 ± 0,88 g, o 2. ábra
Szérumelemzés és májkárosodás
Tanulmányok kimutatták, hogy a BA szabályozza a szérum biokémiai mutatóit a HFD-vel táplált egerekben [35, 36]. A magas zsírtartalmú étrend szignifikánsan növelte az összkoleszterin (TC), a triglicerid (TG), a nagy sűrűségű lipoprotein (HDL) és az alacsony sűrűségű lipoprotein (LDL) szintjét a HFD csoportban, összehasonlítva a C csoportban megfigyeltekkel (2. ábra, 5,30 ± 0,542 mmol/L vs 2,96 ± 0,244 mmol/L, 2,78 ± 0,249 mmol/L vs 1,95 ± 0,216 mmol/L, 4,00 ± 0,322 mmol/L vs 2,36 ± 0,219 mmol/L, 0,678 ± 0,051 mmol/L vs. 0,408 ± 0,061 mmol/l, o 3. ábra
A HFD által kiváltott elhízás metabolikus válasza egerekben a BsS-RS06550-re
Egyre több bizonyíték bizonyítja, hogy a BA részt vesz az energia- és anyagcserében [37], és a fent említett fiziológiai változásokat az anyagcsere különbségei okozhatták. Jelen tanulmányban az összes anyagból székletmintákat gyűjtöttünk az anyagcsere-változások értékelésére. Összesen 9726 potenciális biomarkert szűrtünk, és szignifikáns változásokat figyeltünk meg az összes csoport között (4a. Ábra, b). A PCA-t és az ortogonális OPLS-DA-t az LC – MS adatokon végeztük, és általános áttekintést nyújtottak a fürtözési információkról (4c. Ábra, d). A PCA modellben nem volt szignifikáns elválasztás a HFD, a HS és a HE csoportok között, és az összes csoport el volt választva a C csoporttól. Az OPLS-DA modellt, a felügyelt klaszterezési módszert azonban összehasonlítottuk a PCA-val, amely nagyobb diszkriminációs erőt biztosított. A pontszámdiagram azt mutatta, hogy az összes csoport egyértelműen el volt választva egymástól, és ezek az eredmények azt mutatták, hogy a BsS-RS06550 megváltoztatta a HFD csoportba tartozó egerek székletének metabolikus profilját.
Céltalan széklet metabolomikai elemzés. a A differenciálisan metabolitok hierarchikus csoportosulása minden csoportban. b A minták faelemzése. c A PCA pontszerűen ábrázolják a széklet metabolikus profiljait, normál étrend-csoport (C), magas zsírtartalmú étrend-csoport (HFD), HFD + Bacillus subtilis SCK6 csoport (HS) és HFD + BsS-RE06550 (HE). d Az OPLS-DA pontozza a C, HFD, HS és HE széklet metabolikus profilozásának grafikonjait
Metabolitok és metabolikus útelemzés
A metabolomikai elemzések alapján a kutatók beavatkozási megközelítéseket fogadtak el az elhízás kezelésére [38]. A HFD fogyasztása növelheti az energiatermelést és csökkentheti az elhízást elnyomó SCFA-k termelését, ami elhízást és anyagcserezavarokat eredményezhet [39]. Ezen túlmenően negatív összefüggések mutatkoztak a BA és egyes metabolizmusok között többféle anyagcsere útvonalon. A metabolitok szintje szignifikánsan megváltozott az OPLS-DA (VIP pontszám> 1) és az egyirányú ANOVA (o érték ≤ 0,05) eredmények. Valamennyi azonosított metabolitot nagy pontosságú kvázi-molekuláris ion tömegspektrometriával számítottuk, l-metionin, spermin, piroglutaminsav, O-szukcinilhomoserin, l-homofenilalanin, l-fenilalanin, guanin, adenin, dihidrouracil és 5- a metil-tetrahidrofolát mind a HE csoportban szignifikánsan csökkent a HFD csoportban megfigyeltekhez képest (5., 6. ábra, o 1. táblázat Jelentős metabolitok a HFD, HS és HE székletmintáiban
A glutationban, a metioninban, a tirozinban, a fenilalanin metabolizmusában és a C (kontroll), a HFD (magas zsírtartalmú étrend), a HFD relatív bőségű metabolitjainak relatív bősége + Bacillus subtilis SCK6 csoport (HS) és HFD + BsS-RS06550 (HE) csoportok (n = 8 csoportonként). Az intenzitásadatok normalizálása log függvénykonverzióval (10 alapján)
A szignifikáns metabolitok viszonylagos bősége a purin metabolizmusában és a másodlagos epesav bioszintézisében, valamint C (kontroll), HFD (magas zsírtartalmú étrend), HFD + Bacillus subtilis SCK6 csoport (HS) és HFD + BsS-RS06550 (HE) csoportok (n = 8 csoportonként). Az intenzitásadatok normalizálása log függvénykonverzióval (10 alapján)
A metabolitok fel- és leszabályozása az anyagcsere útjában bekövetkező változásokat jelzi. Ebben a tanulmányban székletmintákat vettünk fel a metabolikus utak változásainak vizsgálatára. A szignifikáns különbség-metabolitok alapján a potenciális jellegzetes metabolitok és anyagcseréjük leírására a KEGG útvonal és az irodalom alapján hálózati diagramot készítettek (7. ábra). Az azonosított metabolitok főleg a metionin, a purin, a glutation, a tirozin és a cisztein metabolizmusában, valamint a fenilalanin és a másodlagos epesav bioszintézisében vettek részt.
Az összes székletminta javasolt metabolikus útvonalának sematikus diagramja. A vörös és a zöld a felfelé, illetve a lefelé szabályozott metabolitokat képviseli
Vita
Az l-dopa és a homogentisav metabolitok, amelyek részt vesznek a tirozin metabolizmusában. Az l-Dopa a dopamin neurotranszmitter előfutára, és alkalmazása a krónikus kétoldali szubtalamikus stimulációs műtétek utáni súlykontroll szabályozásának potenciális stratégiája [47]. A tirozin metabolizmusában részt vevő másik metabolit a homogentisav. Nguyen tanulmánya arról számolt be, hogy a homogentisav hatékony α-glükozidáz inhibitor a vér glükózszintjének javításában [48]. Ebben a tanulmányban az l -Dopa (o Vizsgálatunkban megerősítettük az l-dopát és a homogentisavat (2b. ábra, c). Az l-homofenilalanin és az l-fenilalanin részt vesz a fenilalanin metabolizmusában és bioszintézisében. Ezek az aminosavak tirozinná oxidálódhatnak, és részt vesznek a neurotranszmitterek és hormonok szintézisében. Ezenkívül a fenilalanint potenciális biomarkerként azonosították az elhízásban [49]. A HFD által kiváltott glükóz és lipid anyagcsere rendellenességeket a BsS-RS06550 enyhítheti a fenilalanin szintjének csökkentésével (6. ábra). Így ezek az eredmények arra utalnak, hogy a BsS-RS06550 befolyásolhatja a tirozin és a fenilalanin metabolizmusát.
A deoxikolsav (DCA) olyan epesav, amely szignifikánsan eltérő szinteket mutatott a HE és HFD csoportok között (6. ábra), és a BsS-RS06550 kezelés szignifikánsan csökkentette a DCA szintjét egerekben a HE csoportban, összehasonlítva a HFD-vel megfigyelt szintekkel csoport (o
Következtetés
Mód
Törzsek, táptalaj és növekedési körülmények
Az ebben a vizsgálatban használt baktérium törzseket és plazmidokat az 1. kiegészítő fájl tartalmazza: S1. Táblázat. Escherichia coli DH5a-t alkalmaztunk DNS-klónozáshoz és plazmid-konstrukcióhoz. Bacillus subtilis Az SCK6-ot használták a törzsépítések szülőtörzseként, és a Spizizen minimális táptalajával transzformálták. Az összes törzset rutinszerűen Luria-Bertani (LB) folyékony táptalajban és LB agar lemezeken tenyésztettük 37 ° C-on. Kanamicint használtak a pCas szelekciójához 100 μg/ml végkoncentrációban, és Spectinomycint használtak 100 μg/ml koncentrációban a pTargetF plazmid kiválasztásához.
BsS-RS06550 konstrukció és in vitro kísérletek
SCFA elemzés
Az YCFA táptalaj felülúszókat centrifugálással gyűjtöttük össze, 24 órás tenyésztés után, 37 ° C-on. Az SCFA-k koncentrációit gázkromatográfia – tömegspektrometriával (GC – MS) mértük. Először 0,4 ml 50% -os (v/vkénsavat és 2 ml dietil-étert adunk 2 ml felülúszóhoz az SCFA-k megsavanyítása és dúsítása céljából. A felülúszókat 4 ° C-on végzett centrifugálás után összegyűjtöttük, 3000 r/perc sebességgel 5 percig centrifugáltuk, majd 0,22 μm-es nejlonszűrőn átszűrtük. Kalcium-kloridot használtunk a víz eltávolítására, a felülúszókat pedig a GC – MS kimutatására. A részletes GC – MS folyamat az 1. kiegészítő fájlban látható.
Állatok és kezelési rendszer
32 hím C57 BL/6 J egeret (3–5 hetesek) helyeztünk el, és állandó hőmérsékleten (22 ± 3 ° C) és páratartalomban (55 ± 10%) tartottuk. Az egerek szabadon hozzáférhettek a vízhez és az élelemhez, és egy hetes akklimatizáció alatt 12 órás világos-sötét ciklusnak vetették alá őket. A 32 egeret véletlenszerűen osztották szét négy csoportban (n = 8 csoportonként): kontrollcsoport (C), magas zsírtartalmú étrend (HFD) csoport, HFD + Bacillus subtilis SCK6 (HS) csoport és HFD + BsS-RS06550 (HE) csoport. A HFD-ben, HS-ben és HE-ben lévő egereket naponta egyszer szondával adtuk 200 μl kontroll ddH2O-val, SCK6-tal (108 CFU/ml), illetve BsS-RS06550-vel (108 CFU/ml). Az összes kezelést 4 héten keresztül végeztük, és az egerek egy éjszakán át böjtöltek, mielőtt a vizsgálat végén feláldozták őket. A leölt állatok vér-, máj- és bélszöveteit összegyűjtötték és -80 ° C-on tárolták. A testtömeget és a táplálékfelvételt minden egér esetében hetente egyszer mértük.
Májszövettan és szérumanalízis
A májszöveteket 4% -os formalinnal rögzítettük és feldolgoztuk paraffin beágyazás céljából. A szövetrészeket 5 μm vastag szeletekre vágtuk és standard eljárással hematoxilinnal és eozinnal (H&E) festettük. A szövetmintákat megfigyeltük és fényképeztük CX31 mikroszkóppal (Olympus).
A 10% formalinnal rögzített májszöveteket folyékony nitrogénnel gyorsan lefagyasztották, majd 5 μm vastag szeletekre osztották. A metszett májszövet-lemezeket 5 percre abszolút propilén-glikolba helyeztük, hogy elkerüljük a vizet az olajvörös O-ba. A tárgylemezeket előmelegített Oil Red O-oldattal 30 percig szobahőmérsékleten festettük, majd Mayer hematoxylinjében festettük. oldat 30 másodpercig. Festés után a tárgylemezeket háromszor vízzel mossuk, majd mikroszkóp alatt megfigyeljük Zeiss Obverse 7 (Zeiss).
Vérmintákat vettünk 12 órás böjt után. A szérumot/plazmát elválasztottuk, mielőtt -80 ° C-on tároltuk. A szérum biokémiai paramétereit Mindray BS-2000M készülékkel (Shenzhen, Kína) mértük a gyártó útmutatásai szerint. Az inzulin tolerancia tesztekhez (ITT) az egerek egy éjszakán át tartó éhezés után ad libitum táplált állapotban intraperitoneális humán inzulin injekciót kaptak. A glükóz tolerancia tesztekhez (GTT) az egerek orális glükózt kaptak egy éjszakai éhgyomri után. A vércukorszintet Roche ACCU-CHEK aktív vércukormérővel (Bázel, Svájc) mértük a megadott időpontokban. A plazma szabad zsírsavszinteket kvantifikációs készlet (WAKO) segítségével mértük.
Nem célzott LC – MS a székletminták metabolitjainak mérésére
A székletmintákat (100 mg) és 500 μl ddH2O-t (4 ° C) 2 ml-es centrifugacsőbe helyeztük, és 60 másodpercig vortexeltük. Ezt követően 1000 μl metanolt (előre lehűtve -20 ° C-on) átvisszünk a csövekbe, majd 30 másodpercig vortexeljük. Ezután az oldatokat 10 percig szobahőmérsékleten ultrahanggal kezeljük, majd 30 percig inkubáljuk a jégen. A felülúszó mintákat 10 percig végzett centrifugálás után gyűjtöttük 14 000 fordulat/perc sebességgel és 4 ° C-on. A felülúszó mintákat vákuumban bepároljuk, majd 400 μl 2-klór-benzalamin (4 ppm) metanolos vizes oldatban (1: 1, 4 ° C) feloldjuk. 0,22 μm membránszűrés után a minták készen állnak az LC – MS kimutatására. A specifikus, nem célzott LC – MS körülményeket kiegészítő anyagok mutatják be.
Statisztikai analízis
Az in vitro BA termelési adatokat három példányban elemeztük. Az adatokat átlag ± standard eltérésként (SD) fejeztük ki, és egyirányú varianciaanalízisnek (ANOVA) vetettük alá őket Törökország tesztjével és grafikus bemutatásával, a GraphPad Prism szoftver 8.0 (La Jolla, CA) alkalmazásával. A nem célzott LC – MS nyers adatokat a Proteowizard szoftver dolgozta fel (v3.0.8789). Ezt követően a csúcsok azonosítását, a csúcsok szűrését és a csúcsok igazítását R csomag XCMS-sel (v3.3.2) adtuk meg, és az adatmátrixot tömeg/töltés arány (m/z), retenciós idő (rt) és intenzitás alapján állapítottuk meg. A főkomponens-analízist (PCA) és az ortogonális részleges legkisebb négyzetekkel megkülönböztető elemzést (OPLS-DA) az adatmátrixszal R csomag roplok segítségével adtuk be. A csoportok közötti statisztikai elemzésekhez a GraphPad Prism 8.0 szoftvert használták az ANOVA-hoz. *o
Az adatok és anyagok rendelkezésre állása
A tanulmány során keletkezett vagy elemzett összes adatot ez a közzétett cikk tartalmazza.
- A gyomor baktériumai megvédik-e az elhízástól a ScienceDaily
- Az étrend okozta elhízás és fogyás megváltoztatja az epesav-koncentrációt és az epesav-érzékeny gént
- Vajon a baktériumok ma zsíros pszichológiává tehetnek
- Az elhízás osztályozása személyre szabott étrendi fogyáskezelés alapján
- Tiszta Lean; Teljes életet táplálkozás - kiváló minőségű orvos által összeállított vitaminok és kiegészítők