A koláttartalmú, magas zsírtartalmú étrend sokmagú óriássejtek képződését indukálja az apolipoprotein E -/- egerek ateroszklerotikus plakkjaiban
A Szájbiológiai és Orvostudományi Tanszékről (A.O.S., S.W., B.N. és D.B.), Fogorvostudományi Kar, University of British Columbia, Vancouver, British Columbia, Kanada; valamint az Angiológiai és Érsebészeti Osztály (M.L.G.L. és O.E.E.M.), Hermanos Ameijeiras Kórház, La Habana, Kuba.
A Szájbiológiai és Orvostudományi Tanszékről (A.O.S., S.W., B.N. és D.B.), Fogorvostudományi Kar, University of British Columbia, Vancouver, British Columbia, Kanada; valamint az Angiológiai és Érsebészeti Osztály (M.L.G.L. és O.E.E.M.), Hermanos Ameijeiras Kórház, La Habana, Kuba.
A Szájbiológiai és Orvostudományi Tanszékről (A.O.S., S.W., B.N. és D.B.), Fogorvostudományi Kar, University of British Columbia, Vancouver, British Columbia, Kanada; valamint az Angiológiai és Érsebészeti Osztály (M.L.G.L. és O.E.E.M.), Hermanos Ameijeiras Kórház, La Habana, Kuba.
A Szájbiológiai és Orvostudományi Tanszékről (A.O.S., S.W., B.N. és D.B.), Fogorvostudományi Kar, University of British Columbia, Vancouver, British Columbia, Kanada; valamint az Angiológiai és Érsebészeti Osztály (M.L.G.L. és O.E.E.M.), Hermanos Ameijeiras Kórház, La Habana, Kuba.
A Szájbiológiai és Orvostudományi Tanszékről (A.O.S., S.W., B.N. és D.B.), Fogorvosi Kar, University of British Columbia, Vancouver, British Columbia, Kanada; valamint az Angiológiai és Érsebészeti Osztály (M.L.G.L. és O.E.E.M.), Hermanos Ameijeiras Kórház, La Habana, Kuba.
A Szájbiológiai és Orvostudományi Tanszékről (A.O.S., S.W., B.N. és D.B.), Fogorvostudományi Kar, University of British Columbia, Vancouver, British Columbia, Kanada; valamint az Angiológiai és Érsebészeti Osztály (M.L.G.L. és O.E.E.M.), Hermanos Ameijeiras Kórház, La Habana, Kuba.
Ön a cikk legfrissebb verzióját nézi. Előző verziók:
Absztrakt
Célkitűzés- A többmagú óriássejtek (MGC) szerepének meghatározása a szív- és érrendszeri betegségekben.
Módszerek és eredmények— Az MGC-k az óriássejtes arteritis jellemzői. Aorta aneurysmákból, valamint carotisból és koszorúerekből származó ateroszklerotikus plakkokban is leírják őket. Itt bemutatjuk, hogy a koláttartalmú Paigen-diéta sok MGC-t eredményez az apolipoprotein E -/- egerek ateroszklerotikus plakkjaiban. Ezek az egerek az MGC-szám négyszeres növekedését mutatták ki, összehasonlítva a kolát nélküli nyugati vagy Paigen-diétán. Az MGC-k többsége intenzíven festődött a katepszin K miatt, és a rostos sapkákon helyezkedtek el, a sérült rugalmas rétegek közelében, a kapcsolódó mediális simaizomsejtek kimerülésével. In vitro kísérletek során az MGC-k az elasztolitikus aktivitás hatszoros növekedését mutatták, összehasonlítva a makrofágokkal, és megkönnyítették a simaizomsejtek migrációját egy kollagén-elasztin mátrixon keresztül. Az elasztinból származó hexapeptid (Val-Gly-Val-Ala-Pro-Gly [VGVAPG]) jelentősen megnövelte a makrofág-fúzió sebességét, biztosítva az in vivo MGC-képződés mechanizmusát. Az egér modelljéhez hasonlítva a carotis artériákból és aorta aneurizmákból származó emberi minták katepszin K – pozitív MGC-ket tartalmaztak.
Következtetés- Az apolipoprotein E -/- Paigen diétával táplált egerek modellt nyújtanak az MGC-k vaszkuláris betegségek szövetromboló szerepének elemzéséhez.
Az apoE -/- egerek koláttartalmú HFD-vel történő etetése katepszin K-t expresszáló, többmagvú óriássejtek kialakulását eredményezte; ezek a sejtek főleg rostos kupakokban és a brachiocephalikus artériák sérült elasztinszálai közelében helyezkedtek el. Ez a modell hasznos eszköz lehet az óriássejtek emberi betegségek szövetpusztító szerepének tanulmányozásához.
A sokmagú óriássejtek (MGC) jelenléte az erek falában jól le van írva óriássejtes arteritiszben (GCA) szenvedő betegeknél. Ennek a betegségnek a neve a makrofágok fúziójával képződött MGC jelenlétét tükrözi az artériás fal gyulladásos infiltrátumaiban. 1,2 Az érelmeszesedésben az MGC-ket az aorta aneurysmáiból, valamint a carotisból és a koszorúerekből származó plakkokban írták le. 3 Egy jelentésben 4 CD11c-pozitív MGC-t figyeltek meg az Apolipoprotein E (apoE) -/- „Western” magas zsírtartalmú étrendben (HFD) részesülő, előrehaladott érelmeszesedéses plakkokban.
Mód
A módszerek részletes leírását a Kiegészítő anyag tartalmazza (online elérhető a http://atvb.ahajournals.org címen).
A hathetes apoE -/- egereket a normál chow étrendről 3 típusú HFD-re váltották: (1) egy nyugati HFD-t, amely 21% zsírzsírt és 0,15% koleszterint tartalmazott (n = 12); (2) egy Paigen HFD, amely 18% zsírzsírt, 1% koleszterint és 0,5% nátrium-kolátot tartalmazott (n = 12); és (3) Paigén-diéta kolát nélkül (n = 8) (Purina Mills, LLC, St Louis, Mo). 16 hetes HFD után az egereket egy éjszakán át tartó böjt után, altatásban (xilazin-ketamin) végzett exangellációval eutanizáltuk. A kontroll apoE -/- egereket (n = 12) normál étrenden 22 hetes korban eutanizálták. Az in vitro makrofágfúzióhoz 3 hónapos apoE -/- és apoE -/- plusz Ctsk -/- egereket használtunk. Dupla kiütésű apoE -/- plusz Ctsk -/- egereket állítottunk elő az előzőekben leírtak szerint. 5 Az oszteoklasztok izolálásához vad típusú és Ctsk -/- 2 napos egereket (n = 6 mindegyik csoportban) alkalmaztunk. Minden kísérletet a British Columbia Egyetem (Vancouver) szabályozó hatósága hagyott jóvá.
Nemparaméteres ANOVA-t hajtottunk végre, és az adatokat átlag ± SD-ként adtuk meg. P 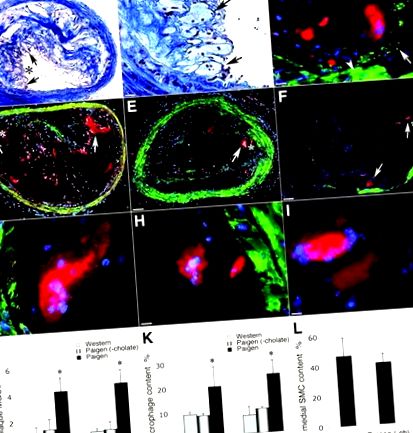
A legtöbb MGC-vel rendelkeztek idegen test MGC-k, és nem mutatták ki a Mac-3 festést
A sejt egészében szabálytalan mageloszlású idegen test MGC-k (FBMGC-k) következetesen jelen voltak a Paigen diéta egereken a brachiocephalicus artériában (2A – C. Ábra), míg a magok patkószerű perifériás elrendezésével jellemzett Langhans-típusú MGC-k. ritkán figyelhető meg (2D – F ábra).
2. ábra. FBMGC-k és Langhans-típusú MGC-k jelenléte a brachiocephalicus artéria plakkokban. Az A, Cathepsin K – pozitív MGC-k nem mutattak festést a Mac-3 makrofág markerre. B – C, nagyított területek A. D-től, Langhans-típusú MGC-k erős immunfestéssel rendelkeznek a katepszin K. E-vel, Langhans-típusú MGC-k erős immunfestéssel rendelkeznek Mac-3-mal szemben. F, D és E egyesülése. A-tól F-ig a piros a katepszin K-t jelöli; zöld, Mac3; és a csillag, a területet nagyítva B-ben és C. MGC-k. J, Néhány MGC klasztereket formált. A csillag mutatja a K és L egymást követő szakaszainak nagyított területét. K és L, az egymást követő szakaszok feltárják az MGC-k jelenlétét a klasztereken belül (a nyilak MGC-ket mutatnak). A-ban a méretarány 130 μm-t mutat; B, C, G-től I-ig, K-ig és L-ig 30 μm; D-től F-ig 20 μm; és J-ben 65 μm. * nagyított területet mutat B-ben; ∗ a nagyított területet mutatja C-ben.
A katepszin K és a Mac-3 makrofág marker kettős immunfestése azt mutatta, hogy az FBMGC-k erősen festették a katepszin K-t, de a Mac-3 esetében nem festődtek, míg az óriássejtek körüli Mac-3-pozitív makrofágoknál a katepszin K festése gyengébb volt vagy egyáltalán nem volt látható (2A – C. Ábra). . Ugyanígy a Langhans-típusú MGC-k szignifikánsan erőteljesebben festődtek a katepszin K-n a környező makrofágokhoz képest; azonban az FBMGC-kkel ellentétben erősen festődtek Mac-3-ra is, amely katokszin K-vel kolokalizálódott (2D – F ábra). A katepszin K-vel ellentétben a katepszin S-t nem detektálták immunhisztokémiai analízissel MGC-kben; a katepszin L jelenlétét gyenge festéssel mutatták ki (2G – I. ábra).
Néhány előrehaladott érelmeszesedéses lézióban az FBMGC-ket fürtökben figyelték meg, és könnyen felismerhetők nagy méretük, festetlen citozoljuk és a sejtek közötti kollagénrostok hiánya miatt a trichrommal festett szakaszokban (2J ábra). Bizonyos területeken az ilyen klaszterek belsejében lévő sejtek óriássejtként jelentek meg, egyetlen maggal; az egymást követő szakaszok elemzése azonban azt mutatta, hogy a sejtek különböző mélységeiben sokmagvúak, bizonyítékot szolgáltatva arra, hogy az ilyen klaszterek valóban MGC-kből állnak (2K és L ábra).
Az endotoxin és az IL-4 szérumkoncentrációja, valamint a plakk-díjas szerű receptorok (4) (TLR4) immunfestő hatása korrelál az MGC-k és az elasztin-törések jelenlétével
3. ábra. A, a szérum endotoxin szintje emelkedett a HFD-k összes egércsoportjában, a legmagasabb szint Paigen diétán volt. A B és C, A Paigen diéta a plakk TLR4 expressziójának (B) és a szérum IL-4 koncentrációjának növekedését (C) indukálta. D, TLR4-pozitív sejtek, közel az MGC-hez (a piros a TLR4-et jelöli; csillag, MGC az E-n látható). E, Cathepsin K – pozitív MGC egymást követő szakaszból. F, trikrommal festett szakasz MGC-vel az elasztinszál törések mellett (a nyilak MGC-ket mutatnak; és nyílhegyek, megszakadt elasztinlapok). G, Cathepsin K – pozitív MGC egy elromlott elasztinlemezhez kapcsolódva (a piros a katepszin K-t jelöli, a zöld pedig a Mac3-at). H, óriássejt az elasztin mellett megtörik (a nyíl az elasztinrost végét mutatja; nyílhegy, SMC az intimába vándorol). I, MGC a sérült rugalmas rétegek közelében, SMC-mentes mediális területtel (a nyíl szétesett elasztinszálat mutat egy óriássejt mellett). E, H és I esetében a vörös a katepszin K-t jelöli; és zöld, SMC a-aktin. D, E és G-től I-ig a skálasávok 130 μm-t jeleznek; és F-ben 30 μm. J, a Paigen-diétás egereknél több elasztinszünet volt, mint a kolátmentes étrendben lévő egereknél; *P
Az elasztinból származó hexapeptid (VGVAPG) fokozza az IL-4 által indukált makrofág-fúziót
Mivel az MGC-ket gyakran a megszakadt elasztinlemezek közelében figyelték meg, azt javasoltuk, hogy az elasztin bomlástermékei megkönnyíthetik a makrofág fúziót. Ennek a hipotézisnek a teszteléséhez egy nemrégiben leírt módszert alkalmaztunk az MGC előállítására tioglikolát által kiváltott peritoneális makrofágokból IL-4 jelenlétében. Az elasztin biológiai aktivitásának nagy része valószínűleg a VGVAPG hexapeptidhez kapcsolódik, amely bőségesen jelen van a tropoelasztinban. 20,21 Ennek a peptidnek a sokféle biológiai aktivitását egy 67 kDa-os elasztinreceptor közvetíti, amelyet számos sejt expresszál, beleértve a makrofágokat is. 9,20 A VGVAPG 10–8 M koncentrációját használtuk, amely korábban a makrofág-vándorlás, az aggregáció és a dendritikus sejtfúzió indukciójában bizonyult a leghatékonyabbnak. 8,9 Az elasztinból származó hexapeptid hozzáadása csaknem kétszeres növekedést okozott a makrofág fúzió sebességében (4A – C. Ábra), amelynek eredményeként néhány, több mint 200 magot tartalmazó óriássejt keletkezett (4D. Ábra).
4. ábra. A, makrofágok és óriássejtek 1 napos IL-4 kezelés után. B, makrofágok és óriássejtek 1 napos IL-4 és VGVAPG kezelés után. C, a fúziós sebesség kvantitatív elemzése (*P
Az MGC-kben lévő katepszin K jelentős szerepet játszik az elasztin lebomlásában és megkönnyíti az SMC migrációját egy kollagén-elasztin réteg révén
Cathepsin K – Pozitív MGC-k humán ateroszklerotikus plakkokban az aorta aneurysmáiból és carotis artériákból
6 beteg carotisának szöveti szakaszait elemeztük, amelyek közül 2 (33%) tartalmazott katepszin K-expresszáló MGC-ket granulomatous infiltrátumukban. A metszetekenkénti átlagos MGC-k száma (átlag ± SD) 2,40 ± 1,14 és 5,00 ± 1,41 (mintánként 10 szakaszt elemeztünk). 9 hasi aorta aneurysmában szenvedő beteg mintáit immunfestették a katepszin K-re, feltárva az MGC-k jelenlétét 1 aortában (11%). Az aorta szakaszaiban az átlagos MGC-k száma (átlag ± SD) 1,50 ± 0,83. Az FBMGC-ket leginkább az intimában figyelték meg (5A – C. Ábra), míg a Langhans-típusú MGC-k elsősorban a média és az intima közötti töredezett területeken helyezkedtek el (5D – I. Ábra); itt jellemzően megfigyelhetők a GCA-ban szenvedőknél. 22.
5. ábra. A nyaki artéria trichrommal festett szakasza FBMGC-vel az intimában. A csillag a nagyított területet mutatja B. B-ben, A nagyított terület A. C-től, Cathepsin K – pozitív FBMGC. A carotis D trichromfoltos szakasza Langhans típusú MGC-kkel a média és az intima találkozásánál. A csillag mutatja a nagyított területet E. E, A nagyított terület D. F-től, Cathepsin K – pozitív Langhans-típusú MGC. G, Langhans-típusú MGC-k a média és az intima közötti töredezett területen. A csillag mutatja a nagyított területet H. H, A nagyított terület G. I-től, Cathepsin K – pozitív MGC-től a média és az intima közötti töredezett területen. A nyilak az MGC-ket mutatják. A, D és G esetében a skálasávok 260 μm-t jeleznek; B-ben és H-ban 65 μm; E-ben 30 μm; C-ban és F-ben 20 μm; az I-ben pedig 130 μm.
Vita
Kísérleteink eredményei azt mutatták, hogy a kolinsavat tartalmazó Paigen-diéta lényegesen több MGC-t indukál az apoE -/- egerek ateroszklerotikus plakkjaiban, összehasonlítva egy széles körben alkalmazott, kolát nélküli nyugati vagy Paigen-diétával. A kolát jelenléte fontosnak tűnik, mivel Paigen diétából való eltávolítása háromszor alacsonyabb MGC-t eredményezett. Az aterogén étrendben lévő kolát kimutatták, hogy sok gén expresszióját befolyásolja a májban, 83 gént indukálva és 23 gént elnyomva; a koleszterin és a zsír befolyásolta 38, illetve 15 gén expresszióját. Az aktivált gének közül a citoszkeletális fehérjék (pl. Vimentin és α-aktin) és a proteázok (pl. A C és B katepszinek) szignifikáns függőséget mutattak a diéta kolát jelenlététől. Ezeknek a fehérjéknek a fokozott expressziója megkönnyítheti a sejtfúziót és növelheti a proteolitikus aktivitást.
A Paigen-diéta során az egerekben található sok elasztintörés az elasztin jelentős lebomlását tükrözi, ami további tényezőket generálhat, amelyek serkentik az óriássejtek képződését. Az elasztin eredetű peptideket 2 betegségben kapcsolták össze az MGC-kkel: GCA és gyűrűs elasztolitikus óriássejtes granuloma. 9,28 In vitro kísérletek kimutatták, hogy az elasztinból származó hexapeptidnek (VGVAPG) 10-8 M-on exponált monocita eredetű dendritikus sejtek óriássejteket képeznek, míg a makrofágok ilyen körülmények között aggregálódnak és granulomákat képeznek. Ezek az eredmények korrelálnak a kísérletünkben a hexapeptid által kiváltott makrofág-fúzió közel kétszeres növekedésével, és arra utalnak, hogy az MGC-k általi elasztinbontás tovább fokozhatja saját képződésüket egy pozitív visszacsatolási mechanizmusban.
Vizsgálatunkban az MGC-k nagy részét a rostos sapka régióban és a media-intima találkozásánál figyelték meg, hajlamosak a belső rugalmas rétegek mentén felhalmozódni. Az MGC-k jelenléte a rugalmas lamina törések mellett jelzi e sejtek fontos szerepét az érfal pusztításában. Ezt alátámasztotta az a megállapításunk, hogy a Paigen-diétás egerekben az MGC-k és az elasztin-törések számának növekedése, összehasonlítva a kolátmentes étrendet fogyasztó egerekkel, jól korrelált (4,0, illetve 3,5-szeres).
Összegzésképpen azt mutatjuk be, hogy az apoE -/- egerek etetése koláttartalmú Paigen-diéta következtében MGC-k alakulnak ki ateroszklerotikus plakkokban; ez hasznos modell lehet az emberi patológiás állapotok esetében, amelyeket MGC-k jelenléte jellemez az erekben. Az immunhisztokémiai és in vitro kísérletek bizonyítékot szolgáltattak arra, hogy az ilyen óriássejtek által termelt katepszin K jelentős szerepet játszik az elasztin lebontásában és az SMC vándorlásában az érelmeszesedés előrehaladása során.
Beérkezett: 2009. szeptember 18-án; a végleges verzió elfogadása: 2010. február 11.
Köszönjük P. Saftignak, PhD, Christian-Albrechts-Universität Kiel, Kiel, Németország, hogy kedvesen ellátta a Ctsk -/- egereket.
A finanszírozás forrásai
Ezt a tanulmányt a kanadai Egészségügyi Kutatóintézetek (CIHR) C04-0435 támogatása támogatta (Dr Brömme); a Kanadai Kutatási Elnöki Díj; és a MOP64447 kutatási támogatás a kanadai egészségügyi kutatóintézetektől.
- A koláttartalmú, magas zsírtartalmú étrend sokmagvú óriássejtek képződését indukálja
- A cukorbetegség endotheliális diszfunkciókat vált ki, de nem növeli a magas zsírtartalmú neointimális képződést
- Az alacsony fehérjetartalmú étrend hatása a patkány hipofízis prolaktint és növekedési hormont termelő sejtjeire
- A nagy intenzitású testmozgás és a magas zsírtartalmú étrend hatása a lipid anyagcserére patkányok májában
- A Dead Cells megkapja a Half-Life Alyx frissítést; Új fegyvert, bőrt és diétát ad hozzá TechRaptor