A leptin szekréciójának stimulálása inzulinnal
Minglun Tsai
Pszichoszomatikus Belgyógyászati Klinika, Kagoshima Egyetem Orvostudományi és Fogtudományi Doktori Iskola, Kagoshima, Japán
Akihiro Asakawa
Pszichoszomatikus Belgyógyászati Klinika, Kagoshima Egyetem Orvos- és Fogtudományi Doktori Iskola, Kagoshima, Japán
Haruka Amitani
Pszichoszomatikus Belgyógyászati Klinika, Kagoshima Egyetem Orvos- és Fogtudományi Doktori Iskola, Kagoshima, Japán
Akio Inui
Pszichoszomatikus Belgyógyászati Klinika, Kagoshima Egyetem Orvostudományi és Fogtudományi Doktori Iskola, Kagoshima, Japán
Absztrakt
A leptinnek döntő szerepe van az ételbevitel szabályozásában és a metabolikus homeosztázis fenntartásában. Bár keveset tudunk a leptin szekréció folyamatáról, úgy gondoljuk, hogy az inzulin, amelynek fontos szerepe van a glükóz és a lipidek metabolizmusában, rövid távon poszttranszkripciós mechanizmuson keresztül, hosszú távon pedig a glükóz metabolizmus révén szabályozza a leptin szekrécióját. A gyomornyálkahártya kiválasztja a leptint, de ezt a mechanizmust még nem sikerült teljesen tisztázni. Az inzulin által szabályozott leptin-szekréció mechanizmusának megértése új kezelési módszerek kidolgozásához vezethet az elhízás és társbetegségei szempontjából, amelyek komoly közegészségügyi problémákat jelentenek.
BEVEZETÉS
A leptint, egy 167 aminosav-hormont 1994-ben fedezték fel [1], és főleg adipociták választják ki. A plazma leptin szintje szignifikánsan korrelál a testtömeg-indexdel (BMI) és a testzsír teljes mennyiségével. [2,3] Egy nemrégiben készült tanulmány arról számolt be, hogy a teljes zsírtömeg a keringő leptin legerősebb előrejelzője. [4] A leptin felfedezése egyértelművé tette, hogy a zsírszövet nemcsak a testtömeg szabályozója, hanem egy endokrin szerv is, visszacsatoló hurkokkal az agy és a perifériás szövetek között. A leptinnek döntő szerepe van az élelmiszer-bevitel és az energiafelhasználás szabályozásában. A leptin a gyomor nyálkahártyájából és a placentából származik. [5,6] Különösen a gyomor nyálkahártyája az egyetlen szövet, amely inkább exokrin, mint endokrin módon szekretálja a leptint. [7]
A plazma leptinszintje az éhezés [8] vagy az energia korlátozása [9] során csökken, és az etetés, [10] túltáplálás, [11] és a műtéti stressz során nő. [12,13] Beszámoltak arról, hogy az inzulin, a glükokortikoidok, a szerotonin és az ösztrogén stimulálják [14–17] Ebben a cikkben a leptin szekréció inzulin általi szabályozására összpontosítunk.
A B ELTIN ÉS A NSZULIN KÖZPONTOK KÖZÖTT A H UMÁNOKBAN ÉS A SZERZŐDÉSEKBEN
A plazma leptin az elhízott személyek BMI-jével és az éhomi plazma inzulinszinttel társult. Embereknél a plazma leptin szintje pulzáló és cirkadián mintát mutatott, éjszaka tetőzött és reggel elérte a mélypontját. [18–20] Sinha és mtsai arról számoltak be, hogy a leptin szintjének cirkadián ritmusa nem jár együtt az inzulinszinttel vagy az élelmiszer-fogyasztással. [18] Ezzel szemben Schoeller és munkatársai azt javasolták, hogy a napi leptinszintet az étkezés időzítése megváltoztassa. [20] Számos vizsgálatot végeztek az étkezés utáni inzulin és leptin növekedése közötti kapcsolatról; az inzulin leptinre gyakorolt hatására vonatkozó következtetések azonban ellentmondásosak.
Dagogo-Jack és munkatársai arról számoltak be, hogy a plazma leptinszintje nem változik étkezés után, és arra a következtetésre jutottak, hogy legalább rövid távon az inzulin nem növeli az emberekben a leptin szekrécióját. [21] Egyes kutatók hasonló eredményekről számoltak be. [22–24] A glükózbilincs-technikával végzett vizsgálatok eredményei alátámasztják azt a megállapítást, hogy az inzulin nem rövid távú szabályozója a leptin-szekréciónak. A fiziológiai és szuprafiziológiai euglikémiás-hiperinsulinémiás bilincsek az inzulinra adott válasz hatására 120 vagy 200 percig nem változtatták meg a plazma leptinszintjét, függetlenül az alanyok inzulinérzékeny vagy inzulinrezisztens státuszától [25,26] és a plazma leptin szintjétől csak több mint 4 óra múlva nőtt. [27–29] Hasonló megállapításokról számoltak be a 2-es típusú diabetes mellitusban szenvedő betegeknél is. [28,30] Vidal és mtsai arról számoltak be, hogy sem a kalóriarajzolás, sem a 3 órás euglikémiás-hiperinsulinémiás bilincs nem változtatta meg a szintet A leptin mRNS mennyisége a hasi szubkután zsírszövetben, annak ellenére, hogy változtak az anyagcsere-paraméterek, például csökkent inzulinémia, glikémia és nyugalmi anyagcsere arány, valamint megnövekedett plazma keton test. Azt javasolták, hogy a leptin gén expresszióját vagy nem szabályozzák akutan, vagy nem szabályozzák az éhezéssel kapcsolatos metabolikus tényezők. [31]
Másrészt Saad és munkatársai ellentmondásos eredményről számoltak be. A plazma leptinszintjének akut étkezés utáni növekedését figyelték meg. [32] Hasonló eredményeket jelentettek Saad és munkatársai, akik glükózbilincset alkalmaztak embereknél. A szerzők azt sugallták, hogy számos korábbi vizsgálat nyilvánvalóan figyelmen kívül hagyta a leptinszint csökkenését a sóoldat infúziója miatt, és ezért nem tudták kimutatni az inzulin leptinre gyakorolt akut hatását. [33] Carlson és mtsai arról számoltak be, hogy az étkezés utáni leptin növekedés megfelel az inzulinszintnek 15 és 30 percnél. [34] Az étkezés utáni leptin növekedésről rágcsálóknál is beszámoltak. [35,36] Otukonyong és munkatársai kijelentették, hogy a magas zsírtartalmú ételek fogyasztása befolyásolta a leptin szekrécióját, ezáltal az étkezés után akár 200 percig is növelte az inzulint. [36] Koopmans és mtsai arról számoltak be, hogy a farmakológiai inzulininfúzió 2 óra alatt stimulálta a leptin növekedését, bár a rágcsálók fiziológiai inzulininfúziója után 4 órára van szükség a plazma leptinszint emelkedésének megfigyeléséhez [37]. Pagano és mtsai arról is beszámoltak, hogy az inzulin akut hatással volt a leptin szekréciójára. [38] Ezenkívül az inzulin fontos a plazma leptinszintjének akut növekedésének kiváltására streptozotocin által kiváltott cukorbetegségben szenvedő patkányokban. [39,40]
Az euglikémiás-hiperinsulinémiás bilincsek mellett egy hipoglikémiás-hiperinsulinémiás bilincsről is beszámoltak [41]. A hiperinsulinémiás euglikémia során a szérum leptinszint fokozatosan emelkedett 180 perc elteltével. A hipoglikémiás bilincs alkalmazásakor megfigyelt leptin-profil azonban eltérett a leptin-profiltól az euglikémiás körülmények között: a növekedés kisebb volt, és késett. Továbbá, Wellhoener és munkatársai, alacsonyabb szérum leptinszint-emelkedést mutattak ki hipoglikémiás körülmények között, mint euglikémiás körülmények között, az inzulin infúzió azonos sebességének ellenére; a befogás során beadott teljes dextróz mennyisége szignifikánsan összefüggött a szérum leptin szintjének változásával. [42] Azt sugallták, hogy a leptin szekréciója főleg az emberek glükóz metabolizmusával függ össze. Az éhezés során a leptin szekréciójának csökkenése közvetlenül vagy közvetve a csökkenő glükózszint következménye lehet. A hosszan tartó hipoglikémia csillapító hatását a hiperinsulinemia által kiváltott leptin szekrécióra inkább a hipoglikémiára adott válasz, mint maga a hipoglikémia okozhatja.
L NSZSIN IDŐBE IDŐZÍTETT DIPCITÁTOK L EPTIN SZABÁLYOZÁSA
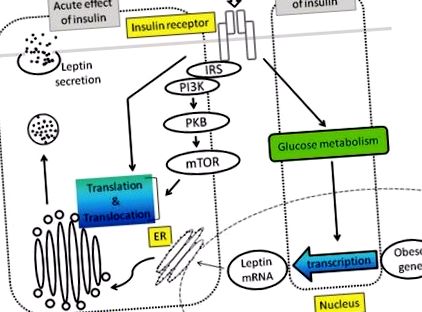
Hogy a leptin szekréciójának inzulinszabályozása emberben és rágcsálókban akut-e, percektől néhány óráig folytatható, ellentmondásos. Másrészt in vitro vizsgálatok kimutatták, hogy az inzulin néhány órán keresztül nem befolyásolja a leptin mRNS szintjét. A leptin szekréció inzulin stimulációját az 1. ábra szemlélteti .
Leptin szekréció Az inzulin egy poszttranszkripciós mechanizmus révén stimulálja a leptin szekrécióját, amelyet főként a PI3K-PKBmTOR út vagy más ismeretlen út közvetít. Felvetődött, hogy az inzulin krónikus hatását a glükóz metabolizmus közvetíti.
IRS: Inzulinreceptor szubsztrát, PI3K: Foszfoinozidid-3-kináz, PKB: Protein-kináz B, mTOR: emlős rapamicin célpont, ER: Endoplazmatikus retikulum
Moreno-Aliaga és munkatársai 3T3-L1 sejtekben kimutatták, hogy a leptin mRNS 48 órás inzulinkezelés után megnövekedett, és a 2-dezoxi-D-glükóz (2-DG), amely a glükóz transzportjának kompetitív inhibitora, és foszforilezés. Arra a következtetésre jutottak, hogy az inzulin által stimulált glükóz metabolizmus és nem önmagában az inzulin közvetíti az inzulin hatását a leptin mRNS növelésére. [43]
A kutatók gyakran használják a 3T3-L1 adipocitákat az adipogenezis, a zsírsav anyagcsere és az inzulin által szabályozott kereskedelem tanulmányozására. A standard izobutil-metilxantin/dexametazon/inzulin (Ibmx/Dex/Ins) protokoll alkalmazásakor a 3T3-L1 fibroblasztok érett adipocitákká differenciálódnak, de a leptin expressziója nagyon korlátozott. [44] Zeigerer és munkatársai módosították a standard protokollt, hogy jobban meghatározzák az adipociták leptin szekréciójának alapját képező molekuláris mechanizmusokat. Peroxiszóma proliferátor-aktivált receptor (PPAR) gamma agonistát adtak az Ibmx/Dex/Ins differenciálási koktélhoz, amely ötszörös növekedést okozott a leptin mRNS szintjében. Ilyen körülmények között az inzulinstimuláció 15 percig a leptin szekréciójának kétszeres növekedését indukálta új fehérjeszintézis nélkül. A fokozott leptin szekréció nem a glükóz anyagcserében bekövetkezett változások miatt következett be. Az inzulin leptin exocitózisra gyakorolt hatását a brefeldin A blokkolta, de a foszfoinozidid-3-kináz (PI3K) inhibitor wortmannin vagy a fehérjeszintézis inhibitor cikloheximid nem. Ez arra utal, hogy a leptin a 3T3-L1 adipociták szabályozó szekréciós rekeszébe irányul, ahol felszabadulását az inzulin PI3K-független mechanizmus révén stimulálja. [45]
A leptin mRNS kimutatható volt érett 3T3-442A sejtekben, de nem korai sejtekben. [46] Továbbá a leptin mRNS szintje normalizálódott a 3T3-F442A preadipocyták egerekbe történő transzplantációja után. [47] Ezek a megállapítások arra utalnak, hogy a leptin mRNS expressziója a sejttenyésztési vonalaktól vagy a sejtek érettségétől függ, és néhány fontos tényező hiányozhat ex vivo.
Amikor a patkány epididimális zsírt inzulinnal vagy inzulin nélkül inkubálták 4 órán keresztül in vitro, a leptin szekréciója a vizsgált minden idõpontban körülbelül 80% -kal növekedett. 10 perces inzulinkezelés után a szövetekkel társult leptin mennyisége csökkent, feltehetően a fokozott szekréció miatt. Később mind a szövetekkel társult leptin, mind a teljes leptin termelés megnőtt az inzulinnal kezelt zsírszövetben. Az inzulinkezelés előtt immunfestéssel kimutatták a leptint az endoplazmatikus retikulumban. Az inzulinkezelés után a leptin festése sok sejtben elhalványult, és a plazmamembrán közelében egy keskeny sávra korlátozódott. Ezek az eredmények arra utalnak, hogy az inzulin mind a leptin szekrécióját, mind a termelését növeli, és serkenti a leptin transzportját az endoplazmatikus retikulumból.
Mueller és munkatársai arról számoltak be, hogy a leptin szekréció inzulin által szabályozott növekedése szorosabban kapcsolódott az adipociták által felvett glükóz mennyiségéhez, mint az inzulin koncentrációjához. A leptin szekrécióját a 2-DG gátolta, és a glükóz magas koncentrációja megfordította. A glükóztranszport két gátlója, a floretin és a citokalazin-B, valamint a glikolízis 2 gátlója, a jód-acetát és a nátrium-fluorid gátolta a leptin szekrécióját is. [49] Ezenkívül kiderült, hogy a metformin és a vanádium, antidiabetikus szerek, amelyek növelik a perifériás szövetek glükózfelvételét, fokozzák a glükózfelvételt és gátolják a tenyésztett adipociták által a leptin szekrécióját. A leptin szekréciójának gátlása a metforminnal összefüggésben volt a glükóz laktáttá történő metabolizmusának növekedésével, így a leptin glükóz felhasználásával történő növelésének hatása magában foglalja a glükóz metabolizmusát anaerob laktáttermelésen kívüli sorsra. [50] Megállapították, hogy a glükóz transzport és az anyagcsere fontos tényezők a leptin expressziójának és szekréciójának szabályozásában.
SZÉLESZTEM A DOSZTIKÁT A SZERZŐDÉSEKBŐL
Saladin és mtsai kimutatták, hogy a leptin mRNS szintje patkányokban táplálékfelvétel és inzulininjekció hatására növekedett, és koplalással csökkent; ezenkívül az inzulin fokozta a leptin mRNS expresszióját az adipocitákban. [14] Zheng és mtsai arról számoltak be, hogy a hasi zsír (epididymális és perirenalis zsírpárnák) magasabb leptin mRNS-szintet mutat, mint a szubkután zsír. [55] A leptin mRNS szintje megemelkedett a hasi zsírban lévő éhgyomri patkányok 2,5 órás infúziója után, azonban a leptin mRNS szintje nem változott a szubkután zsírban.
Lee és mtsai az etetésre adott válaszként a megnövekedett szérum leptin mechanizmusait mutatták be, metabolikus jelölések segítségével a leptin bioszintézisének, szekréciójának és forgalmának közvetlen értékelésére. [56] Az éhezés csökkentette a szérum leptin, a zsírszövet leptin tartalmát és a leptin szekrécióját 3 órás inkubálás alatt. Az inzulin in vitro nem fokozta akutan a leptin bioszintézisét, de a pulzus-chase vizsgálatok azt mutatták, hogy etetett patkányok zsírszövetében az inzulin 30 és 60 perc üldözés után felgyorsította a leptin szekrécióját. A tanulmányokat végző kutatók arra a következtetésre jutottak, hogy az éhezés helyett az etetés több posttranszkripciós szinten befolyásolta a leptin termelést: szintézis, szövetraktározás, forgalom és szekréció.
H PÁROKTÓL SZÁMÍTOTTAM DOSZTÁT
Kolaczynski és munkatársai arról számoltak be, hogy az inzulin közvetett módon szabályozza az emberi zsírszövet leptintermelését. [30] Megvizsgálták, hogy a leptin mRNS in vitro és in vivo megváltozik-e az inzulinra adott válaszban euglikémiás és hiperglikémiás körülmények között. Az egészséges sovány, elhízott és 2-es típusú cukorbetegségben szenvedő alanyokat inzulinnal infundálták 5 órán át egy euglikémiás szorítóban és 64–72 órán át egy hiperglikémiás szorítóban. Az izolált hasi zsírsejteket inzulinnal inkubáltuk 96 órán át. A rövid távú euglikémiás-hiperinsulinémia nem volt hatással a keringő leptin szintjére. Az elhúzódó hiperglikémiás bilincs során a leptin emelkedését legalább 40 órával később észlelték. In vitro inzulin jelenlétében a leptin mRNS 72 óra múlva növekedett, majd a táptalajba szekretált leptin növekedése következett be. Arra a következtetésre jutottak, hogy az inzulin nem stimulálja akutan a leptin termelését; mindazonáltal az inzulin hosszú távú hatása a leptin termelésére mind in vivo, mind in vitro kimutatható volt [30].
Széles körben elfogadott, hogy a dexametazon serkenti a leptin szekrécióját. Russell és munkatársai a leptin expressziójának in vitro szabályozását vizsgálták súlyos elhízott nők és férfiak zsírszövetében inzulinnal és/vagy dexametazonnal történő tenyésztés előtt és után. A tenyésztés előtt a leptin mRNS szintje és a leptin szekréciója nagyobb volt a szubkután és az omentális zsírszövetben. A dexametazon egy nap tenyésztés után átmenetileg megnövelte a leptin mRNS-t mindkét depóban, de a leptin-szekréció csak az omentális zsírszövetben nőtt. Az inzulin egyik depóban sem növelte a leptin mRNS-t, de a tenyésztés hét napja alatt fokozta a leptin szekrécióját a szubkután szövetben. Az inzulin és a dexametazon kombinációja mindkét depóban növelte a leptin mRNS és a leptin szekrécióját az első napon, és a tenyésztés hét napja alatt fenntartotta a leptin expresszióját. Az inzulin és a glükokortikoid depó-specifikus hatású volt, és szinergikusan működött, mint az elhízott alanyok omentális és szubkután zsírszövetében a leptin expressziójának hosszú távú szabályozója. [57] Wabitsch és munkatársai arra a következtetésre jutottak, hogy mind az inzulin, mind a kortizol az emberi zsírszövet leptin-expressziójának fiziológiai szabályozói [58].
Részben ellentmondásos tanulmányról számoltak be Casabiell és munkatársai [59]. Beszámoltak arról, hogy az inzulin kettős hatást fejt ki a leptin szabályozásában: korai (kevesebb, mint 48 óra) gátló hatás, amelyet (48–96 órával később) stimuláció követ. Míg a gátló fázist minden vizsgált glükózkoncentrációnál megfigyelték (tartomány, 1 mM – 25 mM), a stimulációs fázisban fiziológiai vagy szuprafiziológiai glükózkoncentrációk jelenléte szükséges. A leptin szekrécióját glükózfelvétel-gátlókkal eliminálták. Az inzulinnak ez a kettős hatása nem a leptin mRNS szintjének változásának tudható be, ami arra utal, hogy teljes mértékben a poszttranszlációs mechanizmusoktól függ. Arra a következtetésre jutottak, hogy az inzulinhoz kapcsolódó gátlás és stimuláció az inzulin által kiváltott glükózfelvétel növekedése által kiváltott metabolikus változásoknak köszönhető.
A L EPTIN NSZULINI SZABÁLYOZÁSÁNAK SZABÁLYOZÁSA G ASTRIC M UCOSA ÁLTAL
Bado arról számolt be, hogy a gyomornyálkahártya szekretálja a leptint, [5] és mind a kolecisztokinin-8 etetése, mind a beadása növeli a plazma leptint. Cammisotto és mtsai kimutatták, hogy a gyomor nyálkahártyája nagyban hozzájárul a keringő leptin szintjéhez, különösen az étkezéskor mért szintekhez. [7] Ennek ellenére a gyomornyálkahártya által a leptin inzulin által szabályozott szekréciójáról nagyon keveset tudni. További vizsgálatokra van szükség a leptin és az inzulin kapcsolatának tisztázásához.
K ÖVETKEZTETÉS
Az inzulin fontos tényező a leptin szekréció stimulálásában. Vitatható, hogy in vivo aktivitása akutnak tekinthető-e. Az inzulin azonban transzkripciós vagy poszttranszkripciós mechanizmus révén szabályozza a zsírsejtek hosszú távú leptin-szekrécióját. A szabályozást közvetítheti a glükóz metabolizmusa, de a mechanizmus még nem teljesen ismert. Az utóbbi években kevés tanulmány vizsgálta az inzulin által szabályozott leptin szekrécióját a zsírsejtek által. Ennek oka lehet a hagyományos 3T3-L1 adipocita sejtvonal által expresszált leptin mRNS nagyon alacsony szintje, vagy azért, mert hiányoznak az in vivo állapotot szorosan utánzó sejtvonalak, vagy azért, mert a hormonális jelekre nagyon érzékeny sejttörzs nem áll rendelkezésre. A leptin szekréciójának rövid és hosszú távú inzulin által szabályozott mechanizmusainak megértése új kezelések kidolgozásához vezethet az elhízás és társbetegségei szempontjából, amelyek komoly közegészségügyi problémákat jelentenek.
Lábjegyzetek
A támogatás forrása: Nulla
Összeférhetetlenség: Egyik sem nyilatkozott
- Az immunreaktív inzulin szekréció vizsgálata NZO egerekben in vivo SpringerLink
- Felkészülés a mély agyi stimulációs műtétre Csendes-óceáni mozgászavarok
- Az elhízás elleni harcban a leptin rezisztencia leküzdése
- A metabolikus szindróma prevalenciája az elhízott gyermekpopulációban a szérum leptinhez viszonyítva
- Ápolási beavatkozások 2. típusú cukorbetegség inzulin-koffeinrezisztencia - a cukorbetegség egészsége