Normál és Preeclampsia szövődményes terhességek placenta szöveti transzkriptómjának elemzése
E. A. Trifonova
Orvosi Genetikai Kutatóintézet, Szibériai Kirendeltség, Orosz Orvostudományi Akadémia, Nab. Ushayky 10, 634050, Tomszk, Oroszország
Tomszki Állami Egyetem, Lenina Avenue, 36, 634050, Tomszk, Oroszország
T. V. Gabidulina
Szibériai Állami Orvostudományi Egyetem, az Orosz Föderáció Egészségügyi Minisztériuma, Moskovsky Trakt, 2, 634050, Tomszk, Oroszország
N. I. Ershov
Citológiai és Genetikai Intézet, Szibériai Kirendeltség, Orosz Tudományos Akadémia, Prosp. Lavrentieva 10, 630090, Novoszibirszk, Oroszország
V. N. Serebrova
Orvosi Genetikai Kutatóintézet, Szibériai Kirendeltség, Orosz Orvostudományi Akadémia, Nab. Ushayky 10, 634050, Tomszk, Oroszország
A. Yu. Vorozhishcheva
Városi Klinikai Kórház, 1. sz., Ul. Khitarova, 32, 654000, Novokuznyeck, Oroszország
V. A. Sztyepanov
Orvosi Genetikai Kutatóintézet, Szibériai Kirendeltség, Orosz Orvostudományi Akadémia, Nab. Ushayky 10, 634050, Tomszk, Oroszország
Tomszki Állami Egyetem, Lenina Avenue, 36, 634050, Tomszk, Oroszország
Absztrakt
BEVEZETÉS
Az eddig elvégzett számos genom-szintű asszociációs vizsgálat (GWAS) értékes információkat szolgáltatott a multifaktoriális betegségek (MFD) genetikai felépítéséről, és több fenotípushoz kapcsolódó egyetlen nukleotid polimorfizmus (SNP) kockázati alléljait tárta fel. Azonban a komplex tulajdonságok öröklésének csak egy viszonylag kis részét magyarázzák, és csak nagyon enyhe hatást gyakorolnak a társult változatok fenotípusára [1]. Ezek az eredmények felvetik a hiányzó öröklődési problémát, amelyet ma intenzíven tárgyalnak. Az MFD-re való hajlam örökletes komponensének tanulmányozásával kapcsolatos GWAS-hatékonyság egy másik korlátozása a tagSNP használatához kapcsolódik. A GWAS-ban azonosított kockázati allélok általában nem tartoznak az „ok-okozati” közé, hanem a funkcionálisan szignifikáns variáns-allélokkal kötődési egyensúlyhiányban (LD) vannak [2]; ezért a GWAS eredmények biológiai értelmezése komoly problémát jelent.
A GWAS-ban kimutatott polimorfizmusokhoz kapcsolódó „kauzális” allélváltozatok azonosításának jelenlegi megközelítései a kódoló vagy átírt genomi régiók elemzésén alapulnak [2-4]. A GWAS-ban azonosított SNP-k döntő többsége azonban a nem átírt régiókban található. Nem kapcsolódnak az exonokban elhelyezkedő változatokhoz, és hatásuk mechanizmusa nyilvánvalóan a génexpresszió szabályozásához kapcsolódik [5, 6]. Ezért a posztgenomikai módszerek (amelyek könnyen információt nyújtanak a gének, az RN A és a fehérjék különböző hierarchikus szinteken alapfunkcióit koordináló szinte minden komponensről) különösen relevánsak lesznek az MFD genetikai felépítésének és molekuláris mechanizmusainak tanulmányozása során. Az egyik ilyen megközelítést, nevezetesen a génexpresszió nagyteljesítményű mérését mikroarray technológiával alkalmazták a jelen munkában a normál terhesség és a preeclampsia (PE) transzkripciós mintázatának jellemzésére, amely az egyik legsúlyosabb terhességi komplikáció.
A preeclampsia, amely a többszörös szervi diszfunkció szindrómához kapcsolódik, egy olyan speciális szindróma, amely a terhesség 20. hete után jelentkezik, és hipertónia és proteinuria jellemzi. A PE-t a terhességi hipertóniás rendellenességek 70% -ánál diagnosztizálják, és a betegség súlyos és kombinált formáinak előfordulási arányának növekedését figyelték meg az elmúlt években [7]. Az etiopatogenezissel kapcsolatos elméletek nagy száma (neurogén, hormonális, placenta, immunológiai, genetikai stb.), Számos tanulmány a betegség kialakulásának mechanizmusairól és az új terápiák megjelenéséről a PE továbbra is az anyai és perinatális morbiditás és mortalitás. A betegség a halandó születések és vetélések akár 70% -áért felelős; a perinatális veszteségek kockázata csaknem ötszörösére nő a PE-ben [7, 8].
A modern elképzelések szerint a preeclampsia etiopatogenezise szorosan összefügg a méh spirál artériáinak nem megfelelő citotrofoblast inváziójával és az ischaemia-reperfúziós szindróma kialakulásával, amely oxidatív stresszt és szisztémás gyulladást vált ki [9, 10]. Az etiológiai tényezők és ennek a rendellenességnek a mechanizmusai továbbra sem tisztázottak és fokozott figyelmet igényelnek. A PE valószínű jelölt biomarkereinek azonosítása és a terhességi szövődmények molekuláris mechanizmusainak tanulmányozása érdekében elemeztük a placenta transzkriptómának a PE-re és a fiziológiai terhességre jellemző mintázatait, mivel a placenta szövet nyilvánvalóan kulcsszerepet játszik a PE. A mikro-sugarak alkalmazásának stratégiája ebben az összefüggésben elég ésszerűnek és hatékonynak tűnik, mivel lehetővé teszi, hogy alaposan megvizsgálják a preeclampsia patofiziológiájához kapcsolódó gén expresszió változását transzkriptóm szinten.
KÍSÉRLETI
A vizsgált csoportok jellemzői
Összesen 10 PE-ben szenvedő és 11 fiziológiás terhességben szenvedő beteget (kontrollcsoport) vizsgáltunk (1. táblázat). A kérdőív tartalmazott demográfiai információkat (etnikai hovatartozás) és antropometriai paramétereket (testmagasság, súly), életmódot (dohányzási szokás, pszichoaktív szerekkel való visszaélés), valamint információkat a szomatikus és szülészeti-nőgyógyászati előzményekről. A PE diagnosztizálását különböző súlyosságú vezető klinikai tünetek, például proteinuria, ödéma, magas vérnyomás (140 Hgmm fölötti szisztolés vérnyomás, 90 Hgmm feletti diasztolés vérnyomás) alapján diagnosztizálták a betegségek nemzetközi osztályozásának 10. felülvizsgálata szerint. A PE súlyosságát a 2012-es klinikai protokoll kritériumai alapján értékelték: „Hypertonia terhesség alatt. Preeclampsia. Eclampsia ”[11].
Asztal 1
A vizsgált csoportok jellemzői
| Átlagos életkor, évek | 26 ± 2 | 28 ± 3 | 0,241 |
| Átlagos súly, kg | 60 ± 7 | 62 ± 6 | 0,324 |
| Testtömeg-index, BMI | 23 ± 4 | 23 ± 3 | 0,832 |
| Az átlagos maximális szisztolés vérnyomás, Hgmm | 162 ± 19 | 121 ± 3 | 0,0001 |
| Az átlagos maximális diasztolés vérnyomás, Hgmm | 104 ± 13 | 80 ± 4 | 0,0001 |
| Szállítási idő, hét | 38 ± 1 | 40 ± 2 | 0,009 |
| Születési súly, g | 2783 ± 560 | 3549 ± 345 | 0,004 |
| Hossza születéskor, cm | 50 ± 4 | 53 ± 2 | 0,021 |
| Koraszülés, % | 50 | 0 | 0,012 |
| Krónikus betegségek, % | 60 | 50 | 0,575 |
* A szignifikancia szintjét a csoportok összehasonlításával határoztuk meg Mann-Whitney teszt vagy Fisher pontos tesztje segítségével.
A PE-betegek csoportja heterogén volt mind súlyosságát tekintve (a vizsgálatban hat közepesen súlyos és négy súlyos PE-ben szenvedő beteg vett részt), mind a korábbi betegségek és társbetegségek jelenléte szempontjából. Négy betegnél diagnosztizáltak PE-t háttérbetegségek hiányában; másoknál a terhességi komplikációk az extragenitális betegségek hátterében alakultak ki, ideértve a hipo-/hipertenzív típusú neurocirkulációs dystóniát, a krónikus pyelonephritis-t, a krónikus kolecystitist és a krónikus artériás hipertóniát. A kontrollcsoport hat nőstényének krónikus pyelonephritist és krónikus kolecisztitist is diagnosztizáltak. A gravidák életkora mindkét csoportban 18 és 33 év között mozgott; a csoportok összehasonlíthatók voltak az átlagéletkor szempontjából. Statisztikailag szignifikáns különbségeket találtunk a csecsemők testmagasságában és súlyában a kontrollcsoport és a betegcsoport között. A csoportok az artériás vérnyomás és a születés ideje tekintetében is különböztek.
Placenta minták gyűjtése
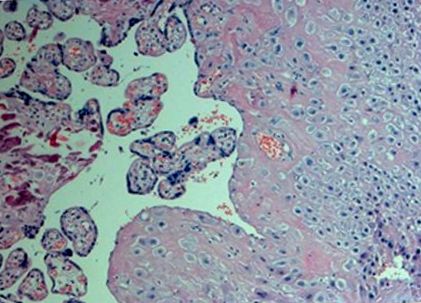
Megvizsgáltuk a placenta disztális (anyai) részét. A szövetekből a szállítás után azonnal mintát vettünk (a minta ischaemia ideje nem haladta meg a 10 percet). Placenta szövetmintákat vettünk a köldökzsinórhoz közeli központi területekről, 0,5 cm-es placenta mélységben. A mintákat a placenta makroszkopikusan normális szakaszaiból (vérzés, meszesedés, nekrózis vagy fibrin lerakódás nélkül) gyűjtöttük be, anélkül, hogy közbenső ereket vezettünk volna be, sóoldattal mostuk az anyai vér és a magzatvíz visszamaradásának eltávolítására, azonnal RN Alaterbe merítettük (Ambion, UK ), és át kell helyezni –80 ° C-on tárolásra az RN A izolációs eljárásig. A szövettani vizsgálat során az összes biopsziás mintában fibrinoid nekrózis gócokkal és kicsi meszesedéssel rendelkező chorion villusokat és decidua szöveteket tártak fel (1. ábra).
A vizsgált placenta biopsziás minták egyikének mikrográfiája. Hematoxilinnel és eozinnal festett.
RNS izolálás
A szövetmintákat (100-200 mg) homogenizáltuk TissueLyser (Qiagen) segítségével Trizol-ban; Ezután az RN A-t a standard protokoll alkalmazásával izoláltuk. A teljes RN A koncentrációját Nanodrop ND-1000 alkalmazásával határoztuk meg, a vízben mért 260 nm-es abszorbancia alapján. A minták minőségét Agilent 2100 Bioanalyzer kapilláris elektroforézis rendszerrel (Agilent Technologies Inc., Palo Alto, USA) és spektrofotometriás letapogatással ellenőriztük.
Microarray elemzés
A placentaszövetben a génexpresszió genomszintű profilját meghatároztuk HT-12 BeadChip mikrorayákon (Illumina, USA) végzett hibridizációval, amely több mint 48 000 transzkriptumról tartalmaz információt. Hibridizáció után a mikrorajkákat Illumina BeadArray Reader eszközzel pásztáztuk. A nyers adatokat a BeadStudio v3 szoftvercsomag (Illumina) segítségével minden minta (Sample Probe Profile) jelerősségének átlagértékévé alakítottuk át.
Bioinformatikai elemzés
Az adatokat R szoftveres környezetben elemeztük a limma programcsomag segítségével [12]. Nem paraméteres háttérkorrekciót, majd kvantilis normalizálást (neqc függvény) hajtottunk végre a teljes adathalmazon. Azok a példányok, amelyeket a kísérleti csoportok legalább egyikének összes mintájában azonosítottak (detektálási p-érték 2. ábra mutatja a hőtérképet a nők hierarchikus csoportosulásának eredményeivel a 63 DEG expressziós szint szerint. Látható hogy az egyik PE-s beteg egy kivételével egy csoportba esik, míg a fiziológiás terhességű nők a másikba tartoznak. Az egyik PE-mintát a kontroll csoportba sorolták, valószínűleg a placenta szöveti gének transzkripciós szintjeinek jelentős interindividuális változékonysága miatt. jelenséget számos emberi sejtvonalban figyeltek meg: különösen a hepatocita transzkriptóm sejtvonalaiban [22, 23].
* Információk a GeneCards adatbázisból (http://www.genecards.org/), kiegészítéssel együtt.
A DEG elemzésével a DAVID online erőforrás segítségével elemeztük a PE kialakulásához kapcsolódó biológiai folyamatokat (3. ábra). Ezen gének fehérjetermékeinek molekuláris funkcióinak fő kategóriái közé tartozik a különféle ingerekre adott válasz, immunfolyamatok, a sejtkommunikáció szabályozása, intracelluláris jelátviteli kaszkádok stb., a leukociták transzendoteliális migrációja és a GTPáz aktivátorok által közvetített jelátviteli utak valószínűleg részt vesznek a PE molekuláris mechanizmusaiban.
A DEG-ket érintő főbb biológiai folyamatok, amelyek preeclampsia-hoz kapcsolódnak (p. 4. ábra). A felépített hálózatban az asszociációk főként a „szövegbányászaton” alapulnak (amelyet egy cikk kivonata említ). Meg kell említeni a koexpressziós klasztert, amely magában foglalja a RAC2, CYBA, TYROBP, HMHA1, ITGB2, LYN és LCP1 géneket. Ezen túlmenően a LEP és receptorai, a SIGLEC 6, valamint az efrin és a LYN kináza bizonyos érdeklődésre tartanak számot.
Fehérje-fehérje kölcsönhatások a DEG termékek között. A fehérjék körök; a körök közötti színvonal jelzi a fehérje-fehérje kölcsönhatás bizonyítékkategóriáját: sárga - irodalmi adatok („szövegbányászat”), fekete - a génexpresszió elemzése szerint, lila - a kísérleti eredmények, kék - bizonyítékok az adatbázisokból, rózsaszínű - összesített bizonyíték
Vizsgálatunk feltárta a PE súlyosságától függõ differenciál gén expresszió sajátosságait is (3. táblázat). Összesen nyolc DEG-t azonosítottak (FDR 5. ábra). Meg kell jegyezni, hogy kis mennyiségű közös gén mellett (21 gén), amelyek mind a súlyos, mind a mérsékelt PE-ben differenciáltan expresszálódtak, több mint 60 ° csak a patológia súlyos formájára volt jellemző. E gének funkcionális annotációjának eredményei a DAVID web-erőforrásban számos olyan biológiai folyamatra utalnak, amelyek statisztikailag szignifikánsan összefüggenek a súlyos PE kialakulásával, például a peptid vagy poliszacharid antigének feldolgozása és bemutatása, valamint a fehérje hajtogatása (4. táblázat ). Az ezeket a géneket érintő metabolikus útvonalak elemzése szintén megmutatja az antigének feldolgozásának és bemutatásának mechanizmusainak fontos szerepét a súlyos PE molekuláris patogenezisében (a KEGG és a BIOCART A adatbázisok szerint).
Venn-diagram, amely a génexpresszió profilozásának eredményeit mutatja közepes és súlyos preeclampsia, valamint fiziológiai terhesség esetén. DEG-ek - olyan gének, amelyek másképp expresszálódnak a preeclampsiaban szenvedő és fiziológiás terhességű nőknél (kontrollcsoport). A nyíl a génexpresszió növekedését (↑) vagy csökkenését (↓) mutatja.
4. táblázat
Fő biológiai folyamatok, amelyek a preeclampsiára jellemző, differenciálisan expresszált géneket tartalmazzák
| Peptidek vagy poliszacharid antigének feldolgozása és bemutatása II. Osztályú MHC molekulákon keresztül (GO: 0002504) | HLA-DPA1, CD74, HLA-DMA, HLA-DRA | 0,0421 |
| Exogén peptidantigének feldolgozása és bemutatása (GO: 0002478) | HLA-DMA, CD74, HLA-DRA | 0,0453 |
| Chaperone által közvetített fehérje hajtogatás (GO: 0051085) | ERO1L, HLA-DMA, CD74 | 0,0467 |
| De novo poszttranszlációs fehérjehajtogatás (GO: 0051084) | ERO1L, HLA-DMA, CD74 | 0,0478 |
| Kibontott fehérjemolekulák reakciói (GO: 0006986) | ERO1L, HSPH1, HSPA1A, HERPUD1 | 0,0489 |
* Jelentőségi szint, beleértve Benjamin-Hochberg többszörös tesztkorrekciót, amely jellemezte e génkészlet hozzárendelésének pontosságát egy bizonyos biológiai folyamathoz.
VITA
Nem találtunk összefüggést a PE kialakulása és az olyan kánon útvonalak között, mint a kóros apoptózis és az angiogenezis, amint azt számos tanulmány leírta [16, 19, 30, 31]. Ez valószínűleg annak tulajdonítható, hogy a placenta szövetében a génexpressziós profilok interetnikusan változnak, a genom szabályozó régióinak populációs differenciálódása, vagy az eltérő kritériumok (populáció nagysága, szállítási ideje, a betegség súlyossága stb.) Miatt. ) a vizsgált csoportok kialakításakor használták. A PE-ben szereplő transzkriptóm egyedi vizsgálatai során alkalmazott biopsziás minták eltérő placentális lokalizációja egy másik tényező, amely nyilvánvalóan befolyásolja ezen ellentmondások előfordulását. Így a nagy áteresztőképességű szekvenálás (RN A-Seq) jelentős különbségeket tárt fel a génexpressziós profilokban az emberi placenta amnionjában, chorionjában és deciduájában [32]. Korábban hasonló eredményekre jutottak, amikor a placenta különböző részein a transzkriptóm minták mikroarray elemzését végezték [33].
A DEG funkcionális annotáció eredményeinek fent említett különbségei ellenére továbbra is érdekes, hogy egyes munkánk során azonosított DEG expressziós szintjének változását más vizsgálatok is leírták (5. táblázat).
5. táblázat
Ebben a vizsgálatban azonosított differenciálisan expresszált gének, amelyeknek a preeclampsia-val való összefüggését korábban a placenta szöveti transzkriptómra összpontosító vizsgálatok mutatták ki
- Az elhízott betegek zsírszöveti makrofágjai (ATM) megnövekedett prolaktinszintet szabadítanak fel
- Testégető zsírelemzés fogyókúrás gépi fogyókúra mester - Kínai szépségszalon felszerelés, lézer
- Testösszetétel - testzsír-elemzés
- Az ADME toxikológiai tesztje a piaci növekedés előrejelzését 2020-tól 2026-ig Az ipar világméretű elemzésének középpontjában áll
- Testösszetétel-elemzés - Közép-Florida wellness