A Schisandra gyümölcsecet csökkenti a zsírtartalmat magas zsírtartalmú diétás patkányokban
Rui Yuan
1 Farmakológiai Tanszék, Gyógyszerészeti Főiskola, Beihua Egyetem, Jilin 132013, Kína
Guangren Sun
2 Élelmiszertudományi Tanszék, Erdészeti Főiskola, Beihua Egyetem, Jilin 132013, Kína
Jiaqi Gao
1 Farmakológiai Tanszék, Gyógyszerészeti Főiskola, Beihua Egyetem, Jilin 132013, Kína
Zepeng Yu
1 Farmakológiai Tanszék, Gyógyszerészeti Főiskola, Beihua Egyetem, Jilin 132013, Kína
Chunyan Yu
3 Klinika, Orvostudományi Főiskola, Beihua Egyetem, Jilin 132013, Kína
Csunmei Wang
1 Farmakológiai Tanszék, Gyógyszerészeti Főiskola, Beihua Egyetem, Jilin 132013, Kína
Jinghui Sun
1 Farmakológiai Tanszék, Gyógyszerészeti Főiskola, Beihua Egyetem, Jilin 132013, Kína
Ő Li
1 Farmakológiai Tanszék, Gyógyszerészeti Főiskola, Beihua Egyetem, Jilin 132013, Kína
Jianguang Chen
1 Farmakológiai Tanszék, Gyógyszerészeti Főiskola, Beihua Egyetem, Jilin 132013, Kína
Társított adatok
A tanulmány eredményeinek alátámasztására használt adatokat a cikk tartalmazza.
Absztrakt
1. Bemutatkozás
2. Anyagok és módszerek
2.1. Kísérleti állatok
Negyven hím SPF Wistar patkányt (210 g – 250 g) a Changchun Yisi Laboratory Animal Technology Co., Ltd.-től (Changchun, Kína; Tanúsítvány száma: SCXK (Ji) 2016-0003) vásároltunk. A patkányokat 6 hétig etették különálló ketrecekben, jó szellőzéssel, állandó hőmérsékleten (21–23 ° C), állandó páratartalom mellett (45–65%), valamint világos és sötét ciklusokkal, 12 órán át. Az állatkísérleteket a Beihua Egyetem Intézményi Állatgondozási és Felhasználási Bizottsága (IACUC) hagyta jóvá a CPBHU IACUC2019-006 engedélyszámmal, és az összes kísérleti eljárást a Beihua Egyetem laboratóriumi állatainak etikai és használati irányelveinek megfelelően hajtották végre.
2.2. Hangszerek
Teljes hullámhosszúságú ELISA (EPOCH, BIOTEX, USA); elektronikus mérleg (LD310-2, Senyang, Kína); nagy teljesítményű folyadékkromatográfia (LC-2010A, SHIMADZU, Japán); kemilumineszcens gél képalkotó rendszer (Surwit Technology Inc., Peking, Kína); automatikus biokémiai analizátor (Tecan Group, Svájc); laboratóriumi pH-mérő (Metler-Toledo Instrument Co., Ltd., Kína); kis sebességű centrifuga (Xinsheng Biotechnology Co., Ltd., Ningbo, Kína); optikai mikroszkóp (OLYMPUS, Japán); Ultraibolya-látható spektrofotométer (Beijing Purkinje General Instrument Co., Ltd., Peking, Kína).
2.3. Vegyszerek és reagensek
A Schisandra chinensis-t a Jilin tartomány Jian Schisandra Seedlings Base-jéből szereztük be. SV (Jilin tartomány Schisandra Fejlesztési és Ipari Mérnöki Kutatóközpontja, Jilin, Kína); TG, TC, FFA, HDL-C, LDL-C, AST, ALT, MDA és SOD detektáló készletek (Nanjing Jiancheng Bioengineering Institute, Nanjing, Kína); nyúl anti-patkány PPAR-a, ACOX1, CPT1, KEAP1, NRF2 és HO-1 antitestek (Abetclonal Company, San Francisco, USA); koleszterin, nátrium-kolát, kalcium-hidrogén-foszfát és kazein (Anhui Tianqi Chemical Technology Co., Ltd., Anhui, Kína); tojássárgája por (Nanjing Xiaolongshan Laboratóriumi Állattenyésztési Központ, Nanjing, Kína); 20% szacharózt, 15% szalonnát, 10% kazeint, 2% koleszterint, 0,6% kalcium-hidrogén-foszfátot és 0,2% nátrium-kolátot tartalmazó HFD; és normál étrend (Changchun Yisi Laboratory Animal Co., Ltd., Changchun, Kína).
2.4. SV elkészítése
A schisandra száraz, érett gyümölcsét vízzel leöblítették és lecsepegtették. Ezután a tiszta és szárított schisandra gyümölcsöt 1 órán át párolóban főztük. A főtt gyümölcs minden kilogrammjához 1 ml pektinázt adunk, és desztillált vízzel 1: 10 arányban 45 ° C-on 1,5 órán át keverjük, így schisandra lekvár áll rendelkezésre. Először a lekvárt schisandra gyümölcsborokká alakították 7% élesztőt aktiváló folyadék hozzáadásával 28 ° C-on 3 napig. Ezután a schisandra gyümölcsbort 8% (V/V) alkoholtartalomra állítottuk be és 6% ecetsavbaktérium-oldattal oltottuk be, 0,15 l · min –1 fermentációs szellőztetéssel 30 ° C-on 15 napig. Végül a gyümölcsbort ecetsav-erjesztéssel SV-vé alakították. Ezt a gyümölcsecetet szűrjük és sterilizáljuk a kísérleti célokra.
2.5. Az SV savasságának és összetevőinek elemzése
Az SV savasságát pH-mérővel mértük. Az ecetsav tartalmát sav-bázis semlegesítéssel és titrálással határoztuk meg a Kínai Népköztársaság gyógyszerkönyvében leírtak szerint. A poliszacharid tartalmát fenol-kénsav módszerrel mértük. A skizandrin A tartalmát nagy teljesítményű folyadékkromatográfiával (HPLC) határozták meg a Kína Népköztársaság Gyógyszerkönyvében a „Skizandrin A meghatározása schisandra egészségügyi élelmiszerekben” című cikk szerint [8].
2.6. Kísérleti protokoll
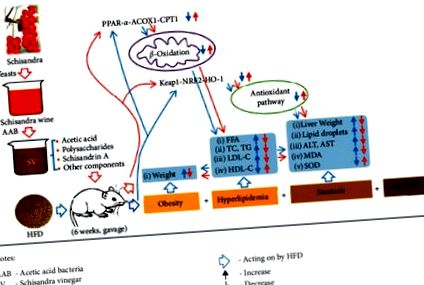
Amint az az 1. ábrán látható, negyven hím SPF Wistar patkányt véletlenszerűen és egyenletesen öt csoportra osztottak, azaz vak kontroll csoportra (CON, normál étrend, desztillált vízbetét), modellcsoportra (MOD, HFD, desztillált vizes szondák), alacsony dózisú SV csoport (SVL, HFD, 25% SV szondázás), közepes dózisú SV csoport (SVM, HFD, 50% SV szondázás) és nagy dózisú SV csoport (SVH, HFD, 100% SV szondázás), amint az Asztal 1 . Valamennyi patkánynak hat héten keresztül megfelelő beadást végeztek, és hetente egyszer lemértek. Ezután a patkányokat 12 órán át éheztettük, de vizet adtunk hozzájuk. Végül az összes patkányt éterrel altattuk, és a hasi aorta vér- és májmintáit összegyűjtöttük a máj súlyának, a májszövet szövettani változásainak, a szérum biokémiai mutatóinak és az antioxidációval kapcsolatos relatív fehérjék kimutatásának vagy elemzésének, beleértve a PPAR-α, ACOX1, CPT1, KEAP1, NRF2 és HO-1.
Kísérleti protokoll. A Schisandra-ecetet (SV) zsírszegény étrendben tartó hím SPF Wistar patkányoknak 6 héten át szondával adták. Ezután mértük a máj súlyát, a májszövet szövettani változásait, a szérum biokémiai mutatóit és az antioxidációs relatív fehérjéket, beleértve a PPAR-α, ACOX1, CPT1, KEAP1, NRF2 és HO-1 fehérjéket.
- A rövid távú alacsony kalóriatartalmú étrend átalakítja a vázizom lipidprofilját és a metabolikus génexpressziót
- A túlsúly és a cukorbetegség megelőzése alacsony szénhidráttartalmú - magas zsírtartalmú étrend
- A PRIME PubMed Kefir ital jelentős, ugyanakkor hasonló javulást okoz a szérum lipidprofiljában,
- Az ízletes, magas zsírtartalmú étrend alacsony zsírtartalmú étellel való felváltása elvonásszerű tüneteket okoz az egerekben -
- Profil: Sanford Diet Review