A vegyes flavonoid- és koffein-kiegészítő heveny fogyasztása növeli az energiafogyasztást és a zsír-oxidációt felnőtt nőknél: Véletlenszerű, keresztezett klinikai vizsgálat
David C. Nieman
1 Humán Teljesítmény Laboratórium, Észak-Karolina Kutatási Campus, Appalachi Állami Egyetem, Kannapolis, NC 28081, USA; ude.etatsppa@janosnomis
Andy Simonson
1 Humán Teljesítmény Laboratórium, Észak-Karolina Kutatási Campus, Appalachi Állami Egyetem, Kannapolis, NC 28081, USA; ude.etatsppa@janosnomis
Camila A. Sakaguchi
2 Fizikoterápiás tanszék, São Carlos-i Szövetségi Egyetem, São Carlos 13565-905, Brazília; moc.liamg@097ihcugakasalimac
Wei Sha
3 Bioinformatikai Szolgáltatások Osztály, North Carolina Research Campus, University of North Carolina, Charlotte, Kannapolis, NC 28081, USA; ude.ccnu@ahsw
Tondra Blevins
4 UNC Nutrition Research Institute, UNC-Chapel Hill, North Carolina Research Campus, 500 Laureate Way, Kannapolis, NC 28081, USA; ude.cnu@snivelb_ardnot (T.B.); ude.cnu@hguabattah_aniaj (J.H.); ude.cnu@reiemlhokm (M.K.)
Jaina Hattabaugh
4 UNC Nutrition Research Institute, UNC-Chapel Hill, North Carolina Research Campus, 500 Laureate Way, Kannapolis, NC 28081, USA; ude.cnu@snivelb_ardnot (T.B.); ude.cnu@hguabattah_aniaj (J.H.); ude.cnu@reiemlhokm (M.K.)
Martin Kohlmeier
4 UNC Nutrition Research Institute, UNC-Chapel Hill, North Carolina Research Campus, 500 Laureate Way, Kannapolis, NC 28081, USA; ude.cnu@snivelb_ardnot (T.B.); ude.cnu@hguabattah_aniaj (J.H.); ude.cnu@reiemlhokm (M.K.)
Absztrakt
1. Bemutatkozás
A zöld tea katechin-koffein italok hosszú távú bevitelét a testsúlycsökkenésre és a testsúly fenntartására gyakorolt kismértékű pozitív hatáshoz kötik [1,2]. A katechin-koffein keverékek heveny fogyasztása átmenetileg növelheti az energiafelhasználást és a zsír oxidációját számos enzim, köztük a katekol-O-metil-transzferáz (COMT), a foszfodiészteráz és a hormon-érzékeny lipáz gátlásával vagy stimulálásával, valamint a barna zsírszövet metabolikus aktivitásának aktiválásával [1,2, 3,4,5,6].
Öt humán vizsgálat (n = 66 férfi, n = 16 nő), metabolikus kamrákban, 150–600 mg koffein-dózist használtak különböző mennyiségű zöld tea katechinnel és epigallokatechin-3-galláttal (EGCG) (240–1200 mg) [7, 8,9,10,11]. A katechin-koffein keverékekkel történő 24 órás energiafelhasználás (24 óra EE) növekedése 2% és 8% között változott, és többé vagy teljes mértékben összefüggésben állt a kiegészítés koffein részével. Rudelle és mtsai. [10] azt javasolta, hogy az akut koffeinfogyasztással (katechinekkel vagy anélkül) történő 24 órás EE növekedése ezzel az egyenlettel becsülhető meg: ((mg koffein × 0,12) + 43,2 kilokalória).
A koffeinbevitelre adott plazma koffein-válasz segíthet megmagyarázni az energiafogyasztás változásának nagy egyénközi eltérését, de ezt még nem mérték. A koffeinbevitel, a plazma koffeinszint és a 24 órás EE-válaszok közötti variancia kapcsolatát szintén befolyásolhatja az rs762551 egyetlen nukleotid polimorfizmusa (SNP), amely a CYP1A2 gén citokróm P450 1A2 (CYP1A2) * 1F allélját kódolja. enzim, amely elsősorban a koffein metabolizmusáért felelős [12]. A CYP1A2 gén 163-as pozíciójában lévő A-C szubsztitúció (rs762551) csökkenti az enzim indukálhatóságát. A C allél hordozói, amelyek a populáció 54% -ában találhatók (163A/C és 163C/C genotípusok, CYP1A2 * 1F), lassabban metabolizálják a koffeint, mint a 163A/A allélre (CYP1A2 * 1A) homozigóta egyedek.
A katechin-koffein keverékek elfogyasztása jobban megnövelheti a zsír oxidációját, mint a koffein önmagában, de ezt a megállapítást a rendelkezésre álló néhány tanulmány nem támasztotta alá következetesen. Az öt vizsgálatból kettő azt mutatta, hogy a placebóhoz viszonyítva a katechin-koffein keverékek stimulálták a zsír oxidációját a kizárólag a koffeinhez kötődött szintek fölött [7,8], három vizsgálat semleges hatást mutatott [9,10,11]. Ezekben a vizsgálatokban gyakori megállapítás volt az egyének közötti magas eltérés, Rudelle et al. [10] arról számoltak be, hogy a 31 résztvevőből hat nem reagált 24 órás EE növekedésével a kiegészítő dózisra (300 mg koffein, 540 mg katechin és 282 mg EGCG).
Más típusú flavonoidok, köztük a flavonolok és antocianinok akut lenyelése befolyásolhatja az energiafogyasztást és a zsír oxidációját, de kevés metabolikus kamra alapú tanulmány jelent meg emberi résztvevőkkel [13,14,15,16]. Három prospektív kohorszvizsgálat adatai, amelyekben 124 086 férfi és nő vett részt, azt mutatta, hogy a flavonolokban (pl. Almából és hagymából származó kvercetin), antocianinokban (pl. Áfonyából), flavan-3-olokban (pl. tea), és a flavonoid polimerek (pl. a tea, proaktocianidinek és teaflavinok, alma) fordítottan összefüggenek a súlyváltozással négyéves időközönként [17]. Egy tanulmány kimutatta, hogy a kvercetin átmenetileg megnövelte az egerek energiafogyasztását [18], de ez nem ismétlődött meg egy kisméretű kísérleti tanulmányban, amelynek során a résztvevők 150 mg kvercetint fogyasztottak [16]. Az áfonya kivonat akut bevitele csökkentette a glükóz étkezés utáni növekedését azáltal, hogy csökkentette a szénhidrát felszívódás mértékét, és ezért befolyásolhatta a zsír oxidációját [19]. A szeder flavonolokat, antocianinokat és flavan-3-olokat tartalmaz, és a 7 napos magas bevitel (600 g/nap) a túlsúlyos/elhízott hímeknél fokozott zsíroxidációval függött össze, a magas zsírtartalmú étrendet fogyasztva a zselatinhoz viszonyítva [15].
A zöld tea kivonatot, kvercetint, valamint fekete áfonya antocianinokat és proantocianidineket tartalmazó kevert flavonoid-koffein (MFC) kiegészítés heveny fogyasztása növelheti az energiafogyasztást és a zsíroxidációt az önmagában koffeinre előre jelzett szint fölé. Az ebben a vizsgálatban használt MFC-kiegészítés (678 mg flavonoid négy kapszulában) kvercetint (200 mg), zöld tea katechineket (368 mg, 180 mg EGCG) és fekete áfonyakivonatból származó antocianinokat és 214 mg koffeint tartalmazott. Rudelle és munkatársai által javasolt egyenlet alapján. [10], a koffein dózisa önmagában a 24 órás EE-t 69 kcal/nap-kal növeli. A metabolikus kamra alapú vizsgálatokban a férfi résztvevők száma alacsony volt (n = 10-15 vizsgálatonként), és csak egy vizsgálatban szerepeltek nőstények (n = 16) [10]. A vizsgálat megtervezése és az adagolási rend jelentősen változott, az öt vizsgálat közül kettő 3 napos kiegészítési periódust tartalmazott, és csak a harmadik napon végzett mérésekkel [8,10].
Ennek a tanulmánynak az volt a célja, hogy megmérje az MFC-kiegészítés (négy kapszula, reggelire és ebédre osztva) bevitelének hatását a placebóval összehasonlítva az energiafelhasználásra és a zsír oxidációjára egy metabolikus kamrában egészséges, menopauza előtti nőknél. A zavaró tényezők potenciális hatásának csökkentése érdekében a résztvevők mindkét kamarai látogatás során (véletlenszerű sorrend) pontosan ugyanazt az ütemtervet követték, és eukalorikus állapotban tartották őket. A plazma koffeinszintet három órával a második kiegészítõ dózis után mértük, és a CYP1A2 gén CYP1A2 * 1F alléljét kódoló, az 1 nukleotid polimorfizmus (SNP) rs762551 genotipizálását végeztük annak megállapítására, hogy ezek az eredmények segítettek-e magyarázni az energiafogyasztásra adott válaszok eltérését a placebo és az MFC vizsgálatok. Feltételeztük, hogy az MFC-kiegészítés bevitele növeli az energiafelhasználást és a zsír oxidációját a placebóval mért szint fölé, és részben a plazma koffeinszintjéhez és az rs762551 genotípushoz kapcsolódik.
2. Anyagok és módszerek
2.1. A tanulmány résztvevői
2.2. Kutatási terv
Ez a tanulmány egy randomizált, kettős-vak, keresztezett tervezést használt, összehasonlítva a flavonoid-koffein vegyes kiegészítés (MFC) akut bevitelét a placebó kontrolltal egészséges, premenopauzás nőknél. A vizsgálat két 23 órás vizsgálati periódusból állt az észak-karolinai egyetem Chapel Hill Táplálkozástudományi Kutatóintézetének (UNC NRI) indirekt szobakaloriméterében. Az anyagcsere-kamrában a 23 órás vizsgálati periódusok 4 hét különbséggel teltek egymástól annak biztosítása érdekében, hogy a vizsgálat résztvevőit a menstruációs ciklus ugyanazon szakaszában teszteljék. Az elsődleges eredmény mértéke a 22 órás energiafelhasználás (22 óra EE) (8:30 és 6:30 között), a szubsztrát kihasználtsága a légzési hányadból (RQ) és a fizikai aktivitás számlálása volt. A 22 órás időtartamot úgy választottuk meg, hogy csökkentse az átmeneti időszegmensekhez kapcsolódó energiaköltségek zavarait a kamraülés elején és végén.
2.2.1. Kiegészítés
2.2.2. A vizsgálat előtti alapvizsgálat
A jogosultságot az UNC NRI ambuláns klinikai csomagjában határozták meg. A testösszetételt (zsírtömeg és zsírmentes tömeg (FFM)) kettős energiájú röntgenabszorpciós módszerrel (DXA) határoztuk meg (GE Lunar iDXA; Milwaukee, WI). A testtömeg-indexet (BMI, kg/m 2) a mért magasságból és súlyból számoltuk. A nyugalmi anyagcserét (RMR) a Mifflin-St. Jeor-egyenlet [22]. Ezt a becsült RMR-t használták az étrendi energiafogyasztás kivetítésére az anyagcsere-kamrában: RMR x fizikai aktivitás szintje (PAL) 1,3, további módosításokkal a kamra látogatásai során (a részleteket alább közöljük). A pajzsmirigyhormon állapotának felmérése céljából kis vérmintát vettünk (Lab Corp, Burlington, NC, USA), és a vörösvérsejteket alikvotizáltuk és lefagyasztottuk az rs762551 genotipizálásához. Vizelet terhességi tesztet is végeztek.
2.2.3. Közvetett kalorimetria
Az UNC NRI anyagcserekamrája, Kannapolis, NC, egy nyitott áramkörű, teljes helyiségű közvetett kaloriméter. A CO2 és az O2 analizátorok differenciálisak, a teljes skálaértékeket 0–1% -ra állítják be. Az oxigénfogyasztást (VO2), a szén-dioxid-termelést (VCO2), az energiakiadást EE) és az RQ-t percenként rögzítettük. Az energiafelhasználást egy rövidített Weir-képlet (VO2 × 3.941) + (VCO2 × 1.106) segítségével számoltuk, ahol a VO2 az elfogyasztott oxigén térfogata L/percben, a VCO2 pedig a kibocsátott szén-dioxid térfogata L/percben. Az RQ értéke VCO2/VO2. A szubsztrát oxidációs sebességét a következőképpen számítottuk: Zsír oxidációs sebessége (g/perc) = (1,689 × VO2) - (1,689 × VCO2); szénhidrát oxidációs sebesség (g/perc) = (4,113 × VCO2) - (2,907 × VO2). A spontán fizikai aktivitást percenként mértük egy teljes szobai mikrohullámú érzékelővel, amely rögzíti a mozgás észlelésének másodpercenkénti számát (Museum Technology Source Inc., Wilmington, MA, USA).
2.2.4. Metabolikus kamra protokoll
A vizsgálat résztvevői egynapos éhgyomorra érkeztek az UNC NRI-hez 7: 00-kor, 24 órán keresztül kerülve a testmozgást, és legalább nyolc órán át a koffeint és az alkoholt. A résztvevőket a kamrában lezárták, a metabolikus mérések rögzítése 8: 00-kor kezdődött. A résztvevők egész nap ülve maradtak és ébren voltak, óránkénti 2 perces intervallumokkal állva, nyújtva és mosdóként. Az MFC vagy placebo kiegészítőket 8: 30-kor fogyasztották. És 13:00 (2 kapszula minden alkalommal). A reggelit (9:00), az ebédet (13:30), az uzsonnát (16:00) és a vacsorát (19:00) légzáró folyosón szolgálták fel, és a tálalástól számított 30 percen belül elfogyasztották. Vérmintát nyertünk 16:00 órakor a plazma koffein koncentrációjának mérésére. A villanyt 22: 00-kor kikapcsolták, a lefekvés pedig 22: 30-kor volt beállítva. A vizsgálat résztvevőit fél 6-kor ébresztették fel, és megengedték nekik, hogy mozogjanak a kamrában, hogy összeszedjék holmijukat. 7: 15-kor a vizsgálat résztvevői kiléptek a kamrából, és megmérték őket. A 22 órás EE-t 8: 30-tól 6: 30-ig gyűjtött adatok alapján számoltuk, eltávolítva az első és az utolsó 30 perc átmeneti szegmenseket.
2.2.5. Metabolikus kamra diéta
Az eukalórikus étrendeket úgy tervezték, hogy hozzávetőlegesen 35% zsír-, 50% szénhidrát- és 20% fehérjetartalmat biztosítsanak, tükrözve az e populációcsoportra vonatkozó jelenlegi ajánlásokat. Alacsony flavonoid menüt tápanyagszámítási és élelmiszer-kezelő szoftver (Nutribase: CyberSoft, Incorporated; Phoenix, AZ, USA) felhasználásával terveztek, és zabpehelyből, fehér kenyérből, mogyoróvajból, tejből (1% zsír), sovány őrölt pulykából állt., barna rizs, túró (1% zsír), granola, száraz pörkölt mogyoró, csont nélküli csirkemell, száraz makaróni és olívaolaj. Nem szolgáltak italokat vagy koffeint tartalmazó ételeket. Mindkét kamarai látogatáskor ugyanazokat az ételeket szolgálták fel. Minden tantárgyhoz elkészítettünk egy alapmenüt a becsült energiafelhasználás (RMR × 1,3) alapján, majd módosítottuk (snack és vacsora) a 7 órás mért energiafelhasználási adatoknak megfelelően.
2.3. Plazma koffein
A minta előkészítését 50 μl plazma fehérje-kicsapásával végeztük 200 μl metanollal, amely 40 ng/ml belső standard koffein-d9-et tartalmaz. A plazma koffein-koncentrációt Waters Acquity Ultra-Performance Liquid Chromatography (UPLC) -Quattro Premier XE tömegspektrometriával (Waters Corp., Milford, MA, USA) elemeztük. A koffein és a belső standard koffein-d9 kromatográfiás elválasztását egy UPLC Ethylene Bridged Hybrid (BEH) C18 1,7 μm analitikai oszlopon (2,1 × 100 mm, Waters Corp., Milford, MA, USA) végezzük, gradiens elúcióval mobil fázissal Víz és mozgó B fázisú acetonitril, mindkettő 0,1% hangyasavat tartalmaz. A detektálást tömegspektrométerrel végeztük pozitív ion üzemmódban, elektrospray ionizációval. Az elemzést többszörös reakciómonitorozás (MRM) módban végeztük. A műszer-vezérlést és az adatgyűjtést Masslynx szoftvercsomag segítségével hajtottuk végre (Waters Corp., Milford, MA, USA).
2.4. rs762551 Genotipizálás TaqMan Assay-vel
A DNS-mintákat 500 µl emberi vérből extraháltuk konzerváló pufferben a QIAamp DNS vér mini kit alkalmazásával. A TaqMan SNP Genotiping Assay (ThermoFisher, Waltham, MA, USA) segítségével 20 ng DNS mennyiséget használtunk be egy genotipizálási reakcióhoz. Előre tervezett primereket használtunk a három lehetséges rs762551 genotípus azonosításához (C_8881221_40 assay). A qPCR reakció után a CFX Maestro Software, a Bio-Rad (Hercules, CA, USA) alléldiszkriminációs csomagját alkalmaztuk az egyes minták genotípusainak hozzárendeléséhez, a Coriell Intézet biobankjának SNP hívására szolgáló három pozitív kontroll segítségével (Camden, NJ, USA). DNS kivonási és genotipizálási vizsgálatokat a David H. Murdock Kutatóintézet Genomikai Laboratóriumában (Kannapolis, NC, USA) végeztünk.
2.5. Statisztikai elemzések
3. Eredmények
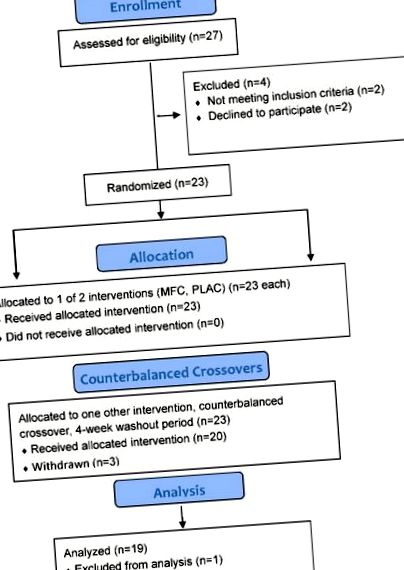
A vizsgálati résztvevő folyamatábráját az 1. ábra mutatja. A vizsgálatba bevont 23 női résztvevő közül 20 sikeresen teljesítette a vizsgálat minden szakaszát, egy pedig kiesett az elemzésből a kamra technikai meghibásodása (a hőmérséklet-szabályozás elvesztése) miatt. A vizsgálatot befejező vizsgálat résztvevőinek (n = 19) a következő jellemzői voltak: életkor 30,7 ± 4,7 év, testtömeg 69,0 ± 9,0 kg, testtömeg-index (BMI) 25,7 ± 3,4 kg/m 2 és testzsír 37,7 ± 6,6%.
Tanulmányozza a résztvevő folyamatábráját. MFC = vegyes flavonoid-koffein vizsgálat; PLAC = placebo-vizsgálat.
Az MFC és a placebo vizsgálatok energiaköltségeit (kcal/h) a 2. ábra hasonlítja össze (kezelési hatás, p = 0,001). Az MFC és a placebo vizsgálatok 22 órás teljes energiafelhasználása átlagosan 1582 ± 143, illetve 1535 ± 154 kcal volt (átlagos vizsgálati különbség, 46,4 ± 57,8 kcal) (p = 0,003). Az 1. táblázat összefoglalja az egyes meghatározott idõszakok metabolikus adatait. Az aktivitásszám és a légzési hányados (RQ) nem különbözött szignifikánsan a vizsgálatok között vagy az egyes szegmensek során (1. táblázat). Az MFC-vizsgálat energiafogyasztása és oxigénfogyasztása szignifikánsan magasabb volt, mint a placebo (p 3. ábra mutatja az energiaköltség-próba különbségét a vizsgálat minden résztvevőjénél. 19 résztvevő közül öt válaszolt az MFC-kiegészítésre alacsonyabb energiafelhasználással a placebóhoz képest (azaz nem A válaszadók esetében a vizsgálati különbség 70,9 ± 42,1 kcal volt. Az életkor, a BMI és a test zsírossága nem volt szignifikáns különbség a válaszadók és a nem válaszolók között. Színkódolt sávokat használtunk az SNP rs762551 genotípusának ábrázolására (3. ábra Az 1. allél, az A/A és a C/A vagy C/C esetén az energiafogyasztás vizsgálati különbsége nem volt különbség (51,4 ± 42,8 és 31,3 ± 82,1 kcal/22 óra, p = 0,50 ).
Energiafelhasználás (kcal/22 óra) próbakülönbség (MFC mínusz placebo) minden vizsgálat résztvevőjére Az adatokat növekvő sorrendben ábrázolják, tetszőleges azonosító számokkal a vizsgálat résztvevői számára. A piros sávok azt mutatják, hogy a vizsgálat résztvevői az rs762551 egy nukleotid polimorfizmus (SNP) homozigóta A/A genotípusával rendelkeznek. A kék sávok a C/A és a C/C genotípusú résztvevőket jelölik (csak egy résztvevő, # 4). A fekete sávok két résztvevőt jelölnek azon genotípusok esetében, amelyeket nem lehetett meghatározni. Az A/A genotípusúak, valamint a C/A vagy C/C genotípusúak energiafogyasztásának vizsgálati különbsége statisztikailag nem volt szignifikáns (51,4 ± 42,8 és 31,3 ± 82,1 kcal/22 óra, p = 0,50).
A 4. ábra a zsír oxidációs sebességét óránként hasonlítja össze az MFC és a placebo vizsgálatok között (kezelési hatás, p = 0,062). Az MFC zsíroxidációja magasabb volt, mint a placebó a meghatározott időszegmensekben (p = 0,054), a szénhidrát oxidáció szempontjából nem volt kísérleti különbség (1. táblázat). A zsír oxidációja a teljes 22 órás időszakban az MFC és a placebo vizsgálatokban 99,2 ± 14,0, illetve 92,4 ± 14,4 g/22 óra volt (p = 0,081).
Zsír oxidáció (gramm/óra) az MFC és a placebo vizsgálatokban (n = 19) (átlag ± SD) (kezelési hatás, p = 0,062). A kiegészítőket 8: 30-kor (1. óra) és 13: 00-kor (5. óra) fogyasztották. A reggelit, az ebédet és a vacsorát 9: 00-kor (1. óra), 13: 30-kor (5. óra) és 18: 30-kor (10. óra) szolgálják fel. A fényeket alváskor 22: 30-kor (14. óra) kikapcsolták.
- Az albuterol-koffein ígéretes és biztonságos lehet () Elhízás elleni verem 13% -kal hevesen növeli az energiát
- A captagon tabletták elfogyasztásával járó akut alacsonyabb szintű szívizominfarktus Esettanulmány
- Túlsúlyos és elhízott serdülők nyugalmi energiafogyasztásának értékelése klinikai körülmények között
- Kalóriák teljes makroelem-bevitel, energiafelhasználás és nettó energiaüzletek - étrend és egészség -
- 3 WAY CAFFEINE NÖVELI METABOLIZMUSÁT a VITER ENERGY Medium segítségével