A Viburnum opulus L. gyümölcsfenolok citoprotektív potenciáljának értékelése az inzulinoma MIN6 sejteken, amelyek relevánsak a cukorbetegség és az elhízás szempontjából
Az V. opulus kivonatok hatása a MIN6 sejtek metabolikus aktivitására, PrestoBlue teszttel meghatározva 24 órás lé (FJ) (A) és PRF (B) expozíció után. A kontroll sejteket csak a vivőanyagnak tettük ki; az értékek átlag ± ± eltérés legalább három független kísérletnél, n ≥ 12; a statisztikai szignifikanciát kiszámítottuk a kontroll sejtekkel (kezeletlen), ** p ≤ 0,01, *** p ≤ 0,001.
Az V. opulus PRF kivonat hatása a 24 órán keresztül kezelt MIN6 sejtek morfológiájára; a kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; véletlenszerűen kiválasztott mezőket × 200 képponton fényképeztük.
Az V. opulus kivonatok hatása a MIN6 sejt ATP szintjére, ATP lumineszcens vizsgálattal meghatározva 24 órás FJ és PRF (A) expozíció után; a mitokondriális membránpotenciált JC-1 szondával (B) határoztuk meg, ahol pozitív depolarizációs kontroll karbonil-cianid m-klór-fenil-hidrazint (CCCP) alkalmaztunk (50 µM); a kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlag ± ± eltérés legalább három független kísérletnél, n ≥ 9; a statisztikai szignifikanciát kiszámítottuk a kontroll sejtekkel (kezeletlen), ** p ≤ 0,01, *** p ≤ 0,001; JC-1-vel festett MIN6 sejtek fluoreszcens képei, ahol véletlenszerűen kiválasztott mezőket × 200 nagyítással fényképeztek FITC és Texas Red szűrőkkel (C).
Az FJ és a PRF 24 órás expozíciójának hatása a foszfatidil-szerin externáliájára az apoptotikus MIN6 sejtek külső membrán szórólapján és membrán permeabilizációján, amelyet Annexin-V-FITC vizsgálati készlettel és propidium-jodid festéssel detektáltunk (A); kivonat befolyásolja a kaszpáz-9 aktivációt (B) és a kaszpáz-3/7 aktivációt (C); Fluoreszcens mikroszkóppal (Olympus CKX41, Japán), 400-szoros nagyítással (D) megfigyelt DAPI-vel festett magok és kromatin kondenzáció. A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; értékek átlag ± ± három eltérés standard eltérései, n ≥ 9; a statisztikai szignifikanciát kiszámítottuk a kontroll sejtekkel (kezeletlen), * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001.
Az V. opulus kivonatok hatása az intracelluláris ROS-termelésre, DCFH-DA vizsgálattal elemezve, MIN6 sejtek 24 órás FJ és PRF (A), GPx aktivitás (B) és hidroperoxid termelési szint (C) inkubálása után. A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; értékek átlag ± ± három eltérés standard eltérései, n ≥ 9; a statisztikai szignifikanciát kiszámítottuk a kontroll sejtekkel (kezeletlen), * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001.
Az V. opulus kivonatok citoprotektív tulajdonságai IC0 dózisoknál (24 órás előinkubálás) kémiai indukció (500 µM t-BOOH, 2 óra) és oxidatív stressz ellen DCFH-DA-val elemezve MIN6 sejteken (A); fluoreszcens mikroszkóppal vizualizált sejtek: alacsony fluoreszcencia a kontroll sejtekben, nagyon magas fluoreszcencia a sejtekben 500 µM t-BOOH inkubálás után, és csökkent a sejtekben, amelyeket 24 órán át PRF-el kezeltek t-BOOH hozzáadás előtt (200x nagyítás) (B ); A MIN6 metabolikus aktivitása PrestoBlue assay-vel (C) elemezve. A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlag ± ± eltérés legalább három független kísérletnél, n ≥ 12; a statisztikai szignifikanciát kiszámítottuk a t-BOOH-val kezelt sejtekhez képest, ** p ≤ 0,01, *** p ≤ 0,001.
Az V. opulus kivonatok hatása a lipidcseppek felhalmozódására Nílus vörösnel festett MIN6 sejtekben, megfigyeltük, miután a sejteket 24 órán keresztül IC0-on kezeltük a kivonatokkal (A); pozitív kontrollként 100 μM olajsavat használtunk; a kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlag ± ± eltérés legalább három független kísérletnél, n ≥ 12; statisztikai szignifikanciát számítottunk a kontroll sejtekhez képest ** p ≤ 0,01. Fluoreszcens mikroszkóp alatt látható sejtek (200-szoros nagyítás) (B).
Az V. opulus kivonatok hatása a zsírsavanalóg TF2-C12 felvételére, amelyet MIN6 sejtekben mértek FFA felvételi vizsgálattal, miután a sejteket extraktumokkal kezelték IC0-on 24 órán át (A); a kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlagok ± szórások, n ≥ 5; statisztikai szignifikanciát számítottunk a kontroll sejtekhez képest. TF2-C12-vel töltött sejtek, fluoreszcens mikroszkóp alatt láthatóak (200x nagyítás) (B).
Az V. opulus kivonatok hatása a MIN6 sejtek inzulinszekréciójára (A), a GLP-1 szekréciójára a GLUTag sejtekben (B) alacsony (nyitott oszlopokban) vagy magas (zárt oszlopokban) glükóz körülmények között. A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; értékek átlag ± ± három eltérés standard eltérései, n ≥ 9; A statisztikai szignifikanciát kiszámítottuk az alacsony glükóz *** p ≤ 0,001 vagy a magas glükóz ### p ≤ 0,001 kezelt kontroll sejtekhez képest. A DPP4 enzim gátlásának százalékos aránya FJ és PRF (C) által; az értékek átlag ± SD, n ≥ 4; statisztikai szignifikancia ** p ≤ 0,01, *** p ≤ 0,001.
A Laurdan-jelölt sejtek emissziós spektrumai V. opulus kivonatokkal végzett inkubálás előtt és után IC0 dózisoknál (A). A sejtmembrán fluiditásának változásai a GP értékeként kifejezve a Laurdan-próbához, miután a sejteket extraktumokkal inkubálták alacsony (nyitott oszlopokban) vagy magas (zárt oszlopokban) glükóz körülmények között (B). Az extraktumok hatása az intracelluláris ROS-termelésre, DCFH-DA assay-vel elemezve alacsony (nyitott oszlopok) vagy magas (zárt oszlopok) glükóz körülmények között (C). Az extraktumok által a sejtmembránon kiváltott hiperpolarizáló hatás alacsony (nyitott oszlopokban) vagy magas (zárt oszlopokban) glükóz körülmények között (D). A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlag ± ± eltérés legalább három független kísérletnél, n ≥ 12; a statisztikai szignifikanciát kiszámítottuk az alacsony glükóz * p ≤ 0.05, ** p ≤ 0.01 vagy magas glükóz ## p ≤ 0.01 kezelt kontroll sejtekhez képest.
Pirénnel jelölt sejtek kibocsátása az V. opulus PRF (A) és FJ (B) kivonatokkal történő inkubálás előtt és után IC0 dózisok mellett; a bemutatott adatok a pirénnel jelölt sejtek reprezentatív emissziós spektrumai a PRF és FJ inkubálás előtt és után, n = 3.
A HSA fluoreszcencia-spektruma (1,5 × 10-5 M, gerjesztés 295 nm-nél) és annak változásai a PRF-kivonat növekvő koncentrációja mellett (A). Stern – Volmer-diagram a HSA kioltására PRF segítségével (PRF koncentráció mg/ml-ben) (B). Stern-Volmer-diagram a HSA kioltására PRF segítségével (PRF koncentráció klorogénsav-ekvivalensben kifejezve [M]) (C).
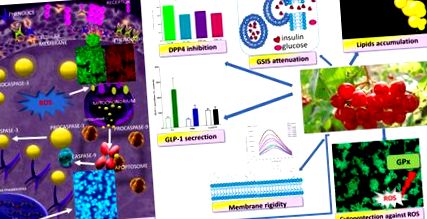
A Viburnum opulus fenolos vegyületek mint a MIN6 sejt biológiai aktivitását befolyásoló citoprotektív szerek - javasolt hatásmechanizmus. Citoprotektív aktivitással rendelkeznek a ROS-generációval szemben, apoptotikus típusú sejtpusztulást váltanak ki, stimulálják a GLP-1 szekréciót és gátolják a DPP4 aktivitást; azonban gyengítik a GSIS-t és fokozzák a lipidfelhalmozódást.
Absztrakt
Az V. opulus kivonatok hatása a MIN6 sejtek metabolikus aktivitására, PrestoBlue teszttel meghatározva 24 órás lé (FJ) (A) és PRF (B) expozíció után. A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlag ± ± eltérés legalább három független kísérletnél, n ≥ 12; A statisztikai szignifikanciát kiszámítottuk a kontroll sejtekkel (kezeletlen), ** p ≤ 0,01, *** p ≤ 0,001.
Az V. opulus PRF kivonat hatása a 24 órán keresztül kezelt MIN6 sejtek morfológiájára; a kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; véletlenszerűen kiválasztott mezőket × 200 képponton fényképeztük.
Az V. opulus kivonatok hatása a MIN6 sejt ATP szintjére, ATP lumineszcens vizsgálattal meghatározva 24 órás FJ és PRF (A) expozíció után; a mitokondriális membránpotenciált JC-1 szondával (B) határoztuk meg, ahol pozitív depolarizációs kontroll karbonil-cianid m-klór-fenil-hidrazint (CCCP) alkalmaztunk (50 µM); a kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; értékek átlag ± ± három eltérés standard eltérései, n ≥ 9; a statisztikai szignifikanciát kiszámítottuk a kontroll sejtekkel (kezeletlen), ** p ≤ 0,01, *** p ≤ 0,001; JC-1-vel festett MIN6 sejtek fluoreszcens képei, ahol véletlenszerűen kiválasztott mezőket × 200 nagyítással fényképeztek FITC és Texas Red szűrőkkel (C).
Az FJ és a PRF 24 órás expozíciójának hatása a foszfatidil-szerin externáliájára az apoptotikus MIN6 sejtek külső membrán szórólapján és membrán permeabilizációján, amelyet Annexin-V-FITC vizsgálati készlettel és propidium-jodid festéssel detektáltunk (A); kivonat befolyásolja a kaszpáz-9 aktivációt (B) és a kaszpáz-3/7 aktivációt (C); Fluoreszcens mikroszkóppal (Olympus CKX41, Japán), 400x-os nagyítással (D) megfigyelt DAPI-vel festett magok és kromatin kondenzáció. A kontroll sejteket csak a vivőanyagnak tettük ki; értékek átlag ± ± három eltérés standard eltérései, n ≥ 9; statisztikai szignifikanciát számítottunk a kontroll sejtekhez (kezeletlen), * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001.
Az V. opulus kivonatok hatása az intracelluláris ROS-termelésre, DCFH-DA vizsgálattal elemezve, MIN6 sejtek 24 órás FJ és PRF (A), GPx aktivitás (B) és hidroperoxid termelési szint (C) inkubálása után. A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; értékek átlag ± ± három eltérés standard eltérései, n ≥ 9; statisztikai szignifikanciát számítottunk a kontroll sejtekhez (kezeletlen), * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001.
Az V. opulus kivonatok citoprotektív tulajdonságai IC0 dózisoknál (24 órás előinkubálás) kémiai indukció (500 µM t-BOOH, 2 óra) és oxidatív stressz ellen DCFH-DA-val elemezve MIN6 sejteken (A); fluoreszcens mikroszkóppal vizualizált sejtek: alacsony fluoreszcencia a kontroll sejtekben, nagyon magas fluoreszcencia a sejtekben 500 µM t-BOOH inkubálás után, és csökkent a sejtekben, amelyeket 24 órán át PRF-el kezeltek t-BOOH hozzáadás előtt (200x nagyítás) (B ); A MIN6 metabolikus aktivitása PrestoBlue assay-vel (C) elemezve. A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlag ± ± eltérés legalább három független kísérletnél, n ≥ 12; a statisztikai szignifikanciát kiszámítottuk a t-BOOH-val kezelt sejtekhez képest, ** p ≤ 0,01, *** p ≤ 0,001.
Az V. opulus kivonatok hatása a lipidcseppek felhalmozódására Nílus vörösnel festett MIN6 sejtekben, megfigyeltük, miután a sejteket 24 órán keresztül IC0-on kezeltük a kivonatokkal (A); pozitív kontrollként 100 μM olajsavat használtunk; a kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlag ± ± eltérés legalább három független kísérletnél, n ≥ 12; statisztikai szignifikanciát számítottunk a kontroll sejtekhez képest ** p ≤ 0,01. Fluoreszcens mikroszkóp alatt látható sejtek (200-szoros nagyítás) (B).
Az V. opulus kivonatok hatása a zsírsavanalóg TF2-C12 felvételére, amelyet MIN6 sejtekben mértek FFA felvételi vizsgálattal, miután a sejteket extraktumokkal kezelték IC0-on 24 órán át (A); a kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlagok ± szórások, n ≥ 5; statisztikai szignifikanciát számítottunk a kontroll sejtekhez képest. TF2-C12-vel töltött sejtek, fluoreszcens mikroszkóp alatt láthatóak (200x nagyítás) (B).
Az V. opulus kivonatok hatása a MIN6 sejtek inzulinszekréciójára (A), a GLP-1 szekréciójára a GLUTag sejtekben (B) alacsony (nyitott oszlopokban) vagy magas (zárt oszlopokban) glükóz körülmények között. A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; értékek átlag ± ± három eltérés standard eltérései, n ≥ 9; A statisztikai szignifikanciát kiszámítottuk az alacsony glükóz *** p ≤ 0,001 vagy a magas glükóz ### p ≤ 0,001 kezelt kontroll sejtekhez képest. A DPP4 enzim gátlásának százalékos aránya FJ és PRF (C) által; az értékek átlag ± SD, n ≥ 4; statisztikai szignifikancia ** p ≤ 0,01, *** p ≤ 0,001.
A Laurdan-jelölt sejtek emissziós spektrumai V. opulus kivonatokkal végzett inkubálás előtt és után IC0 dózisoknál (A). A sejtmembrán fluiditásának változásai a GP értékeként kifejezve a Laurdan-próbához, miután a sejteket extraktumokkal inkubálták alacsony (nyitott oszlopokban) vagy magas (zárt oszlopokban) glükóz körülmények között (B). Az extraktumok hatása az intracelluláris ROS-termelésre, DCFH-DA assay-vel elemezve alacsony (nyitott oszlopok) vagy magas (zárt oszlopok) glükóz körülmények között (C). Az extraktumok által a sejtmembránon kiváltott hiperpolarizáló hatás alacsony (nyitott oszlopokban) vagy magas (zárt oszlopokban) glükóz körülmények között (D). A kontroll sejteket egyetlen vegyületnek sem tettük ki, csak a vivőanyagot; az értékek átlag ± ± eltérés legalább három független kísérletnél, n ≥ 12; a statisztikai szignifikanciát kiszámítottuk az alacsony glükóz * p ≤ 0.05, ** p ≤ 0.01 vagy magas glükóz ## p ≤ 0.01 kezelt kontroll sejtekhez képest.
Pirénnel jelölt sejtek kibocsátása az V. opulus PRF (A) és FJ (B) kivonatokkal történő inkubálás előtt és után IC0 dózisok mellett; a bemutatott adatok a pirénnel jelölt sejtek reprezentatív emissziós spektrumai a PRF és FJ inkubálás előtt és után, n = 3.
A HSA fluoreszcencia-spektruma (1,5 × 10-5 M, gerjesztés 295 nm-nél) és annak változásai a PRF-kivonat növekvő koncentrációja mellett (A). Stern – Volmer-diagram a HSA kioltására PRF segítségével (PRF koncentráció mg/ml-ben) (B). Stern-Volmer-diagram a HSA kioltására PRF segítségével (PRF koncentráció klorogénsav-ekvivalensben kifejezve [M]) (C).
A Viburnum opulus fenolos vegyületek mint a MIN6 sejt biológiai aktivitását befolyásoló citoprotektív szerek - javasolt hatásmechanizmus. Citoprotektív aktivitással rendelkeznek a ROS-generációval szemben, apoptotikus típusú sejtpusztulást váltanak ki, stimulálják a GLP-1 szekréciót és gátolják a DPP4 aktivitást; azonban gyengítik a GSIS-t és fokozzák a lipidfelhalmozódást.
- Antioxidánsok szabad teljes szövegű oxidatív egyensúlyhiány és vesekárosodás a Cafeteria diéta okozta patkányban
- Állatok a szén, a szilícium és a fémalapú nanorészecskék teljes szövegű toxicitását a hemocitákra
- Biomolekulák nélküli teljes szövegű nikotinamid, nikotinamid-ribozid és nikotinsav - feltörekvő szerepek
- Rákok Ingyenes teljes szövegű kolin PETCT többszörös myeloma HTML-ben
- Az állatok a kocák teljes szöveges elhízása késői vemhesség alatt súlyosbítják a perinatális anyagcsere-rendellenességeket