Az étrendi fruktóz által kiváltott béldiszbiózis elősegíti az egér hippocampusos neuroinflammációját: a rövid láncú zsírsavak előnye
Absztrakt
Háttér
A nyugati stílusú étrend ideggyulladást vált ki, és rontja az emberek és állatok érzelmi és kognitív viselkedését. Korábbi tanulmányunk kimutatta, hogy a magas fruktóz tartalmú étrend hippocampalis neuroinflammatorikus választ és neuronvesztést okozott állatokban, de a mögöttes mechanizmusok megfoghatatlanok maradtak. Itt a bél mikrobiotájában és a bél hámgátlójában bekövetkezett változásokat vizsgálták, mint a magas fruktóz tartalmú étrend által kiváltott hippokampus neuroinflammációit.
Eredmények
Következtetések
Eredményeink azt mutatják, hogy a bél dysbiosis kritikus tényező a magas fruktóz-tartalmú étrend által kiváltott hippokampusos neuroinflammációban C57BL/6N egerekben, amelyet valószínűleg a bél hámgátjának károsodása közvetít. Mechanikusan a hibás vastagbél NLRP6 gyulladás felelős a bélhám gátlásáért. Az SCFA-k stimulálhatják az NLRP6 gyulladásos állapotát és enyhíthetik a bél hámgátjának károsodását, ami védelmet eredményez a magas fruktóztartalmú étrend által kiváltott hippokampusos neuroinflammáció és idegsejtvesztés ellen. Ez a tanulmány foglalkozik a nyugati stílusú étrendhez kapcsolódó idegkárosodás megértésének hiányosságával. Kiemelt egy új beavatkozási stratégia a neurodegeneratív betegségek kockázatának csökkentésére az SCFA-k kiegészítése vagy az étkezési rostfogyasztás révén.
Háttér
Az ideggyulladás a nyugati stílusú étrendhez kapcsolódó neurodegeneratív betegségek jellemzője, beleértve a feldolgozott cukrokban (fruktóz vagy szacharóz) és zsírokban gazdag magas kalóriatartalmú étrendeket is [1,2,3,4]. A bélmikrobiota arról számolt be, hogy a csíra nélküli és antibiotikumokkal kezelt, specifikus kórokozóktól mentes (SPF) egerekben a mikroglia érését és működését szabályozó felnőtt hippokampus neurogenezisét és neurológiai működését [5, 6] jelzi, hogy a a bél mikrobiota (bél dysbiosis) lehet a neuroinflammációt és az azt követő idegsejtek sérülését kiváltó fő esemény [5, 7, 8].
A rostokban gazdag étrend enyhíti a bélhám akadályát és gyulladását a dextrán-nátrium-szulfát (DSS) által kiváltott kolitikus egerekben [28], és megvédi az egér tüdejét az allergiás gyulladástól [29]. A bevitt élelmi rostokat a vastagbél baktériumai könnyen fermentálják, hogy szerves savakat, köztük rövid szénláncú zsírsavakat (SCFA) termeljenek. Az SCFA-kkal végzett kezelés gyengíti a magas zsírtartalmú étrend által kiváltott változást a bél mikrobiotájában és a bél hámgátjának integritásában a C57BL/6 egerekben, valószínűleg a szisztémás gyulladás gátlásával [30, 31]. Az SCFA-k képesek lehetnek modulálni az agy mikroglia érését és működését, ami a bél mikrobiotából származó SCFA-k potenciális előnyeire utal az ideggyulladásos folyamatok elleni védelemben [6, 32]. Az SCFA-k neuroprotektív hatásait a neurodegeneratív rendellenességek állatmodelljeiben is bizonyították [32, 33], de további bizonyítékokra van szükség.
Ebben a tanulmányban azt tapasztaltuk, hogy az étrendi fruktóz-vezérelt bél dysbiosis a bél epitheliális gátjának károsodását okozta, ami a hippocampus neuroinflammációjának előfordulásához kapcsolódik C57BL/6N egerekben. A peroxiszóma proliferátor által aktivált gamma receptor (PPAR-γ) a vastagbél lumenében található butirát-érzékelő [34]. A mikrobiota által aktivált PPAR-γ jelzésről beszámoltak arról, hogy megakadályozza a kórokozó baktériumok diszbiotikus terjeszkedését a vastagbél hámsejtjeinek energia-anyagcseréjének ösztönzésével [35]. Kiemeltük azokat a kulcsfontosságú molekuláris mechanizmusokat is, amelyek révén az SCFA-k, valamint a pioglitazon (PPAR-γ agonista) az NLRP6 gyulladás aktiválásával helyreállították a bél hámgát károsodását, esetleg hozzájárulva a hippocampus neuroinflammatorikus válaszának gátlásához és a fruktóz-táplált neuronvesztéshez. egerek.
Eredmények
A bél mikrobiota kimerülése gátolja a hippocampus neuroinflammációját fruktózzal táplált egerekben
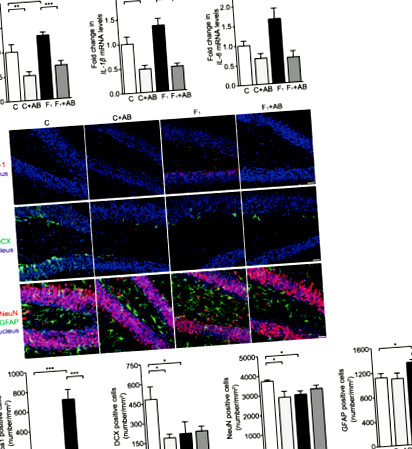
Hippocampusos neuroinflammatorikus választ, amelyet az interleukin-1 béta (IL-1β), a tumor nekrózis faktor alfa (TNF-α) és az IL-6 mRNS szintjének szignifikáns upregulációja jellemez, magas fruktóz tartalmú táplálékkal etetett C57BL/6N egereknél figyeltek meg. nyolc hétig (1a. ábra). Az immunfluoreszcens festés azt mutatta, hogy az Iba-1 + mikroglia száma szignifikánsan megnőtt a magas fruktóz tartalmú táplálékkal táplált egerek teljes hippokampuszában, összehasonlítva a standard étrenddel etetett állatokkal (1b. Ábra és 1. kiegészítő fájl: S1a ábra). A NeuN + idegsejtek és a duplekortin (DCX) + újszülött idegsejtek száma szignifikánsan csökkent, míg a GFAP + asztrociták növekedtek a hippocampus dentate gyrus-ban (DG) (1b. Ábra), de a cornu ammonis 1-ben (CA1) és CA3 területek (1. kiegészítő fájl: S1b ábra) fruktózzal táplált egerekben. Ezek az eredmények megerősítik, hogy a magas fruktóz tartalmú étrend hippocampus neuroinflammatorikus választ és neuronvesztést vált ki C57BL/6N egerekben.
A magas fruktóztartalmú étrend a bél dysbiosisát, az SCFA-k csökkenését és a bélhám akadályát okozza C57BL/6N egerekben
Az étrendi fruktóz egerekben a bél mikrobiotára gyakorolt hatásának értékeléséhez a széklet mikrobiotáját 16S rRNS gén amplikon szekvenálásával elemeztük. A magas fruktóztartalmú étrendi táplálás nyolc héten át megváltoztatta a mikrobiális közösség szerkezetét, de nem volt hatással az egerek mikrobiális alfa-változatosságára (2a. És b. Ábra, 1. kiegészítő fájl: S2a ábra). A rengeteg Bacteroidetes jelentősen csökkent és Proteobaktériumok szignifikánsan megnőtt a fruktózzal táplált egerekben. Ezen túlmenően ezek az állatok növekvő tendenciát mutattak Firmicutes (2c. Ábra). A fruktóz takarmányozás a kórokozó baktérium taxonok jelentős gazdagodásához is vezetett Deferribacteraceae (Mucispirillum) és Helicobacteraceae (Helicobacter) egerekben (1. kiegészítő fájl: S2b ábra). Bár a fő SCFA-t termelő baktériumok, mint pl Lachnospiraceae és Ruminococcaceae, fruktózzal táplált egerekben erősen dúsultak (1. kiegészítő fájl: S2c ábra), az acetát, propionát, butirát és az összes SCFA székletkoncentrációja szignifikánsan alacsonyabb volt a fruktózzal táplált egerekben, mint a kontroll csoportban (2d. ábra). Az antibiotikumok csökkentették az acetát, a propionát, a butirát és az összes SCFA széklet koncentrációját mind a kontroll, mind a fruktózzal táplált állatokban (2d. Ábra).
Az SCFA-k és a pioglitazon részlegesen formálják a bél dysbiosisát és javítják a bélhám akadályát a fruktózzal táplált egerekben
A fruktózzal táplált egerek hibát mutatnak a vastagbél NLRP6 gyulladásában, amelyet az SCFA-k és a pioglitazone enyhítenek
Nevezetesen, a vastagbél-interferon gamma (IFN-γ), a TNF-α és az IL-10 rendellenes termelése további bélimmunális egyensúlyhiányt mutatott a fruktózzal táplált egerekben, amelyeket SCFA-k és pioglitazon enyhítettek (1. kiegészítő fájl: S4a ábra) . A vastagbél NLRP6 és hasított kaszpáz-1 P10 szintje szignifikánsan csökkent, a vastagbél IL-18 szekréciója pedig csökkent a fruktózzal táplált egerekben (4a. Ábra). A kontroll csoportban az antibiotikumok szignifikánsan csökkentették az NLRP6-t és hasították a kaszpáz-1 P10 fehérje szintet, de nem mutattak hatást a vastagbél IL-18 szekréciójára (4a. Ábra). Fruktózzal táplált egerekben az antibiotikumok megfordították a vastagbél IL-18 szekréciójának csökkenését és tovább elnyomták a vastagbél NLRP6 expresszióját (4a. Ábra). Az SCFA-k vagy a pioglitazon szintén megakadályozták a vastagbél NLRP6 szintjének csökkenését és a kaszpáz-1 aktivációt a fruktózzal táplált egerekben, ami az IL-18 termelés helyreállítását eredményezte (4b. Ábra). A kontroll egerekhez viszonyítva a vastagbél NLRP3 expressziója nem változott az SCFA-kkal és pioglitazonnal kezelt fruktózzal táplált egerekben, de jelentősen csökkent az antibiotikummal kezelt kontroll és a fruktózzal táplált egerekben (4a., B. Ábra). Ezenkívül a PPAR-γ és a célgén vastagbél expressziója (ANGPTL4) a fruktózzal táplált egerekben, amelyeket SCFA-k és pioglitazon állítottak vissza, szabályozták (1. kiegészítő fájl: S4b és c ábra).
A normál egerek vastagbélében az SCFA-k orális beadása felszabályozta az NLRP6 expressziót és fokozta az IL-18 termelést (1. kiegészítő fájl: S4d ábra). A tenyésztett egér vastagbél-explantánsok ex vivo rendszerében (ex vivo vastagbél-explantánsok) az SCFA-k emelték az NLRP6 expresszióját és hasították a kaszpáz-1 P10 fehérje szintjét, és elősegítették az IL-18 termelést, és ezeket a hatásokat hisztamin (bakteriális metabolit) elnyomta ( 4c. Ábra). Ezenkívül az NLRP6 fehérje szintjét és az IL-18 termelést az SCFA-k növelték, de csökkentek NLRP6 siRNS-ek egér CT26 vastagbélrákos sejtekben (4d. ábra). Azonban sem a pioglitazon, sem a GW9662 (PPAR-y antagonista) nem befolyásolta a bazális vagy SCFA-stimulált NLRP6 gyulladásos aktivációt az ex vivo vastagbél explantánsokban (1. kiegészítő fájl: S4e ábra). Ezek az eredmények arra utalnak, hogy az SCFA-k aktiválhatják az NLRP6 gyulladást a PPAR-y aktivációtól függetlenül.
Az SCFA-k és a pioglitazone elnyomják a hippocampus neuroinflammatorikus válaszát és a neuronveszteséget fruktózzal táplált egerekben
Vita
A széles spektrumú antibiotikum-kezelést követő egyik legszembetűnőbb megfigyelés a hippocampus neuroinflammation és a reaktív gliosis gátlása volt magas fruktóz tartalmú étrenddel kezelt csoportban, amely hasonló volt az antibiotikumok hatásához az Alzheimer-kór egérmodelljében, egy progresszív neurodegeneratív betegség [41]. Megállapítottuk azt is, hogy a bél mikrobiota kimerülése hippocampus neuronvesztést okozott mind a kontroll, mind a fruktózzal táplált csoportokban, ami arra utal, hogy a bélmikrobák és/vagy metabolitjaik kritikus szerepet játszanak a hippocampus neurogenezisének modulációjában. Érdekes módon az SCFA-k vagy a bél mikrobiota helyreállíthatja a hibás mikrogliákat és megerősítheti a csíramentes egerekben a vér-agy gát integritását [6, 42]. Az SCFA-k jótékony hatása a hippokampusz neuroinflammációjára és a fruktózzal táplált állatok neuronveszteségére tovább bizonyítja a kommenzális mikrobák és/vagy metabolitjaik kritikus szerepét a neurológiai funkciók modulációjában [7].
Következtetések
Világosan kimutattuk, hogy a bél mikrobiotájának magas fruktóz tartalmú étrend által kiváltott aberráns szerkezete és a széklet SCFA-szintjének csökkenése bizonyítja, hogy a bél dysbiosis hozzájárul a hippocampus neuroinflammációjához C57BL/6N egerekben. Mechanikusan a vastagbél NLRP6 gyulladásos diszfunkciója szerepet játszott a bél epitheliális gátjának károsodásában, amelyet SCFA-k vagy pioglitazon javítottak. Ezek az eredmények új bizonyítékot szolgáltatnak az SCFA-k és a pioglitazon protektív mechanizmusairól a hippocampus neuroinflammatorikus válasz és az idegsejtek elvesztése ellen ebben az állatmodellben. Eredményeink rávilágítanak a nyugati stílusú étrend egyik jellemzőjének a hippocampusos neuroinflammációra gyakorolt káros hatására, és új beavatkozási stratégiát javasolnak a neurológiai diszfunkcióra. A jövőben azonban közvetlenebb bizonyítékokat kell beszerezni.
Anyagok és metódusok
Állatok és kezelések
SPF körülmények között nevelt négy hetes C57BL/6N hím egereket (17-20 g) a Beijing Vital River Laboratory Animal Technology Co., Ltd.-től (Peking, Kína; gyártási engedély: SCXK (Su) 2016-0003) vásároltak. ), és hagyták a kísérleti felhasználás előtt egy hétig akklimatizálódni az állattartó létesítmény környezetében. Speciális kórokozóktól mentes, hőmérséklet- és páratartalom-szabályozott környezetben (22 ± 2 ° C, 50 ± 5% páratartalom), 12 órás fény/sötét ciklus mellett helyezték el őket. Ezeknek az egereknek ad libitum hozzáférést biztosítottak az élelemhez és a vízhez.
In vivo permeabilitási vizsgálat
A bélpermeabilitást in vivo FITC-dextrán (FD4; Sigma-Aldrich) permeabilitási vizsgálattal értékeltük, a korábban leírtak szerint [21]. A 4 órán át éheztetett egereket 0,6 mg/testtömeg-kg FITC-dextránnal (4 kDa) 25 mg/ml-es oldatban szoptattuk, és a vért 3 óra múlva submandibularis vérzéssel vettük fel. A szérum fluoreszcencia intenzitását fluoreszcencia spektrofotométerrel (Synergy 2, Biotek, Winooski, VT) mértük. A FITC-dextrán-koncentrációkat a FITC-dextrán soros hígításával kapott standard görbéből határoztuk meg.
Vér- és szövetmintagyűjtés
A kísérletek végén az egereket egy éjszakán át éheztettük, és nátrium-pentobarbitállal (50 mg/kg, i.p.) altattuk, és kardiopunkcióval vért nyertünk. Ezeket a vérmintákat 2500 fordulat/perc sebességgel 10 percig centrifugáltuk a szérumminták összegyűjtésére, amelyeket biokémiai vizsgálatok céljából azonnal -80 ° C-on lefagyasztottak. A Hippocampus és a vastagbél szöveteit histopatológia, transzmissziós elektronmikroszkópos (TEM) elemzés, immunfluoreszcencia festés, kvantitatív polimeráz láncreakció (qPCR) és Western blot elemzés céljából boncoltuk.
16S rRNS génszekvencia elemzés
Az egerekből származó friss székletmintákat fertőtlenített csövekbe gyűjtöttük, a gyűjtés után azonnal folyékony nitrogénben lefagyasztottuk, és az elemzésig -80 ° C-on tároltuk. A széklet DNS-mintáit izoláltuk, és a mikrobiómákat a pekingi Genomikai Intézetben elemeztük egy Illumina MiSeq platformon. Kiváló minőségű olvasmányokat választottak ki a bioinformatikai elemzéshez, és az összes minta összes érvényes olvasatát operatív taxonómiai egységekbe (OTU-kba) csoportosítottuk a szekvencia 97% -os hasonlósága alapján. Az α-diverzitást a Chao1 diverzitás index alapján számítottuk ki. A kísérleti csoportok közötti variációt (β-diverzitás) fő koordináta-analízis (PCoA) diagramokkal értékeltük. A hatásmérettel (LEfSe) párosított lineáris diszkrimináns elemzést a LEFSE szoftverrel végeztük.
A széklet SCFA koncentrációjának meghatározása
Tenyésztett egér vastagbél explantánsok ex vivo rendszere
A tenyésztett egér vastagbél-explantánsok ex vivo rendszerét egy korábbi jelentés [13] módszereinek megfelelően állítottuk össze (2. kiegészítő fájl). Nyolc hetes normál C57BL/6N egerekből származó vastagbéleket hosszanti irányban kinyitottunk, és alaposan átmostunk 100 U/ml penicillint, 100 μg/ml streptomicint és 50 μg/ml metronidazolt tartalmazó hideg HBSS-sel. A vastagbélszöveteket körülbelül 4 mm2-es töredékekre vágtuk, előzetesen áztatott Gelfoam-tutajokra helyeztük, és 1 ml RPMI 1640 táptalajban tenyésztettük, amely 0,01% BSA-t, 200 U/ml penicillint, 200 μg/ml sztreptomicint és 1% Fungizont tartalmazott. A vastagbél explantátumokat nátrium-acetát, nátrium-propionát és nátrium-butirát és hisztamin (H7125; Sigma-Aldrich), pioglitazone vagy GW9662 (PPAR-γ antagonista) keverékének jelenlétében (3: 1: 1 arányban) inkubáltuk. 24 órán át a kísérleti terv szerint. A táptalajt és a vastagbél explantánsokat összegyűjtöttük az NLRP6 gyulladás aktiválásának és a PPAR-γ transzkripciójának tesztelésére.
Sejtkultúra és kezelés
Egér CT26 vastagbélrák sejtek a Shanghai Institute of Biological Sciences-től (Sanghaj, Kína) vásároltuk, és 10% magzati szarvasmarha-szérummal kiegészített 1640-es táptalajban 5% CO2-ot tartalmazó párásított atmoszférában 37 ° C-on tenyésztettük. A kísérletekhez a sejteket 6 lyukú lemezekre szélesztettük 12 órán át, és azokkal transzfektáltuk NLRP6 siRNS vagy negatív kontroll siRNS (GenePharma, Shanghai, Kína) Lipofectamine 2000 alkalmazásával 6 órán át. Ezeket a sejteket 1640 táptalajban inkubáltuk 12,5 mM nátrium-acetát, nátrium-propionát és nátrium-butirát keverék jelenlétében vagy hiányában (3: 1: 1 arány) 48 órán át. A táptalajt összegyűjtöttük, és az összes sejtfehérjét biokémiai és Western blot analízishez extraháltuk.
qPCR elemzés
Western blot elemzés
Ilealis és vastagbél hisztopatológia
A kivágott ileum- és vastagbélszöveteket 4% paraformaldehidben rögzítettük és paraffinba ágyazottuk. A blokkokat sorozatosan 5 μm vastag szakaszokra vágtuk, és hematoxilinnal és eozinnal (H&E) festettük. A szövettani képeket Olympus IX53 mikroszkóppal (Tokió, Japán), Olympus DP73 digitális fényképezőgéppel és Olympus cellSens képalkotó szoftverrel készítettük.
Transzmissziós elektronmikroszkópia (TEM) elemzése
A kivágott ileum- és vastagbélszöveteket alaposan átmossuk a széklet anyagától, és 2,5% glutáraldehiddel rögzítettük PBS-ben. A TEM esetében a szövetmintákat standard protokollokkal dolgoztuk fel a Nanjing Orvostudományi Egyetem (Nanjing, Kína) elemző központjában, és JEOL JEM-1010 transzmissziós elektronmikroszkóppal vizsgáltuk (Tokió, Japán).
Immunfluoreszcens festés és morfometrikus elemzés
Minden csoportból három állatot altattunk és transzkardiálisan perfundáltunk jéghideg 4% paraformaldehiddel. Az agyakat kivágtuk, 4% paraformaldehidben rögzítettük egy éjszakán át, 20% szacharóz/PBS-ben inkubáltuk egy éjszakán át 4 ° C-on, és egy éjszakán át 30% szacharóz/PBS-ben inkubáltuk 4 ° C-on. Ezután az agymintákat az optimális vágási hőmérsékletű vegyületben (Sakura Finetek, USA) lefagyasztották, és kriosztáttal koronálisan 30 μm vastag szakaszokra vágták. A fagyasztott részeket 10% -os szarvasmarha-magzati szérummal PBS-ben blokkoltuk 1 órán át szobahőmérsékleten. A tárgylemezeket primer antitestekkel inkubáltuk egy éjszakán át 4 ° C-on, majd 30 percig inkubáltuk 37 ° C-on Alexa Fluor-konjugált szekunder antitestekkel (Invitrogen). Az elsődleges antitestek között volt egér anti-Iba1 (sc-32725, Santa Cruz), egér anti-NeuN (ab104224; Abcam), nyúl anti-DCX (ab77450; Abcam) és nyúl anti-GFAP (Z0334; Dako). A metszeteket 4,6-diamidino-2-fenilindollal (DAPI) ellenfestettük a magfestés céljából. A képeket Leica TCS SP8 konfokális mikroszkóppal rögzítettük. Minden állatból hat véletlenszerűen kiválasztott agymetszetet használtunk az immunfluoreszcencia-pozitív sejtek felvázolására és számolására a hippocampal DG, CA1 és CA3 régiókban Image-Pro Plus szoftverrel (Media Cybernetics, USA).
Statisztikai analízis
Az adatokat átlag ± SEM-ben fejezzük ki. A statisztikai elemzéseket a GraphPad Prism Software 6.01 (GraphPad Software, San Diego, USA) alkalmazásával végeztük. A különbségeket egyirányú varianciaanalízissel (ANOVA) elemeztük post-hoc tesztekkel, több csoport összehasonlítására. o értékek
Az adatok és anyagok rendelkezésre állása
Az összes 16S rRNS-gén szekvenálás leolvasási adatot letétbe helyezték az Országos Biotechnológiai Információs Központ szekvenciaolvasási archívumában PRJNA540110 azonosítószám alatt.
- Az étrendi zsírgyorsító leptin jelzés elősegíti a protumorigén gyomorkörnyezetet egerekben
- Az étrendi mangán elősegíti a szív staphylococcus fertőzését - ScienceDirect
- A fermentálható élelmi rost elősegíti a helmint fertőzést és súlyosbítja a gazdaszervezet gyulladásos reakcióit
- A vas rendelkezésre állásának étrendi korlátozása gyengíti az UPEC patogenezisét a vizelet egérmodelljében
- Étrendi ajánlások a bél diszbiózisa ellen