Fenotipizálás, etiológiai tényezők és biomarkerek: A precíziós orvoslás felé az autizmus spektrum zavaraiban
ABSZTRAKT:
Az autizmus spektrumzavar (ASD) biológiájának megértésében elért eredmények ellenére az alapvető tünetekkel kapcsolatos hatékony biológiai beavatkozások továbbra is megfoghatatlanok. Az ASD etiológiai heterogenitása miatt az „egy mindenki számára megfelelő” kezelési megközelítés azonosítása valószínűleg továbbra is kihívást jelent. Találkozót hívtak össze a Missouri Egyetemen és a Thompson Központban, hogy megvitassák az ASD-s betegek rétegződésének stratégiáit a precíziós orvoslás felé történő elmozdulás céljából. Az itt bemutatott „fehér könyv” megfogalmazza az ezzel járó kihívásokat és javaslatokat kínál a jövőbeni megoldásokra.
AZ AUTIZMUS SPEKTRUMZAVARA KOMPLEXITÁSAI
Az autizmus spektrum rendellenesség számos, együtt előforduló orvosi és/vagy pszichiátriai állapothoz társulhat, beleértve a rohamokat, a gyomor-bélrendszeri állapotokat, az alvászavarokat, az agresszív viselkedést, a szorongás tüneteit és a figyelemhiányt. Ezek az állapotok társulhatnak kognitív károsodással vagy nem. Egy nemrégiben készült tanulmány az egyidejűleg előforduló orvosi és biológiai változókat is beépítette az adatok által vezérelt fenotípusos klaszterek létrehozásába, feltárva a klasztereket (1) cirkadián és szenzoros diszfunkció, (2) immunrendellenességek, (3) neurodevelopmentális késés és (4) sztereotip viselkedés az ASD-vel kapcsolatos jellemzők egyik elemzésében. 12 Bár a legjobb kezelési mód egyértelmű ezen állapotok esetében (vagyis a rohamok epilepszia elleni gyógyszerekkel történő kezelése), nem ismert, hogy ezek a különböző, együtt előforduló fenotípusos szempontok hogyan kapcsolódhatnak az alapvető jellemzők lehetséges célzott kezeléséhez.
MI A „BIOMARKER”? BIOMÉRKÖZŐK EGY KEZELÉSI FELTÉTELEKHEZ, MINT AZONOSAN MEGHATÁROZOTTAK, MINT AZOK A RÁKOKKAL SZERINT BETEGSÉGEK?
Az Országos Mentálhigiénés Intézet Research Research Criteria (RDoC) kezdeményezése 38 a sajátos jellemzői területeket célozza meg a mentális rendellenességek széles körű kutatásának megközelítéseként, ami fontos szempont az ASD markáns heterogenitásának fényében. Javasolja a tünetek célzó doménjeinek alkalmazását ahelyett, hogy a tünetek konstellációját képviselő diagnózis célzására összpontosítana. Az ASD-ben fontos lesz meghatározni, hogy a specifikus tünetek súlyossága hogyan társul genetikai vagy nongenetikus biomarkerek jelenlétével, ideértve az idegrendszeri változások anatómiai és funkcionális mutatóit is, miközben figyelembe veszik a fejlődési pálya releváns hatását, hogy a lehető legjobban megkönnyítsék. tünetspecifikus individualizált kezelési megközelítések. Bár az előző szakaszban ismertetett korábbi munkában megvizsgálták a genetika és a klinikai markerek közötti összefüggést, más molekuláris adatok (pl. 39-es transzkriptómok) 17,19,28,29 beépítését is figyelembe kell venni.
A fehérjét kódoló gének mellett a nem kódoló RNS-ek is szerepet játszhatnak az ASD kiváltásában, amint azt a mikroRNS-ek diszregulációja mutatja az ASD-ben. 40–44 Egy nemrégiben végzett, egész genomra kiterjedő asszociációs vizsgálat (GWAS) jelentős összefüggést azonosított egyetlen nukleotid polimorfizmussal, amely nem egy kódoló régióban található, hanem inkább egy nem kódoló RNS-ben található, amely a moesin, egy fehérje génjének antiszensz inhibitora. amely szabályozza az idegsejtek architektúráját. 45 Ez a felfedezés bemutatja a nem kódoló RNS potenciális hozzájárulását az ASD kockázatához. Ezenkívül a molekuláris útvonalak konvergenciájának bizonyítékáról számoltak be alternatív splicing 46,47 és transzkriptóma szinten 48, és az mRNS expressziójának fontosságát az utóbbi években egyre inkább hangsúlyozták. 32,33,49 Más epigenetikus markereket is azonosítottak az ASD-vel kapcsolatban. 50,51
Általában a DNS-metiláció, a hiszton-acetilezés és a mikroRNS-markerek szerepe az ASD-ben jelenleg kevésbé ismert. Ezek a kérdések azonban egyre fontosabbá válnak az orvostudomány más területein, például a rák kezelésében. A rák számos különféle típusával a közelmúltbeli kutatások feltárták a biomarkerek fontosságát a kezelési megközelítések optimalizálásában. A DNS-metilációs minták megjósolták, hogy ki a legvalószínűbb bizonyos glioblastoma-terápiákra reagálni, 52 és széles körben ismert, hogy a hormonális markerek megjósolják az emlőrák hormonterápiájára adott választ. 53 Ezért a kapcsolódó megközelítések egyre fontosabbá válhatnak az ASD-ben.
Különös figyelmet kell fordítani azokra a biomarkerekre is, amelyek releváns funkcióval vagy kapcsolatban állnak az idegrendszerekkel, amelyek felelősek egy adott fenotípus (ok) kifejeződéséért a meghatározott fejlődési korszakokban. Például bizonyos szinapszisok vagy regionális áramkörök gerjesztőek lehetnek a fejlődés egyik szakaszában, de gátló hatásúak egy másik korszakban. Ez a szinaptikus fiziológia eltérő módon befolyásolhatja egy adott fenotípus vagy biomarker expresszióját meghatározott fejlődési periódusokban. A glutamaterg és GABAerg rendellenességeket némi következetességgel figyelték meg az ASD-ben a postmortem agyi vizsgálatokban, 54–56 és in vivo a mágneses rezonancia spektroszkópia (MRS) regionális eredményei alapján, 57,58, vagy ha a GABA és a glutamát arányában fejezzük ki az MRS-szel. 59 Lehetséges a perifériás mérések lehetősége is. 60 A GABAerg rendszert érintő mutációk szintén társultak az ASD-vel. 61,62 Mivel a közelmúltban végzett nagy klinikai vizsgálatok a glutamaterg (memantin) és a GABAerg (arbaclofen) rendszereket próbálták megcélozni, az MRS vagy más proximarkerek, például az EEG gamma sáv aktivitása alapján ezekben a rendszerekben aktivitást jelző 5 markernek tűnik 63, 63 ide vonatkozó.
Egyéb markerek, amelyek a kezelés szempontjából relevánsak lehetnek, lehetnek az ASD-ben gyakran atipikus immunjelzők, 64,65 teljes vér szerotonin, 66,67 genetikai polimorfizmus, amelyek befolyásolják a szerotonerg rendszert, 68 vagy szerotonin ligandum markerek a pozitron emissziós tomográfián. 69–73 A szimpatikus/paraszimpatikus tónust jelző oxidatív reaktivitás, 74 és pszichofizikai reaktivitás, 75 azonosíthatja azokat az alanyokat, akik jobban reagálhatnak a metabolikus vagy adrenerg kezelésekre.
Melyek azok a biomarkerek, amelyek irányított klinikai kezelést nyújtottak?
MILYEN KÍsérleteket hajtottak végre a fejlett biomarkerekkel az ASD-nél?
MI A FENOTÍPUS SZEREPE A BIOMARKEREK FELFEDEZÉSÉBEN az ASD számára?
Bár a biomarkerek önmagukban is kritikus információkat nyújthatnak az egyén mögöttes autizmus spektrum-rendellenességgel (ASD) kapcsolatos biológiával kapcsolatban, a fenotípusos információk további kritikus adatokat szolgáltatnak, amelyek a klinikai körülmények között is könnyebben elérhetők, ami lehetővé tenné a kutató vagy klinikus számára, hogy optimális, egyénre szabott kezelés minden beteg számára. A további klinikai információk további kölcsönhatásba léphetnek a biomarker és a kezelési válasz kapcsolatával. A gazdag viselkedési és fenotípusos információk ilyen beépítése a biológiai információk mellé lehetővé teszi a klinikus számára, hogy azonosítsa azokat a jellemzőket, amelyek kapcsolódhatnak ezekhez a biomarkerekhez a legjobb kezelési terv megjóslásához. Amint azt a NIMH RDoC-vel leírták, 38 ez a megközelítés lehetővé teszi a kezelés célzott lehetséges eredményeinek árnyaltabb megértését. A korábbi biomarker-fejlesztési erőfeszítések a fenotípusos információk beépítésének mértékében változtak. Az egyénre szabott kezelés szempontjából potenciálisan releváns alcsoportba sorolt betegek esetében nagyobb fenotípusos információkra lesz szükség.
JELENLEGI STRATÉGIÁK A FENOTÍPUS ELŐÍRÁSÁRA
KÖRNYEZETI EXPOZÍCIÓK, MINT VÁLTOZHATÓ LEHETŐSÉGES BIOLÓGIAI ÉS ÉRTÉKES STRATIFIKÁCIÓ: Az ASD „ENVIROME”
Habár ikervizsgálatokon alapuló korábbi jelentések szerint az autizmus spektrum rendellenesség (ASD) örökölhetősége akár 0,9, a legfrissebb bizonyítékok szerint 111–115 az ASD okának tisztán genetikai összetevője valamivel kevesebb, mint azt korábban gondolták. 116–118 Jóllehet a környezeti okok megértése jóval alacsonyabb, mint a genetikai okoké, figyelembe kell venni azoknak az ASD kifejeződésével összefüggő, a mögöttes idegrendszerekre gyakorolt hatását is. Ez a kutatási terület az utóbbi években megnőtt, több környezeti tényező is előtérbe került. Ezek a vizsgálati vonalak azt a hipotézist sugallják, hogy az ASD „környezete” kölcsönhatásba lép a fejlődő emberi agy specifikus (genetikailag meghatározott) neurális rendszereivel, hogy hozzájáruljon az ASD expressziójához.
Az ASD egyik ilyen nongenetikusan hozzájáruló tényezője az immunrendszer diszregulációja, amelyet gyakran leírtak ASD-ben szenvedő egyéneknél és családtagjaiknál. 65 Legfőképpen az ASD-ben szenvedő gyermekek anyáiban számoltak be arról, hogy a magzati agyfehérjékre reaktív antitesteket hordoznak, amelyek jellemzően fejlődő vagy nem ASD-s fejlődésben szenvedő gyermekek anyáiban hiányoznak. Ezeknek az ASD-specifikus anyai antitesteknek a fehérje célantigénjeit nemrégiben azonosították; ezen fehérjék különféle kombinációinak az anyai antitestek általi felismerése biztosítja az anyai antitestekkel kapcsolatos (MAR) ASD specifitását. Ezekkel a fehérjékkel szembeni antitestreaktivitást az ASD-s gyermekek anyáinak 23% -ában figyelték meg, szemben a tipikusan fejlődő gyermekekkel rendelkező nők kevesebb mint 1% -ával, ami sokkal magasabb ASD arányt képvisel, mint bármely egyes gén. Ezen antitestek etiológiai jelentőségét számos rágcsáló és nem emberi főemlős-kutatás is alátámasztja, amelyek során ezen ASD-specifikus anyai antitestek vemhes állatokba történő injektálása MAR autizmus szempontjából releváns magatartást eredményezett az utódokban. 123–127
A pszichoszociális stresszorok 128 vagy a trópusi viharok 129 a második trimeszter végén és a harmadik trimeszterben való kitettség szintén az ASD fokozott előfordulásával jár. A dán és a svéd kohorsz epidemiológiai tanulmányaiban megnövekedett kockázatot találtak más stressz-kitettségekkel is. Egy tanulmányban ez az összefüggés kifejezetten jelen volt, amikor az anyai pszichiátriai kórtörténetet beépítették az adatelemzésbe. 132 Úgy tűnik, hogy a prenatális pszichoszociális stresszhez kapcsolódó ASD kockázata összefügg az anyai genetikai érzékenységgel a nagyobb stresszreaktivitásra. Ezenkívül rágcsáló-modellben kimutatták, hogy a genetikailag stresszre fogékony anyák utódaiban a prenatális stressz expozíció aberrális társadalmi viselkedést eredményez, 134 ami a fejlődés során a GABAerg idegsejtek késleltetett migrációjával is társult. Az ápolói egészségügyi tanulmány adatainak legfrissebb megállapításai szerint az anyák terhesség előtti stressznek, sőt a korai életkornak kitett stressz az ASD kialakulásának fokozott kockázatával jár a következő terhességekben. 136,137
FENOTÍPUS, BIOMARKEREK ÉS KEZELÉSI PROJEKTEK
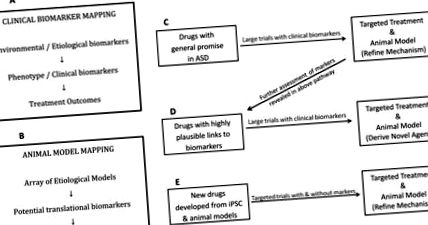
A. Biomarker-gazdag beállítás a korai szakaszban végzett vizsgálatok számára a nagyobb vizsgálatok tájékoztatása céljából
Ez a folyamat egy ésszerű modellt szemléltet, amelyben az idegrendszereket célozzák, ugyanakkor érzékenyek a fejlesztés időzítésére. Az egyik kritikus kérdés az, hogy a korábbi beavatkozás nemcsak a tünetek javulásához vezethet-e a vizsgálat idején, hanem javuló fejlődési pályához is. Az is lehetséges, hogy a korán előnyösnek tűnő kezelések, mint például a szedációt okozó gyógyszerek alkalmazásának csökkent viselkedése, esetleg nem rendelkeznek optimális hosszú távú eredménnyel. Így a részvétel kora és a hosszú távú monitorozás további fontos elem lehet, amelyet figyelembe kell venni a jövőbeli klinikai vizsgálatokba történő beépítéskor.
B. Ok/biomarkerek feltérképezése, új vegyületek kifejlesztésének lehetővé tétele állatmodellekkel, fordítás a klinikai környezetbe célzott módon
A biomarkerekben gazdag környezetben végzett kutatásból származó információk tájékoztatnák az új vegyületek kifejlesztését és értékelését állatmodellekben. E megközelítés optimalizálása érdekében ok/biomarker térképet kell létrehozni a nagy klinikai populációkból. Az ASD környezeti vizsgálatokból, valamint a fejlődési és kognitív idegtudományokból származó ismereteknek módosítaniuk kell az ok/biomarker térképet a megfelelő csomópontokban. Az ASD-vel összefüggő géneket széles körben alkalmazták a preklinikai állatmodellek, köztük egerek, patkányok, drosophila és zebrafish kifejlesztésében. Ezeket a modelleket később az ASD kockázati gének és az új kezelésekre adott válaszok értékelésére használták, azzal az előnnyel, hogy az ASD szempontjából releváns viselkedési eredmények feltárhatók. 175 Ezenkívül az állatmodellek lehetővé teszik a genetikai mutációk és/vagy kísérleti kezelések által előidézett, emberben nem lehetséges viselkedési és fiziológiai hatások értékelését.
Bár a genetikailag módosított állatokat ilyen módon alkalmazó állatkísérleteken alapuló terápiás kezelések később vizsgálhatók egy klinikai populációban, csak akkor lehet biztos abban, hogy az ASD-ben szenvedő betegeknél az adott mutáció okozta válaszreakció (amely a teljes mutációnak csak kis részét képviseli). populáció), és potenciálisan más, nagyon hasonló mechanizmusú. Emiatt létrehozták a Preklinikai Autizmus Konzorciumot a Terápiákhoz (PACT). A PACT célja a genetikailag módosított rágcsáló-modellek kiválasztása szabványosított párhuzamos módszer alkalmazásával a lehetséges új farmakológiai beavatkozások hatásainak felmérésére. 176
C. Hogyan támogathatják az indukált pluripotens őssejtek a biomarkerek fejlődését?
Egy nemrégiben végzett tanulmány idiopátiás ASD-vel rendelkező, betegtől származó iPSC-kből származó 3D-s idegkultúrák (organoidok) felhasználásával bizonyítékot talált a gátló idegsejtek túltermelésére, amelyet a FOXG1 túlzott expresszió befolyásolt. 180 A FOXG1 RNSi általi lebontása ASD eredetű organoidokban helyreállította az egyensúlyt az idegsejtek gátló/gerjesztő termelése között, azonosítva a FOXG1 potenciális gyógyszercélpontot. Jövőbeni transzlációs munkára van szükség a FOXG1 célzás terápiás hatásának teszteléséhez idiopátiás ASD-ben.
Az indukált pluripotens őssejtek a skálázhatóság előnyét kínálják az állatmodellekkel szemben. Az új terápiás gyógyszerek hatásait nagyon hatékony módon lehet értékelni az iPSC modellekkel. 39,181–183. Ezenkívül az a tény, hogy ez az emberi szövet emberi humán mutációin alapul, további előnyöket kínál az esetleges transzlációs hatásban az állatmodellekhez képest. Az iPSC-k azonban korlátozottan képesek mind a nongenetikus okok feltárására, mind azokban az esetekben, amikor az ASD patológiája olyan hatások következménye, amelyek több idegrendszer kölcsönhatását igénylik specifikus fejlődési korszakokban. Jelentős technikai kihívások rejlenek az iPSC kutatásban, beleértve az agykéreg idegsejtjeinek specifikációjával és fenntartásával kapcsolatos kihívásokat. A kezdeti költségek és a technológiához való hozzáférés korlátozza azokat a csoportokat, amelyek ezen a ponton nagyszabású vizsgálatokat végezhetnek az ASD többféle genetikai oka kapcsán az iPSC-k számára. Ez a korlátozás kevésbé problémássá válhat, mivel ezek a technológiák olcsóbbá és szélesebb körben elérhetővé válnak.
A JÖVŐ. MILYEN SZÜKSÉG lesz, hogy felfedezzék az ASD biomarkereit?
Értékes információkat nyertek az ASD környezeti kockázati tényezőivel kapcsolatos nagyobb epidemiológiai vizsgálatok, például az ápolók egészségügyi tanulmánya, valamint a dán és svéd kohorszok, amelyeket a korábbi szakaszokban tárgyaltunk. A gyermekkori autizmuskockázatok a genetikából és a környezetből (CHARGE) tanulmány az ASD és a nem érintett gyermekek nagy mintáit követi nyomon esettanulmány-ellenőrzéssel, hogy meghatározzák a környezeti expozíció, a gyulladásos markerek és a genetikai tényezők etiológiai hozzájárulását és az ASD-vel való kölcsönhatásukat (http: //beincharge.ucdavis.edu/), amely már feltárta a korábbi szakaszokban leírt számos lehetséges környezeti tényezőt. Továbbá olyan tanulmányok, mint az autizmus kockázatának markerei a csecsemőknél-tanulás korai jeleiben (MARBLES) (http://marbles.ucdavis.edu/) és a korai autizmus kockázatának longitudinális vizsgálata (EARLI) (http://www.earlistudy.org /) értékes információkat nyújt számos tényezőről, szorosan nyomon követve az autista gyermekekkel rendelkező családok későbbi terhességét.
* A MISSOURI AUTISM SUMMIT KONZORCIUM tagjai
Lábjegyzetek
A Missouri Egyetemen és a Thompson Központban tartott találkozót, amelyből ez a cikk készült, a Mizzou Advantage, a Missouri Egyetem kancellárja megkülönböztetett látogatói programja, a Missouri Egyetem Klinikai és Transzlációs Tudományok Intézete (iCATS) és a Thompson támogatásai finanszírozták. Autizmus és Neurodevelopmental DI rendellenességek központja.
Közzététel: A cikk elkészítése óta Daniel Smith álláspontot foglalt el a Blackthorn Therapeuticsnál. A többi közreműködő kijelenti, hogy nincs összeférhetetlenség.
- A tudósok új genetikai mutációkat tárnak fel, amelyek az autizmus spektrum rendellenességéhez kapcsolódnak
- A prosztatarák kockázati tényezői Johns Hopkins Medicine
- Alkoholmentes zsírmájbetegség Carr Lab Perelman Orvostudományi Kar a University of
- Alkoholmentes zsírmájbetegség Natural Medicine Journal
- Anyagcserezavar vagy alalia vagy autizmus - Orvosok Szalonja (TM)