β-karotin konverziós termékek és ezek hatása a zsírszövetre
Franck Tourniaire
1 Mezőgazdasági, Élelmezési és Vidékfejlesztési Iskola, Newcastle Egyetem, King's Road, NE2 1PN Newcastle upon Tyne, Egyesült Királyság
Erwan Gouranton
2 INRA, UMR1260 Nutriments Lipidiques et Prévention des Maladies Métaboliques, Marseille, 13385 Franciaország
3 INSERM, U476, 13385 Marseille, Franciaország
4 Univ Aix-Marseille 1, Univ Aix-Marseille 2, Faculté de Médecine, IPHM-IFR 125, 13385 Marseille, Franciaország
Johannes von Lintig
5 Farmakológiai Tanszék, Case Western Reserve University, Cleveland, OH, USA
Jaap Keijer
6 Ember- és állatfiziológia, Wageningen Egyetem, Wageningen, Hollandia
M. Luisa Bonet
7 Molekuláris Biológiai, Táplálkozási és Biotechnológiai Laboratórium és CIBER Fisiopatología de la Obesidad y Nutrición, Universitat de les Illes Balears, Palma de Mallorca, Spanyolország
Jaume Amengual
7 Molekuláris Biológiai, Táplálkozási és Biotechnológiai Laboratórium és CIBER Fisiopatología de la Obesidad y Nutrición, Universitat de les Illes Balears, Palma de Mallorca, Spanyolország
Georg Lietz
1 Mezőgazdasági, Élelmezési és Vidékfejlesztési Iskola, Newcastle Egyetem, King's Road, NE2 1PN Newcastle upon Tyne, Egyesült Királyság
Jean-François Landrier
2 INRA, UMR1260 Nutriments Lipidiques et Prévention des Maladies Métaboliques, Marseille, 13385 Franciaország
3 INSERM, U476, 13385 Marseille, Franciaország
4 Univ Aix-Marseille 1, Univ Aix-Marseille 2, Faculté de Médecine, IPHM-IFR 125, 13385 Marseille, Franciaország
Absztrakt
A legújabb epidemiológiai adatok arra utalnak, hogy a β-karotin védelmet nyújthat az anyagcsere-betegségek ellen, amelyekben a zsírszövet kulcsfontosságú szerepet játszik. A zsírszövet képezi a fő β-karotin tároló szövetet, és funkcióinak kimutatták, hogy modulálódnak a β-karotin bomlástermékekre, különösen a retinára, amelyet a β-karotin 15,15′-monooxigenáz (BCMO1) hasítása után hoztak létre, és a retinsavval. a retina oxidációjából adódóan. Azonban fennáll annak a lehetősége, hogy a β-karotin ép formájában is befolyásolhatja az adipocita működését. A kiütési modell kidolgozása és a funkcióvesztés mutációjának azonosítása rámutatott, hogy a BCMO1 valószínűleg az egyetlen enzim, amely felelős az A-provitamin retinává történő átalakulásáért emlősökben. A BCMO1 -/- egerek felhasználásával a jövőben betekintést kell adni a β-karotin hatásra. Emberekben az intervenciós vizsgálatok rávilágítottak a β-karotin konverzió hatékonyságának óriási interindividuális változására, valószínűleg genetikai polimorfizmusok miatt, amelyek hatással lehetnek a β-karotinra adott válaszra. Ez a rövid áttekintés a β-karotin konverzióban szerepet játszó folyamatokat, valamint a hasítási termékek testzsír- és zsírszövet-működésre gyakorolt hatását tárgyalja.
Karotinoidok és A-provitamin
A karotinoidok fotoszintetikus organizmusok által termelt C40 lipofil pigmentek. Mintegy 600 különféle vegyületet azonosítottak eddig, amelyek közül 50 megtalálható az emberi étrendben. Azonban csak körülbelül 10 van jelen jelentős mennyiségben az emberi plazmában [54]. A karotinoidok kémiai szerkezetük szerint két csoportra oszthatók: a karotinek, amelyek szénhidrogének, és a xantofilok, amelyek szintén oxigént tartalmaznak, és ezért polárisabbak, mint a karotinok. A polaritásbeli különbség következményekkel jár a szöveti eloszlásukra, és befolyásolja a lipoproteinek közötti megoszlást és cserét is [46, 70]. A szubsztituálatlan β-gyűrűt és C11 poliénláncot tartalmazó karotinoidokat A-provitaminnak nevezik, mivel az állatok hasíthatják azokat a retina felszabadulásáért, amely ezt követően átalakulhat retinollá (A-vitamin, lásd alább). A β-karotin képezi a fő provitamin-forrást, napi napi kb. 1-3 mg-os fogyasztással [23, 24, 27, 64].
A magas étrendi fogyasztás vagy a magas plazma karotinoid státusz megfigyelési vizsgálatokban általában a krónikus betegségek (például szív- és érrendszeri megbetegedések, egyes ráktípusok és szembetegségek) kockázatának csökkenésével járt [2, 40]. Ezenkívül számos tanulmány alacsonyabb β-karotin státuszt talált II típusú cukorbetegségben vagy metabolikus szindrómában szenvedő betegeknél, mint egyeztetett kontrolloknál [10, 19, 20, 55, 56, 65, 82]. Az oxidatív stressz szerepet játszik a krónikus és anyagcsere-betegségek kiváltásában és/vagy fennmaradásában, és kidolgozták azt a hipotézist, hogy az antioxidánsok (karotinoidok, polifenolok, tokoferolok) fokozott bevitele megakadályozza az oxidatív stresszt és a betegség előfordulását. Egészen a közelmúltig a karotinoidoknak tulajdonított jótékony egészségügyi hatások összefüggésben voltak azzal a képességükkel, hogy képesek „közvetlen” antioxidánsként (például szabad gyökök eltávolítójaként) fellépni lipofil környezetben, például biomembránokban és lipoproteinekben [45]. A jelenlegi kutatások azonban azt a lehetőséget vizsgálják, hogy a fitokemikáliák jótékony egészségügyi hatásait a génexpresszió modulációja és az indukált endogén védekező mechanizmusok okozhatják [13].
Érdekes, hogy számos beavatkozási kísérlet nem mutatta be a karotinoidok megelőző hatását a betegség előfordulására, és egyes esetekben a hosszú távú, fiziológián felüli adagolás károsnak bizonyult a betegség kockázatának kitett embereknél is [5, 21]. Ezek az adatok arra utalnak, hogy a β-karotin számára előnyös ablak van, és hogy a betegség kialakulásának elkerülése érdekében megfelelő táplálékfelvétel révén optimális karotinoid státuszt kell elérni. Ezenkívül az előnyök ez az egyénenként eltérő lehet életstílusuktól és genetikai hátterüktől függően, mindkettő hajlamos a karotinoidokra adott válasz modulálására, amint azt az alábbiakban tárgyaljuk. Az emberi zsírszövet képviseli a test fő β-karotin készletét [37], és kulcsszerepe van a metabolikus patológiákban [34]. Ezért elképzelhető, hogy feltételezett β-karotin hatás is fellép a zsírszövetben, vagy azt közvetíti. A β-karotin egészségre gyakorolt mögöttes hatása azonban még mindig nem világos, és magában foglalhat antioxidáns tulajdonságokat, de a génexpresszió és/vagy a sejtkommunikáció modulálását is a β-karotin és/vagy származékai által [13].
Karotinoid-oxigenázok
Karotinoid/retinoid út és lipid anyagcsere
A β-karotin és metabolitjai hatása a zsírszövet biológiájára
Adipocita differenciálódás
A zsírszövet erősen képlékeny. Óriási képessége van az adipociták hipertrófiájával és hiperpláziájával történő terjeszkedésre. A preadipociták megkülönböztethetik adipocitákat. Ezt a differenciálódást táplálkozási és hormonális jelek váltják ki, amelyek aktiválják a transzkripciós faktorok kaszkádját, ideértve a CCAAT/enhancer kötő fehérjéket (C/EBP) és a peroxiszóma proliferátorral aktivált γ (PPARγ) receptorokat, amelyek az utóbbi az adipogenezis fő szabályozója ( felülvizsgálatra lásd: [14]).
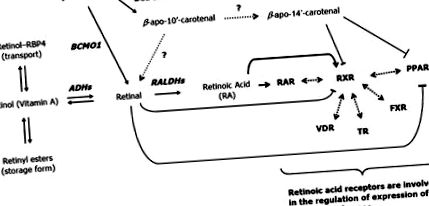
A β-karotin hatását a 3T3-L1 preadipocyták differenciálódására írták le, amely prototípusos modell az ilyen vizsgálatokhoz [38]. Az eredmények azt mutatták, hogy a β-karotin erősen gátolta a 3T3-L1 sejtek zsírkonverzióját. Ezen eredmények alapján azonban nem zárható ki az A-vitamin, mint a β-karotin hatás. Valójában köztudott, hogy az A-vitamin származékok erősen elnyomják az adipocita differenciálódást. Ezt régen megállapították az RA esetében [42], és egy friss cikk elegánsan bebizonyította, hogy a retina fiziológiás koncentrációja in vitro és in vivo elnyomja az adipogenezist [85] az RXRα (retinoid X receptor α) gátlásával és a saját ligandumaik által végzett PPARγ-aktivációval. (2. ábra). Ugyanez a csoport azt is kimutatta, hogy az aszimmetrikus hasítási termék β-apo-14′-karotenal (de nem β-apo-8′ karotenal és β-apo-12′-karotenal) gátló tulajdonságokkal rendelkezik a preadipocyták differenciálódásában a PPARα elnyomásán keresztül, PPARγ és RXR-aktiváció a megfelelő ligandumaikkal [86].
Az RA-t nagyrészt az emlős gén expressziójának modulátoraként vizsgálták. A fő hatásokat a nukleáris hormon receptorainak két típusa közvetíti: a retinoid X receptorok (RXRα, RXRβ és RXRγ), amelyek reagálnak a 9-cisz RA-ra, és a retinsav receptorok (RARα, RARβ és RARγ), reagálnak az all-trans és 9-cisz RA. Ezeknek a nukleáris receptoroknak nagyon széles következményei vannak az általános homeosztázisra. Az RXR-k partnerekként működnek a II. Osztályú nukleáris receptorokban, beleértve a pajzsmirigyhormon-receptort, a D-vitamin-receptort, a PPAR-t, a farnesoid X-receptort és a máj X-receptorokat, és többféle biológiai hatáshoz vezetnek [22]. Hasonlóképpen, az RXR-ekkel, mint heterodimerizációs partnerekkel rendelkező RAR-ok biológiai hatással bírnak, a morfogenezistől és az organogenezistől kezdve a sejtnövekedésig, a differenciálódásig és az apoptózisig [22].
Az adipocita differenciálódás specifikus összefüggésében az all-trans RA hatása számos eseményhez kapcsolódott (áttekintve [6]). Közülük az RA-k zavarják a C/EBP fehérjéket, ami a downstream célgének, köztük a PPARγ indukciójának blokkolását eredményezte. Bebizonyosodott a RARγ (felfelé szabályozás) és az RXRa (le-szabályozás) expresszióra gyakorolt hatás, amely módosítja az adipogenezisben részt vevő nukleáris receptorok heterodimerjeinek összeállítását. Végül az RA-k hatása a retinoblastoma fehérjére elősegítheti a proliferációs képességet, és ezáltal csökkentheti a preadipocyták differenciálódási képességét. Érdekes módon a RA alacsony koncentrációi (1–10 nM), ellentétben a magas koncentrációval (0,1–1 μM), stimuláns hatást mutatnak az adipogenezisre (áttekintve [6]).
Végül azt is figyelembe kell venni, hogy mind az in vivo, mind az in vitro RA (all-transz és 9-cisz) kimutatták, hogy a barna adipociták molekuláris markere, a szétkapcsolódó protein-1 (UCP1) expresszióját indukálja. A provitamin A karotinoidok UCP1 expressziót indukáltak a tenyészetben differenciált primer barna adipocitákban is [61]. Ezt az indukciót azzal magyarázzák, hogy RA és PPAR válaszelemek léteznek az UCP1 gén promoterben. Más UCP családtagok all-trans RA általi beidegzéséről is beszámoltak (lásd [6]).
Adipokintermelés
Lipid anyagcsere
A β-karotinnal vagy az apokarotenallal kezelt adipociták lipid metabolizmusáról kevés adat áll rendelkezésre. Tudomásunk szerint csak az all-trans RA-val foglalkozó tanulmányok jelentek meg. Ezek a vizsgálatok azt mutatták, hogy mind az in vivo (kezelt egerekben), mind az érett 3T3-L1 adipocitákban az all-trans RA kiváltotta az átalakulást a lipogenezis és a fokozott oxidatív anyagcsere csökkentése érdekében, amint azt a génexpresszió változásai, a szövettani változások és a tenyésztett sejtek esetében is megmutatták., fokozódik a lipolízis és a zsírsav oxidációja [50, 51].
Leendő
Elismerés
A szerzők elismerik az Európai Nutrigenomics Network NuGO-t a „karotinoidok” fókuszcsoport finanszírozásáért. Hálásak Dr. Aldona Dembiska-Kiec-nek (JUMC Krakkó, Lengyelország), Patrick Borelnek (INRA 1260 Marseille, Franciaország), Chris Evelo-nak (BiGCat Maastricht, Hollandia), Andreu Palou-nak és Joan Ribot-nak (UIB, Spanyolország) a kézirat.
Összeférhetetlenségi nyilatkozat A szerzők kijelentik, hogy nincs összeférhetetlenségük.
Lábjegyzetek
Georg Lietz és Jean-François Landrier egyaránt hozzájárultak ehhez a munkához.
- A gyors fogyás hatása az elhízottak szisztémás és zsírszöveti gyulladására és anyagcseréjére
- A mérsékelt és az azt követő progresszív fogyás hatása az anyagcserére és a zsírszövetre
- A fakultatív fehérje szelénáció szabályozza a redox érzékenységet, a zsírszövet termogenezisét és
- A zsigeri zsírszövet-raktár összehasonlítható csökkentése étrend által kiváltott fogyás után vagy
- Gyors fogyás 🍡 Amway fogyás elleni termékek mellékhatásai - Kultana orchideák