Kitin és cellulóz feldolgozása alacsony hőmérsékletű elektronnyaláb plazmában †
Tatjana Vasziljeva
1 Moszkvai Fizikai és Technológiai Intézet, Institutsky per., 9, Dolgoprudny, 141700 Moszkva, Oroszország; ur.liam@veragisaa (A.S.); ur.relbmar@6002veilisavnm (M.V.)
Dmitry Chuhchin
2 „Core Arktika” központ, Északi (sarkvidéki) Szövetségi Egyetem, Severnaja Dvina Emb., 17, 163002 Arkhangelsk, Oroszország; ur.liamg@hcstamid
Szergej Lopatin
3 Szövetségi Állami Intézet, Szövetségi Kutatóközpont, RAS biotechnológiai alapjai, Biomérnöki Intézet, 60 let Oktjabrja pr-t, 7/1, 117312 Moszkva, Oroszország; ur.ca.igneib@nitapol (S.L.); ur.ca.igneib@vomalrav (V.V.)
Valerij Varlamov
3 Szövetségi Állami Intézet, Szövetségi Kutatóközpont, RAS biotechnológiai alapjai, Biomérnöki Intézet, 60 let Oktjabrja pr-t, 7/1, 117312 Moszkva, Oroszország; ur.ca.igneib@nitapol (S.L.); ur.ca.igneib@vomalrav (V.V.)
Andrey Sigarev
1 Moszkvai Fizikai és Technológiai Intézet, Institutsky per., 9, Dolgoprudny, 141700 Moszkva, Oroszország; ur.liam@veragisaa (A.S.); ur.relbmar@6002veilisavnm (M.V.)
Michael Vasiliev
1 Moszkvai Fizikai és Technológiai Intézet, Institutsky per., 9, Dolgoprudny, 141700 Moszkva, Oroszország; ur.liam@veragisaa (A.S.); ur.relbmar@6002veilisavnm (M.V.)
Absztrakt
1. Bemutatkozás
Két természetes megújuló biopolimer, nevezetesen a cellulóz (több száz-sok ezer β-1,4-kapcsolt d-glükóz egység lineáris lánc) és a kitin (a β-1,4-kapcsolt 2-amino-2-dezoxi- lineáris heterokopolimer d-glükopiranóz és 2-acet-amido-2-dezoxi-d-glükopiranóz egységek) a földön a legelterjedtebb poliszacharidok. A cellulóz-, kitin- és kitozánszármazékok nagyon ígéretesek olyan technológiai és ipari alkalmazások számára, mint a mezőgazdaság, a mikrobiológia, az élelmiszer-feldolgozás, az orvostudomány, valamint a cellulóz és papír alágazat.
Bár a polimerek egyedülálló tulajdonságokkal rendelkeznek (magas biokompatibilitás az élő szövetekkel, biológiai lebonthatóság, komplexképesség, alacsony toxicitás stb.), Számos ipari területen korlátozottan alkalmazhatók, mivel oldhatatlanok a legtöbb oldószerben. Például vízoldható kis molekulatömegű kitooligoszacharidokra (COS) (kevesebb, mint 10 kDa) általában szükség van az orvostudományban, a gyógyszerészetben és a mezőgazdaságban [5,6,7,8,9,10]. Az alacsony molekulasúlyú cellulózfragmensek a mikrobiológia szubsztrátjai, mivel mikrobás fermentáció útján monoszacharidokká és számos termékké, fermentálható cukrokká alakíthatók bioetanol szintézis céljából [11].
Hagyományos módszer az egyszerű és viszonylag olcsó kémiai hidrolízis tömény savakban vagy lúgokban magas hőmérsékleten. Ezek a technikák azonban általában több órát vagy akár napokat is igénybe vesznek, és a feldolgozó berendezés károsodik a korrózió miatt, és semlegesítési eljárásokra van szükség [12,13,14,15]. Ezenkívül a mérgező hulladék és a környezeti szennyeződés a poliszacharid kémiai feldolgozásának velejárója. A kémiai módszerek másik problémája a módosított kémiai szerkezetű termékek képződése. Például a kitin kémiai lebontása dezacetilezett COS kialakulását eredményezheti, de további (bio) kémiai reakciókhoz általában a kitinszerkezetben rendelkezésre álló stabil N-acetilcsoportokra van szükség [12,13].
Az enzimek gyakran előnyösebbek a katalitikus kapacitású szervetlen vegyületekkel szemben, mivel környezetileg fenntarthatóak. A cellulóz enzimatikus hidrolízise azonban gyakran nem teljes, és a képződött termékek magas polidiszperzitási indexgel rendelkeznek [16].
Így a gazdaságilag megvalósítható és környezetbarát módszerek kifejlesztésére irányuló erőfeszítések a poliszacharid lebontására ésszerűnek tűnnek. A nem egyensúlyi, alacsony hőmérsékletű plazmákat alkalmazó plazmakémiai technológiák ígéretes alternatívát jelenthetnek a fent említett hidrolízis módszerekkel szemben. Korábbi tanulmányaink kimutatták, hogy az elektronsugaras plazma (EBP) alkalmazható a kitozán hatékony és szabályozható megsemmisítésére, és a vízoldható COS magas hozama érhető el az EBP-kezelési eljárás optimalizálásával [17].
Jelen tanulmány célja a következő volt:
A kitin és a cellulóz EBP-feldolgozásának tanulmányozása és a vízoldható kis molekulatömegű termékek (LMWP) EBP-stimulált képződésének időfüggőségének feltárása.
Az előállított LMWP kémiai szerkezetének és molekulatömegének jellemzése.
Javasolni az EBP poliszacharidokra gyakorolt lehetséges mechanizmusait.
2. Eredmények
2.1. A poliszacharidok EBP-feldolgozása
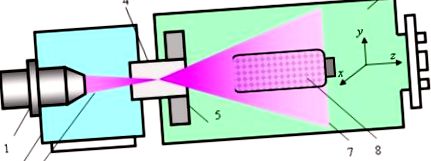
Az 1. ábra szemlélteti az elektronsugaras plazma-kémiai reaktor (EBPR) tervezését és működését. Az EBPR-t, annak működési módjait és a biomateriális kezelési sémák optimalizálását, valamint az EBP tulajdonságait részletesen leírta a [18,19].
Elektronsugaras plazma-kémiai reaktor és a kezelési eljárás sémája: 1 - elektronnyalábos pisztoly; 2 - nagy vákuum kamra; 3 - elektronnyaláb; 4 - injekciós ablak; 5 - elektromágneses letapogató rendszer; 6 - munkakamra; 7 - EBP felhő; 8 - keverő eszköz kezelendő poliszacharidporral.
Röviden: a 2 nagy vákuumkamrában elhelyezkedő 1 elektronnyalábos pisztoly által generált fókuszált EB 3-at a 4 befecskendező ablakon keresztül bepermetezik a 6 munkakamrába, amely plazmát generáló gázzal van feltöltve. elasztikus ütközésekben szóródik szét, és a gyors elektronok energiája a közeggel járó különféle rugalmatlan kölcsönhatásokban (ionizáció, gerjesztés, disszociáció) fokozatosan csökken. Ennek eredményeként létrejön a 7 EBP felhő, ahol az összes plazma paraméter az x, y és z koordináták függvénye (z az EB injekció tengelye).
Az 5 elektromágneses letapogató rendszer a munkakamrában, az injekciós ablak közelében helyezkedik el, képes elhajlítani a befecskendezett EB tengelyt x és y irányban, és ezzel szabályozni a plazma részecskék térbeli eloszlását a plazma tömegben. A munkakamrát előzetesen nyomásra kiürítik
1 Pa, majd megtöltötték plazmát előállító közeggel - kémiailag tiszta oxigénnel (Sigma-Aldrich, München, Németország) 670 Pa-ig.
A poliszacharid porokat egy speciális 8 keverőreaktorban dolgoztuk fel. Az eszköz (2.a ábra) egy hengeres 1a kvarctartályt tartalmaz, belső 3a bordákkal; léptetőmotorral van felszerelve, amely az edényt különböző módokban forgatja (folyamatos, szakaszos, hátramenet stb.). Amikor az edény forog, a kezelendő poranyag (4a) keveredik. Az eszközt az EBPR munkakamrába helyezzük, amelyet a szükséges nyomáson megtöltünk a plazmat generáló gázzal, és az EB 2a-t a reaktor nyitott végén keresztül fecskendezzük be. Ennek eredményeként az 5a aeroszol reakciózóna képződik az edény belsejében. A poliszacharidok kezelési időtartama (τ) az 1–20 perc közötti tartományban változott. A poliszacharidok hőpusztulásának megakadályozása érdekében ezeket Ts = 40 ° C hőmérsékleten dolgozták fel. A minta hőmérsékletét a kezelés alatt Optris LS optikai IR-pirométerrel (Optris GmbH, Portsmouth, NH, USA) vagy a reakciózónába helyezett miniatűr hőérzékelővel figyeltük. Az anyag hőmérsékletét az EB áramának változtatásával szabályoztuk.
A keverőberendezésben feldolgozott poliszacharidporok:a) A keverőberendezés kialakítása poliszacharidporok EBP-kezelésére: 1a - hengeres kvarcedény; 2a - az EBP felhő; 3a - belső válaszfalak; 4a. Poliszacharid por; 5a — aeroszol reakciózóna. (b) Kitinpor az EBP reakciózóna fotóján.
2.2. Az EBP-vel kezelt poliszacharidok jellemzése
2.2.1. Molekulatömeg jellemzése
Az eredeti poliszacharidok vízben nem oldódtak, és az EBP-kezelés (τ = 1–10 perc) növelte vízben és néhány más oldószerben való oldhatóságukat a polimerizációs fok csökkenése és az alacsony molekulatömegű termékek (LMWP) képződése miatt. Az 1. táblázat szemlélteti az EBP-vel kezelt cellulóz-szulfát desztillált vízben és 5% NaOH-ban való oldhatóságának változását. Az oldható cellulóz LMWP hozama az EBP-kezelés időtartamával nőtt, és 10 perces kezelést követően elérte a 77,4% -ot (vízoldható LMWP esetén). A 2 percig tartó EBP-feldolgozás jelentősen csökkentette az oldhatatlan frakció polimerizációs fokát.
Asztal 1
Az EBP-vel kezelt cellulóz-szulfát oldhatósági változásai desztillált vízben és 5% NaOH-ban.
Az EBP-feldolgozás ideje, min. Vízben oldódó termékek hozama, a termékek% -os hozama, 5% NaOH-ban oldható, az oldhatatlan maradékok% -os hozama 1, a nem oldható maradékok polimerizációs foka| 0 | 1.8 | 6.8 | 93.2 | 960 |
| 2 | 22.7 | 45.3 | 54.7 | 460 |
| 10. | 77.4 | 100 | 0 | - |
1 Az oldhatatlan maradék olyan termékeknek felel meg, amelyek nem oldódnak sem 5% NaOH-ban, sem desztillált vízben.
A 10-től magasabb és a glükóz monomerekig terjedő polimerizációs fokú termékek keverékét az EBP-vel kezelt cellulóz kivonataiban kromatográfiás technikával, a Rezex RSO-oligoszacharid Ag + (4%) ionkizáró oszlopával (Phenomenex, Torrance, CA, USA). A vízoldható LMWP polimerizációs foka többnyire a 3–10 tartományban van. Alacsonyabb (legfeljebb glükóz monomerekig) és nagyobb molekulatömegű termékeket is megfigyeltek (3. ábra). Eleinte az LMWP koncentrációja a polimerizációs fok csökkenésével 6-ra csökken, majd ismét emelkedik. A képződött termékek molekulatömeg-eloszlását a 4. ábra mutatja. A túlsúlyban lévő tetramerrel végzett LMWP képződést 13C-NMR analízissel is megerősítettük.
Az EBP-feldolgozás eredményeként kapott vízoldható cellulóz LMWP ligandcserélő kromatogramja: 1 - glükóz; 2–10 — LMWP különböző polimerizációs fokokkal (a számok megegyeznek a polimerizáció mértékével); RI - törésmutató.
A cellulóz EBP-feldolgozásakor képződött termékek molekulatömeg-eloszlása: 1 — eredeti cellulóz; 2 - az EBP-ben 2 percig kezelt cellulóz; 3 - az EBP-ben 10 percig kezelt cellulóz.
Az EBP-vel kezelt kitin kizárási kromatográfiájával kis molekulatömegű kitooligoszacharidok (COS) képződését mutattuk ki, átlagos tömegű molekulatömegű Mw = 1000–2000 Da és 2,2 polidiszperzitási index mellett.
Mivel a kitozán EBP-stimulált pusztulása során a dimerektől a heptamerekig változó polimerizációs fokú MOS = 800–2000 Da és a polimerizációs fok már korábban bebizonyosodott [17], ezért az összes poliszacharid esetében az EBP által stimulált feldolgozás ugyanaz a mechanizmusa feltételezett.
2.2.2. A poliszacharidok EBP-feldolgozásának főbb jellemzői
Jelen kísérleteink feltárták a vízoldható LMWP hozam függését a kezelési időtől, és találtak néhány egyéb jellemző tulajdonságot a kitin és a cellulóz EBP-feldolgozásában:
Optimalizált kezelési körülmények között (plazmageneráló közegnyomás, elektronnyaláb-jellemzők, a keverőberendezés kialakítása) mindössze 2 percre volt szükség ahhoz, hogy alacsony molekulatömegű COS-t kapjon 85% -os hozam eredeti kitinporból [17]. A vízben oldódó cellulóz LMWP maximális hozamát (77,4%) 10 perc múlva értük el (1. táblázat).
Az LMWP hozam és az EBP-kezelés időtartama közötti küszöbérték-kapcsolat. Optimális kezelési körülmények között a kitin és a cellulóz pusztulása leállt, amikor a feldolgozási idő elérte a 7, illetve a 15 percet.
2.2.3. Kémiai szerkezet jellemzése
A rendezett fázis 30% -kal csökkent a kezelt cellulóz mintákban az eredeti anyaghoz viszonyítva, míg az amorf frakció tartalma nőtt. A cellulóz kristályosság indexét (CI) XRD technikával határoztuk meg. Megállapították, hogy az amorfitás plazma-kémiai kezelés után növekszik: a módosított cellulóz CI-je 76,4%, míg a kezeletlen anyag CI-értéke 86,4%. Ugyanez a tendencia mutatkozott a kitin esetében is. Az előzetes kísérletek a CI elvesztését mutatták ki a következő tartományokban: 61,1% -tól 65,9% -ig (eredeti kitin) 50,9-55,2% -ig oxigéntartalmú közegben végzett EBP-kezelés után.
Az alacsony hőmérsékletű EBP számos aktív oxigénfajta (O, O •, szingulett oxigén, OH • stb.) Forrása (5. ábra), amelyeket plazma kémiai folyamatokban nagyon magas koncentrációban (akár 10 10–10 11 cm −3) [18]. Ezek a részecskék felelősek lehetnek a poliszacharidok elpusztításáért és oxidációjáért. Az oxigénes kezelés következtében a poliszacharid molekulák oxidációs változásainak feltárására FTIR-spektroszkópiát alkalmaztunk. A cellulóz IR-spektrumanalízise intenzív abszorbanciát mutatott 1720–1750 cm-1-nél (6. ábra), ami a karbonil C = O csoportok jelentős növekedésének tulajdonítható [20].
Az oxigén EBP optikai spektruma látható és NIR tartományokban; a különböző oxigénfajoknak tulajdonított csúcsok összhangban vannak a [21,22].
- Kitin és cellulóz feldolgozása alacsony hőmérsékletű elektronnyaláb plazmában - PubMed
- Végső jelentés Cellulóz nanorészecskékkel megerősített ökokompozitok a meglévő alternatívája
- Gyógyító plazma összegyűjtése és értékelése a COVID ‐ 19 kezeléshez miért és hogyan Tiberghien - 2020
- Az emelkedett plazma endotelin-1 csökkent testsúlycsökkenéssel jár együtt a függőleges hüvelyes gastrectomia után
- Fogási súlyú termékek feldolgozása raktárkezeléssel - Supply Chain Management Dynamics 365