Ösztrogénhiány és az elhízás eredete a menopauza idején
Fernando Lizcano
1 orvosbiológiai kutatóközpont, Universidad de La Sabana (CIBUS), 7. km, Autopista Norte de Bogota, Chia, Kolumbia
2 Fundacion Cardio-Infantil Instituto de Cardiologia, Bogota, Kolumbia
Guillermo Guzmán
1 orvosbiológiai kutatóközpont, Universidad de La Sabana (CIBUS), 7. km, Autopista Norte de Bogota, Chia, Kolumbia
Absztrakt
1. Bemutatkozás
Az elhízás és az elhízással összefüggő rendellenességek, például a 2. típusú diabetes mellitus (2. típusú DM), a szív- és érrendszeri betegségek és a magas vérnyomás világszerte járványok, és a fejlődő országokban nagyobb arányban növekednek [1–3]. Számos genetikai és epigenetikai tényező határozza meg a testzsír felhalmozódásának patofiziológiáját [4, 5]. E tényezők többsége különböző kategóriákba sorolható [6–9], például (1) az étvágy és a jóllakottság hormonális szabályozásáért felelős tényezők; (2) a test glükózszintjét szabályozó tényezők [10–12]; (3) a bazális metabolikus sebesség szabályozói [13, 14]; (4) a zsírsejtek mennyiségét, elhelyezkedését és eloszlását szabályozó tényezők [15, 16]; (5) modulátorok a progenitor sejtek differenciálására [17, 18]; és (6) azok a tényezők, amelyek meghatározzák az adipocita sejtek származását [19, 20]. Az adipociták szabályozhatják a citokinek termelését is, amelyek ellenőrzik a központi idegrendszer jóllakottsági és éhségközpontjait, és modulálják az egyéb szövetek energiafogyasztását [21–23].
A menopauzás nők túlsúlyának és elhízásának növekedése fontos közegészségügyi probléma [24, 25]. Az elhízás prevalenciája, amely szorosan összefügg a kardiovaszkuláris rizikóval, jelentősen megnő az amerikai nőknél, miután elérik a 40 éves kort; a prevalencia 40 és 59 év között eléri a 65% -ot, a 60 évnél idősebb nőknél pedig 73,8% -ot [26]. Sajnos korlátozott számú gyógyszer létezik az elhízás kezelésére, mert az új termékek többségét visszahívták mellékhatások miatt [27–29].
2. Módszerek
A tanulmány megtervezése a meglévő publikált eredeti cikkek és áttekintések áttekintése volt. Az SSB-k és az egészségügyi eredmények ezen áttekintését a Preferred Reporting Items for Systematic Review and Meta-Analysis Statement (PRISMA) [35] szerint végeztük el. A PubMed publikációit 2013. november 30-ig vették figyelembe.
3. Ösztrogének és ösztrogénreceptorok a zsíranyagcserében
A hormonok segítik az anyagcsere-kölcsönhatás integrálását a főbb szervek között, amelyek nélkülözhetetlenek az anyagcsere-intenzív tevékenységekhez, például a szaporodáshoz és az anyagcsere-funkcióhoz. A nemi szteroidokra van szükség a zsírsejtek anyagcseréjének szabályozásához, és befolyásolniuk kell az egyes zsírraktárak nemi specifikus átalakulását is [36, 37]. Emberben a zsíreloszlást szabályozó tényezőket részben a nemi hormonok koncentrációja határozza meg [38]. A férfiaknak átlagosan kevesebb az összes testzsírjuk, de több a centrális/intraabdominális zsírszövet, míg a nőknél általában több az összes zsír, amely a gluteális/femorális és subcutan depótnak kedvez [39]. A testsúly és a zsír hasi megoszlása különbözik a reproduktív korú és a menopauzás nők körében [40, 41]. A menopauzás nők ösztrogénszintjének csökkenése a bőr alatti zsírvesztéssel és a hasi zsír növekedésével jár [42]. Nyilvánvaló az ösztrogének jelentősége a szubkután zsír felhalmozódásában; valójában az ösztrogén hormonterápia férfiaknál is növeli a bőr alatti zsír mennyiségét [43, 44].
Emberben a 17-β-ösztradiol (E2) a legerősebb ösztrogén, amelyet az ösztron (E1) és az ösztriol (E3) követ, [45]. Az enzimeket az ösztrogén szintetikus útvonalában kódoló gének, például az aromatáz és a reduktív 17β-hidroxi-szteroid dehidrogenázok (17β-HSD) expressziója kritikus az E2 képződés szempontjából [46]. Több átfedő funkciójú gén fehérjetermékei reduktív 17β-HSD aktivitást eredményezhetnek a perifériás szövetekben [47].
Az ösztrogének működését a nukleáris receptorok közvetítik, amelyek transzkripciós faktorok, amelyek a nukleáris receptorok szupercsaládjához tartoznak. Kétféle ösztrogénreceptort (ER) azonosítottak, az alfa (ERα) és a béta (ERβ) receptorokat [48, 49]. Az ER hatásának klasszikus genomiális hatásmechanizmusa általában órákon belül jelentkezik, ami a célgének aktiválásához vagy elnyomásához vezet. Ebben a klasszikus jelátviteli útban az ligandummal aktivált ER disszociál chaperone hősokk-fehérjéjéből, és dimerként kötődik közvetlenül egy ösztrogén-válasz elemhez (ERE) a célgének promóterében [50–52], bár úgy ítélték meg, hogy az akció az E2 gén expressziójának szabályozásában szerepet játszott. A közelmúltban egyre több bizonyíték van azokra a nem nukleáris citoszolos vagy plazmamembrán-asszociált receptorokra, amelyek több szteroid hormon nongenomikus és gyors hatását közvetítik [53–55]. Ilyen módon megállapították, hogy a hagyományos ösztrogén magreceptorok a sejtmagon kívül működnek, hogy közvetlen nongenomikus hatásokat fejtsenek ki [56].
A membránjelző aktiválás számos mechanizmusa magyarázhatja az E2-re adott gyors reakciókat. Ezek a gyors cselekvések magukban foglalják a kináz, a foszfatáz és a foszfolipáz aktiválását, amely közvetítheti a kalciumfüggő jelátvitelt és közvetítheti a downstream nongenomikus fiziológiai reakciókat, például a sejtciklusra, a sejtek túlélésére és az energia-anyagcserére gyakorolt hatásokat [57, 58].
A humán szubkután és viscerális zsírszövetek mind az ERα-t, mind az ERβ-t expresszálják [59, 60], míg a barna zsírszövetben csak az ERα mRNS-t azonosították [61, 62]. Az ERα nagy szerepet játszik az adipociták aktivitásában és a zsíreloszlás szexuális dimorfizmusában. Az ERα hiányú nőstény és hím egereknek központi elhízásuk van, súlyos inzulinrezisztenciájuk van és cukorbetegek [63–65]. Bár nem minden tanulmány egyezik, az emberekben az ERα polimorfizmusa összefüggésben áll a szív- és érrendszeri betegségek kockázati tényezőivel [66].
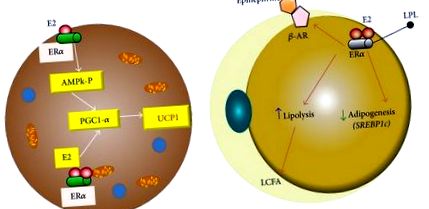
Ösztrogén a zsírsejtben. (a) Barna adipocita sejtekben az ER alfa receptor növelheti az UCP1 expresszióját azáltal, hogy növeli a PGC1alpha koaktivátort az AMPk-n keresztül, és közvetlen hatással van a receptor koaktivátorra. (b) A fehér adipocita ER-alfa-receptorának ösztrogén általi aktiválása csökkenti a lipoprotein-lipázt és növeli a béta-adrenerg receptor aktivitását. UCP1: az 1. fehérje szétkapcsolása; PGC1alpha: peroxiszóma proliferatív aktivált receptor gamma koaktivátor 1 alfa; ER: ösztrogén receptor; AMPk: AMP-aktivált protein-kináz. LPL: lipoprotein lipáz; β-AR: adrenerg receptor béta.
4. Az étvágy és a jóllakottság központi magjának ösztrogénszabályozása
Az elhízás ösztrogén hipotalamusz-kontrollja. Az agyban található ER alfa szabályozza a testtömeget mind a hímek, mind a nők esetében. ▸ A női SF1 idegsejtekben található ER alfa szabályozza az energiafelhasználást és a zsíreloszlást. POMC: proopiomelanokortin; SF1: szteroidogén faktor-1.
5. Ösztrogén és energia szabályozás
Az ösztradiol hozzáférhetősége befolyásolja a trikarbonsav-ciklus aktivitásában részt vevő enzimek szabályozását. Az E2 fokozza a glikolitikus/piruvát/acetil-CoA útvonalat az oxidatív foszforilációhoz és az ATP előállításához szükséges elektronok előállításához a glükóz elsődleges tüzelőanyag-forrásként történő felhasználásának fenntartása érdekében.
A lipoprotein lipáz (LPL) az energia-anyagcsere kulcsszabályozó enzime, amely lebontja a plazma trigliceridjeit szabad zsírsavakká és glicerinné. Az ösztradiol modulálja az LPL aktivitását, ahol a promoter régió olyan ösztrogén válasz elemeket tartalmaz, amelyek kölcsönhatásba lépnek az ösztrogén receptorral és gátolják az mRNS expresszióját a 3T3 sejtekben és az ösztradiol tapaszokkal kezelt betegeknél [118, 119]. Szintén el kell ismerni az ösztrogének szerepét a mitokondriumokban, amelyek a sejtek ATP-jének több mint 90% -át termelik. A mitokondrium fontos szerepet játszik a sejtek túlélésének és az apoptózis szabályozásában, és a légzési lánc az elsődleges strukturális és funkcionális komponens, amelyet az ösztrogén aktivitás befolyásol [61]. Az ösztrogén oxidatív stresszre gyakorolt védőhatását a citoszolból származó specifikus enzimek transzlokációja közvetíti, amelyek megakadályozzák a szabad gyökök oxidatív támadásának mitokondriális ADN-jét [120].
6. Ösztrogén és adipokin szekréció
Az ösztrogének számos adipokinra gyakorolhatnak hatást, amelyeket az adipociták termelnek. A premenopauzás nők ösztrogénszintje szorosan összefügg a leptinszinttel [129, 130]. A leptin anorektikus hatással modulálhatja a hipotalamusz energiamérlegét, és lipolitikus hatást is mutat. Az ösztrogén növeli a leptin érzékenységet azáltal, hogy szabályozza a leptin-specifikus receptorok expresszióját [130–132].
Az adiponektin fordítottan összefügg az ösztrogénszinttel. Ez az adipokin különféle gyulladásos folyamatokban, az endotheliális funkció modulációjában és az inzulinrezisztencia szindróma elleni védelemben vesz részt. Az adiponektin plazmaszintje közvetetten és negatívan korrelál az E2 plazmaszintjével. A felnőtt egerek oophorectomiája megnöveli az adiponektint, amelyet az E2 helyettesítés megfordít [133–135].
A rezisztin egy hormon, amelyet az adipociták termelnek, és hozzájárul az elhízáshoz. Az ösztradiol-benzoát szubkután injekciója csökkenti az adipociták rezisztinszintjét [136].
Az aromatáz ArKo hiányos modellek bizonyítékai hozzájárulnak ezekhez a megfigyelésekhez. Ezeknek az egereknek egy truncalis elhízási fenotípusuk alakul ki megnövekedett gonadális és zsigeri adipozitással és háromszor magasabb keringő leptinnel, anélkül, hogy a test súlya jelentősen növekedne [137]. A zsírsejtek gyulladásgátló adipocitokinek képesek előállítani, amelyek az elhízás számos szövődményét kiváltják, mint például a CD68, a TNFα vagy az IL6. Az ösztrogének ovariectomizált nőstény egereknek való beadása jelentősen csökkenti az IL6, TNFa és CD68 mRNS-ét. Ezenkívül az ösztrogén megakadályozta a nőstény egereket a máj steatosisának kialakulásában és az inzulinrezisztencia kialakulásában [72, 138].
7. Ösztrogénszerű vegyületek és endokrin rendellenességek
Egyes vegyi anyagok és növényi eredetű vegyületek, amelyek szabályozhatják az ösztrogén receptorok aktivitását, potenciális obezogének [139]. Értékelték a tibolona, egy ösztrogén aktivitású szintetikus anyag testmennyiségre gyakorolt hatását a posztmenopauzás nőknél [140, 141]. Az egyéves tibolona kezelés csökkenti a zsírtömeget. Azonban a tibolona 17-β-ösztradiollal és noretindron-acetáttal kombinálva 2 évig nem csökkenti jelentősen a zsírtömeget [142]. A hormonpótló kezelés és a tibolona kombinációja menopauzás nőknél növeli a testtömeg-indexet (BMI), a zsírmentes tömeget (FFM), a szabad ösztrogén-indexet (FEI) és a szabad tesztoszteron-indexet (FTI), de a derék-csípő arányt (WHR) csökken a tibolona kezelés után [142]. A genistein fitoösztrogén, amelynek szerkezete hasonló a humán női 17-β-ösztradiollal, amely mind az alfa, mind a béta ösztrogén receptorokhoz képes kötődni, és utánozza az ösztrogének célszervekre gyakorolt hatását. A genistein szója van jelen, és a postmenopauzás nőknél népszerű. A genistein alacsony dózisoknál általában elhízást vált ki, de a magasabb dózisok növelik a zsírsav oxidációját és csökkentik a zsír felhalmozódását a májban [117, 143]. A Genistein azonban megfordítja a csonk zsírfelhalmozódást a posztmenopauzás nőknél és az ovariektomizált rágcsáló modellekben [144, 145].
Az elhízást genetikai és környezeti tényezők kombinációja okozza [146]. A környezetben található egyes xenobiotikumok károsítják a különféle nukleáris receptorok normális szabályozását vagy adipogén hatást váltanak ki. Ezeknek az endokrin rendellenességeknek a szerepét a szexuális viselkedésben, a menopauzában és egyes ivarmirigy-betegségekben megvizsgálták az ösztrogén receptor-aktivitás modulációja miatt. Számos vegyszer és növényi eredetű vegyület, mint például a biszfenol A (BPA), a ftalátok és a nehézfémek ösztrogén aktivitást mutatnak [147–150]. Számos endokrin rendellenesség befolyásolhatja a nukleáris receptorok transzkripciós aktivitását azáltal, hogy megváltoztatja a ligandkötő doménnel való kompetitív kötés hatását, amely módosíthatja a koaktivátor aktivitását és disszociálja a deacetilázok hatását csökkentő corepresszorokat. Egyes endokrin rendellenességek módosíthatják a DNS-metilációt a specifikus gének szabályozó régiójában is. Továbbá néhányuk aktiválhatja a fehérjék foszforilezését [151, 152].
Az endokrin rendellenességek különféle ösztrogén beavatkozási folyamatokban is részt vehetnek, például a glikolitikus úton és a glükóz transzporterek szabályozásakor olyan vegyületekkel, mint a BPA, a 4-nonilfenol (NP), a 4-oktilfenol (OP) és a 4-propilfenol [116, 153, 154]. Ezeknek az anyagoknak az endokrin rendellenességei szintén zavarják a trikarbonsav anyagcserét azáltal, hogy csökkentik a mitokondriális aktivitás kulcsfontosságú enzimeit, amelyek részben összefüggésben lehetnek az elhízással (4. ábra).
Ösztrogén hatású komponensek. Ösztrogén és néhány endokrin rendellenesség, amelyek ösztrogén hatásúak. A DDT vegyi műtrágya. A biszfenol A egy szerves vegyület, amelyet polikarbonát polimerek és epoxigyanták előállítására használnak; A genistein egy izoflavon, amely számos növényben megtalálható, beleértve a szóját is. DDT: diklór-difenil-triklór-etán.
Ezen megállapítások mellett számos más ösztrogén által közvetített utat modulálhatnak az endokrin rendellenességek. További vizsgálatokra van szükség ezen vegyi anyagok részvételének tisztázása érdekében.
8. Ösztrogénterápia és elhízás
Egyre több bizonyíték bizonyítja, hogy az ösztrogén jelátvitel fontos szerepet játszhat a menopauzás nők elhízás kialakulásában. A menopauzás nőknél háromszor nagyobb az elhízás és a metabolikus szindróma rendellenességeinek kialakulási esélye, mint a premenopauzás nőknél [155]. Továbbá, az ösztrogén/progesztin alapú hormonpótló terápia menopauzás nőknél kimutatta, hogy csökkenti a zsigeri zsírszövetet, az éhomi szérum glükóz- és inzulinszintjét [70, 156]. Az ösztrogének csökkentik a menopauza idején növekvő kardiovaszkuláris kockázati tényezőket is. Ezért az ösztrogénterápia pozitív hatást fejthet ki az összkoleszterin és a relatív LDL szint csökkentésével [157].
A menopauzás nőknél végzett több mint 100 randomizált vizsgálat metaanalízise elemezte a HRT hatását a metabolikus szindróma komponenseire. A szerzők arra a következtetésre jutottak, hogy cukorbetegség nélküli nőknél mind az orális, mind a transzdermális ösztrogén, progesztinnel vagy anélkül, növeli a sovány testtömeget, csökkenti a hasi zsírtartalmat, javítja az inzulinrezisztenciát, csökkenti az LDL/nagy sűrűségű-lipoprotein koleszterin arányt és csökkenti a vérnyomást [ 163].
9. Következtetés
Érdekkonfliktus
A szerzők kijelentik, hogy a jelen cikk megjelenésével kapcsolatban nincs összeférhetetlenség.
- Ösztrogén, ösztrogén dominancia, súlygyarapodás és jódhiány; Miss Lizzy jód és pajzsmirigy
- Az elhízás csökkentésére tervezett elektronikus implantátum kipróbálandó - BBC News
- Körülmények; Elhízás és fogyás; NeuroSpa Agyfiatalító Központ
- Az elhízás széklettranszplantációival végzett első emberi kísérlet vegyes eredményeket hoz
- Első súlycsökkentő jabs; indulás a főutcán Borisz után; s Covid elhízás blitz