Rhizobiális szabad zsírsavak nagy áteresztőképességű ujjlenyomata kémiai vékonyréteg-leválasztással és mátrix-segített lézeres deszorpciós/ionizációs tömegspektrometriával
Alekszej Gladcsuk
1 Toxikológiai Intézet, Oroszország Szövetségi Orvosi-Biológiai Ügynöksége, 192019 Szentpétervár, Oroszország; moc.liamg@42dalgela (A.G.); ur.liam@tkelana (I.A.); [email protected] (E.P.)
Julia Shumilina
3 Bioorganikus Kémia Tanszék, Leibniz Növényi Biokémiai Intézet, 06120 Halle, Németország
Alena Kusnetsova
Ksenia Bureiko
3 Bioorganikus Kémia Tanszék, Leibniz Növényi Biokémiai Intézet, 06120 Halle, Németország
Susan Billig
4 Analitikai Kémiai Intézet, Kémiai és Ásványtani Kar, Universität Leipzig, 04103 Lipcse, Németország; ed.gizpiel-inu@gillib (S.B.); ed.gizpiel-inu.eimehc@reyemekrib (C.B.)
Alexander Tsarev
3 Bioorganikus Kémia Tanszék, Leibniz Növényi Biokémiai Intézet, 06120 Halle, Németország
Irina Alexandrova
1 Toxikológiai Intézet, Oroszország Szövetségi Orvosi-Biológiai Ügynöksége, 192019 Szentpétervár, Oroszország; moc.liamg@42dalgela (A.G.); ur.liam@tkelana (I.A.); [email protected] (E.P.)
Larisa Leonova
Vlagyimir A. Zsukov
5 Egész Oroszország Mezőgazdasági Mikrobiológiai Kutatóintézete, 196608 Szentpétervár, Oroszország; [email protected] (V.A.Z.); ur.xednay@8002mairra (I.A.T.)
Igor A. Tikhonovich
5 Egész Oroszország Mezőgazdasági Mikrobiológiai Kutatóintézete, 196608 Szentpétervár, Oroszország; [email protected] (V.A.Z.); ur.xednay@8002mairra (I.A.T.)
6 Szentpétervári Állami Egyetem Genetikai és Biotechnológiai Tanszék, 199034 Szentpétervár, Oroszország
Claudia Birkemeyer
4 Analitikai Kémiai Intézet, Kémiai és Ásványtani Kar, Universität Leipzig, 04103 Lipcse, Németország; ed.gizpiel-inu@gillib (S.B.); ed.gizpiel-inu.eimehc@reyemekrib (C.B.)
Jekatyerina Podolszkaja
1 Toxikológiai Intézet, Oroszország Szövetségi Orvosi-Biológiai Ügynöksége, 192019 Szentpétervár, Oroszország; moc.liamg@42dalgela (A.G.); ur.liam@tkelana (I.A.); [email protected] (E.P.)
7 Analitikai Műszerészeti Intézet, Orosz Tudományos Akadémia, 198095 Szentpétervár, Oroszország
Andrej Frolov
3 Bioorganikus Kémia Tanszék, Leibniz Növénybiokémiai Intézet, 06120 Halle, Németország
Társított adatok
Absztrakt
1. Bemutatkozás
A zsírsavak (FA) az élő szervezetek egyik legfontosabb metabolit osztályát képviselik [1]. Valójában egyrészt ezek a vegyületek könnyen részt vesznek számos enzimatikus reakcióban, így alifás, ciklikus és aromás alkoholok észtereit kapják, amelyek meghatározzák a membrán és a tároló lipidek szerkezetét [2]. Másrészt nem észterezett formában az FA-k a hormonok prekurzoraként és modulátorokként szolgálnak - a növényi [3] és az állati [4] szabályozási utak kulcsszereplői, akik részt vesznek minden létfontosságú fiziológiai reakcióban. Nem kevésbé fontos a szabad zsírsavak (FFA) szerepe alacsony molekulatömegű effektorként, amelyek közvetlenül részt vesznek az immunszervekben az élő szervezetek minden országában [4]. Ezért az FFA-k sok biológus és elemző különös figyelmét vonják magukra [5].
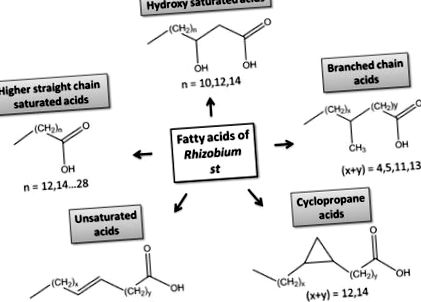
A bakteriális zsírsavak szerkezeti osztályai.
A modern bioanalitikai kémia során az FFA összetételének elemzése leggyakrabban gázkromatográfiára - tömegspektrometriára (GC-MS) támaszkodik [11]. Míg a rövid láncú illékony savak fejtér injekciós technikákkal [12] elemezhetők, addig a hosszú láncú savak megfelelő derivatizálás után folyékony injekcióval [13]. Ez utóbbi megközelítés a metil- vagy trimetil-szilil-észterek kimutatására támaszkodva hatékonynak bizonyult az elágazó zsírsavak elemzésében a baktériumok membránjában [14]. A derivatizációs eljárások végrehajtása a kísérleti munkafolyamatokban azonban drámai módon csökkenti a minta áteresztőképességét, és kiválthatja a lipidek átészterezését, valamint a telítetlen FFA-k izomerizációját és oxidációját [15, 16]. Bár hidrofil interakció [17] és fordított fázisú folyadékkromatográfia (HILIC és RP-LC) [18], on-line összekapcsolva az elektrospray ionizációs tömegspektrometriával (ESI-MS) vagy a tandem MS (MS/MS) többszörösével reakciófigyelő (MRM) mód [19] szintén alkalmazható az FFA-k számszerűsítéséhez, ezek a technikák nem rendelkeznek érzékenységgel vagy zsírsav-metabolom-lefedettséggel, összehasonlítva a hagyományos GC-MS-alapú munkafolyamatokkal [20].
Az FA elemzéséhez szükséges GC-MS- és LC-MS-alapú megközelítések ezen szűk keresztmetszetei hatékonyan kiküszöbölhetők a mátrix által támogatott lézeres deszorpciós/repülési tömegspektrometriás ionizációs idő (MALDI-TOF-MS) és Langmuir – Blodgett kombinációjával. technológia [21]. Nemrégiben kimutattuk, hogy a Langmuir – Blodgett filmek nemcsak a foszfopeptidek [22], a foszfororganikus vegyületek fehérje adduktjai [23] és a klórozott rovarirtók [24] szelektív dúsításában valósíthatók meg hatékonyan, hanem hatékony eszköznek bizonyultak a magas -a szabad zsírsavak áteresztőképessége és érzékeny ujjlenyomata, mint bárium-monokarboxilátok pozitív ion módban [25]. Ezért itt ezt a megközelítést alkalmazzuk egy újonnan kifejlesztett protokollban, amely a rizobiális baktériumok FFA-összetételének elemzésére szolgál, és javaslatot teszünk egy átfogó kvantitatív megoldásra az FFA-k tenyésztett sejtekben történő ujjlenyomatvételére MALDI-TOF-MS segítségével. Ezzel először bemutatjuk a Langmuir/MALDI-TOF-MS megközelítés alkalmazhatóságát a valódi biológiai kérdések megválaszolására.
2. Kísérleti tervezés
Bár a lágy reakció körülményei a Langmuir technológiát ígéretes eszközzé teszik a tömegspektrometriai elemzéshez szükséges minta előkészítésében, annak analitikai gyakorlatban történő megvalósításához azonban alapvető változásokra volt szükség az egyrétegű előkészítési stratégiában. Először, amint azt legutóbbi munkánkban [21] bemutattuk, a kationos komponenst kétértékű fémre, ideális esetben báriumra kell cserélni. Valójában ezek a kationok többnyire monokarboxilátokat képeznek, és nem tartalmaznak kevert sókat, vagyis hatékonyan ionizálható egyrétegeket eredményeznek. Az ilyen monokarboxilát monorétegek deszorbeálhatók egy hagyományos MALDI cél felületéről UV lézerrel, és ezért elemezhetők MALDI-TOF-MS műszerekkel. Az ionizációs hatékonyság tovább növelhető a vizes fázis hagyományos MALDI mátrixokkal történő kiegészítésével, amelyek helyettesített benzoesav- vagy fahéjsavakra épülnek, amelyek javítják a minta energiaeloszlását a lézeres lövés során [28]. Ebben az összefüggésben a 2,5-dihidroxi-benzoesav (DHB) a vízben való jó oldhatósága miatt a FA-k számára a legjobb választásnak bizonyult [25]. Az így kapott spektrumok jól értelmezhetők és felhasználhatók kvantitatív becslésekhez.
Sajnos a rövid láncú és telítetlen FA-k nem alkotnak szilárd egyrétegűeket; sóik a vizes fázis felszínén maradnak, amikor az ilyen egyrétegűek összeomlanak. Ezt és számos más korlátozást leküzdhetünk a Langmuir technológia átadásával a sík felépítésből (például Petri-csészében) egy csepp formátumba [25]. Ez lehetővé teszi monorétegek képződését közvetlenül a MALDI célponton a minta veszteségei nélkül. Másodszor, a cseppfelület domború alakja miatt a fémionok nagyobb koncentrációja érhető el az interfázisban. Ezáltal a minta fogyasztása meglehetősen alacsony (mintánként legfeljebb 1 µL). Végül az egyrétegű struktúra továbbra is szabályos marad, ami az elemzés nagy reprodukálhatóságát eredményezi. További kísérletek során a savas lánc hosszának összefüggésében foglalkoztunk a módszer korlátaival. Megállapítottuk, hogy a C6: 0 és C8: 0 savak nem detektálhatók ezzel a protokollal, míg a C10: 0 jel alacsonyabb intenzitást mutat a magasabb homológokhoz (C12: 0 és magasabb) képest.
A javasolt protokoll mögött álló átfogó kísérleti elrendezés számos fő lépést tartalmaz (2. ábra): a rizobia tenyésztése agaron és vizes tápközegben, a baktériumsejtek előtisztítása, a vizes szuszpenzió hexános extrakciója a baktérium pelletből, a minta felvitele a a MALDI cél, tömegspektrometriai elemzés, kvalitatív és kvantitatív elemzés és statisztikai értelmezés (utófeldolgozás).
- A cukorbetegség és az inzulin hatása a nem alkoholos zsírmáj betegségre a kórosan elhízott embereknél
- A Hale Yeah Meal Prep gyors, tápláló ételeket kínál Chattanooga Times Free Press
- Májbetegség, milyen étrend működik és miért olívaolaj - Fatty Liver Foundation
- A nem alkoholos zsírmájbetegség javulása bariatrikus műtét után kórosan elhízott kínaiaknál
- Kemény cukormentes cukorka