1 A széklet H-NMR vizsgálata: új lehetőségek a helminthes fertőzések kutatásában
Absztrakt
Háttér
A székletminták elemzése elengedhetetlen része a helminthes fertőzések rutin diagnosztikájának. A szokásos módszerek, mint például a Kato és a Kato-Katz, a rendelkezésre álló információknak csak a töredékét használják fel. Itt bemutatunk egy olyan mágneses rezonancia spektroszkópián (NMR) alapuló módszert, amely a minták komplex metabolikus profiljainak (vagy fenotípusainak) kiértékelésével segíthetné a standard eljárásokat.
Módszer
A mintákat 2015. június-július között gyűjtötték, a gyűjtés helyén -20 ° C-on lefagyasztották, és négy órán belül átadták -80 ° C-os állandó tárolás céljából. A széklet metabolitjait kb. 100 mg felolvasztott széklet anyag és 0,5 ml foszfát-puffer sóoldat keverésével keverjük ki, majd homogenizálási és centrifugálási lépéseket hajtunk végre. Az összes NMR-adatot 5 mm-es hármas rezonancia inverz kriopróbával és z-gradiens rendszerrel ellátott Bruker 600 MHz-es AVANCE II spektrométerrel rögzítettük.
Eredmények
Itt a székletminták NMR-alapú metabolikus profilozásához/fenotipizálásának optimalizált módszeréről számolunk be. Összességében 62 metabolitot jegyeztek fel a pool mintában a 2D NMR spektrumok és a Bruker Biorefcode adatbázis felhasználásával. A vegyületek a metabolómák széles körét lefedik, ideértve az aminosavakat és származékaikat, rövid láncú zsírsavakat (SCFA), karbonsavakat és származékaikat, aminokat, szénhidrátokat, purinokat, alkoholokat és másokat. A metabolikus profilok feltáró elemzése nem tár fel olyan erős tendenciákat, amelyek a betegek fertőzésének állapotához kapcsolódnának. A büntetett regresszió változó szelekciós módszerként való felhasználásával azonban sikerült tizenegy változó részhalmazát találnunk, amely lehetővé teszi a betegek megkülönböztetését a fertőzés állapota alapján.
Következtetések
A székletminták metabolikus profilálásának/fenotipizálásának egyszerű módszeréről beszámoltak és tesztelték egy kísérleti opisthorchiasis kohorton. Tudomásunk szerint ez az első jelentés egy NMR-alapú székletelemzésről a helmintikus fertőzések összefüggésében.
Háttér
Valójában a széklet tömegei a gyomor-bél traktus fiziológiai termékei, az emberi test egyik legfontosabb anyagcsererendszere. Így logikus feltételezni, hogy összetételüknek tükröznie kell az emésztőrendszer jelenlegi metabolikus állapotát vagy metabolikus fenotípusát [8]. Az emberi bél komplex ökoszisztémát képvisel, és bélbaktériumokat tartalmaz, amelyek meghaladják a szervezetünk sejtjeit [9], és a széklet tömegének vagy/és származékainak (pl. Kivonatok vagy ürülékvizek) elemzése a legközvetlenebb hozzáférést kínálja az élettani folyamatokhoz. gyomor-bél rendszer homeosztázisa, a bélbaktériumok és a gazda kölcsönhatásai, valamint a gazda és a parazita helmintézis közötti kölcsönhatás. Például a helmint fertőzéseket gyakran olyan tünetek kísérik, mint hasmenés, hasi fájdalom és vér a székletben. A megadott példák a szélsőséges eseteket mutatják be, de egyértelműen szemléltetik a parazita képességét, amely megváltoztatja a gazda metabolikus homeosztázisát és különösen a gazda emésztőrendszerét. Ez pedig a széklet tömegeinek metabolikus elemzését teszi érdekes, nem invazív módszerként az ilyen változások nyomon követésére.
Itt egy egyszerű NMR-alapú metabolomikai munkafolyamatot mutatunk be a székletminták elemzéséhez. Ehhez a kísérleti tanulmányhoz olyan betegek székletmintáit használtuk, akiknél opisthorchiasis diagnosztizáltak, és egy csoportba illesztett kontrollokat. Az opisthorchiasis parazita betegség, amelyet az Opisthorchiidae (Opisthorchis felineus, Opisthorchis viverrini) [10]. A WHO szerint körülbelül 17 millió fertőzött és körülbelül 112 millió ember van kitéve vagy fennáll a fertőzés kockázatának. Az itt bemutatott munkafolyamat csak az elvi bizonyíték, de könnyen skálázható, kvantitatív elemzésre hangolható és beépíthető más esettanulmányokba vagy a jövőbeni rutinszűrésekbe a mintagyűjtemény vagy a kilépő diagnosztikai rutin alapvető módosítása nélkül.
Mód
Minta kollekció
A tanulmányt a Szibériai Állami Orvostudományi Egyetem (Tomszk, Oroszország) helyi etikai bizottsága felülvizsgálta és jóváhagyta. A mintákat 2015. június és július között gyűjtötték. A mintákat a gyűjtés helyén -20 ° C-on lefagyasztották, és négy órán belül áthelyezték −80 ° C-os állandó tárolásra. Az opisthorchiasis diagnózisát Kato-Katz teszt igazolta [1]. Az 1. táblázat összefoglalja a betegek demográfiai adatait. Összesen 30 beteg (16 fertőzött és 14 nem fertőzött) mintáját használtuk fel.
A széklet metabolitjainak kivonása
A széklet metabolitjait máshol leírtak szerint extrahálták [11], némi kisebb módosítással. Röviden, körülbelül 100 mg felolvasztott széklet anyagának alikvot részeit összekevertük 0,5 ml foszfát-puffer sóoldattal (1,9 mM Na2HPO4, 8,1 mM NaH2PO4, 150 mM NaCl, pH 7,4; Sigma-Aldrich, Németország), amely 10% deuterált vizet (D2O 99,8%) tartalmazott. (Cortecnet, Franciaország) és 0,05 mM nátrium-3-trimetil-szilil-propionát-d 4 (TMSP-2,2,3,3-d 4; Cambridge Isotope Laboratories Inc., Egyesült Királyság) mint kémiai eltolódási referencia. Az elegyeket gyöngyveréssel 1 mm átmérőjű cirkónium-oxid gyöngyökkel 30 másodpercig, 4 ° C-on, Bullet Blender 24-ben (Next Advance Inc., USA) vertük fel. A széklet iszapját ezután 16100x-on centrifugáltukg 15 percig 4 ° C-on. A felülúszókat összegyűjtöttük, és a centrifugálást megismételtük. Végül a kapott ürülékkivonatokat 96 lyukú lemezre (Bruker, Németország) vittük át, és mindegyik mintából 190 μl-t egy 3 mm-es NMR-csőbe vittünk a SampleJet 96 csőtartóba (Bruker, Németország) 215 Gilson folyadékkezelő alkalmazásával. A mintákat ezután egy SampleJet rendszerbe helyeztük, és 6 ° C-on hűtöttük, miközben sorban álltunk az NMR-mérésekhez.
A széklet extrakciójának máshol leírt alternatív protokolljait [5, 12, 13] szintén alkalmazták műszaki másolatok, valamint a fent leírt berendezések és vegyszerek felhasználásával. A szűréshez Whatman szűrőket használtunk 0,2 μm átmérőjű pórusokkal (GE Healthcare, Egyesült Királyság). Szűréssel ultracentrifugálási lépést is teszteltünk Amicon Ultra cellulóz centrifugális szűrőkkel, 3000 Da határértékkel (Millipore Ireland, Ltd). A szűrőket használat előtt kétszer desztillált vízzel mostuk, és teszteltük a szennyeződéseket és az adalékanyagok jelenlétét vak PBS pufferminta és NMR-spektrumok felvétele alapján, ugyanazokkal a paraméterekkel, mint a székletkivonatok mérésére (lásd alább).
NMR spektroszkópia
Az összes NMR-adatot 5 mm-es hármas rezonancia inverz kriopróbával és z-gradiens rendszerrel ellátott Bruker 600 MHz-es AVANCE II spektrométerrel rögzítettük. A minták hőmérsékletét a mérés során 27 ° C-on szabályoztuk. Az adatgyűjtés előtt az egyes mintákhoz automatikusan elvégezték a szondafej hangolását és illesztését, majd fényesítést és protonimpulzus kalibrálást. Egydimenziós (1D) 1H-NMR-spektrumokat rögzítettünk a NOESY impulzusszekvencia első növelésével, előtelítettséggel (γB1 = 50 Hz) 4 másodperces relaxációs késleltetés és 10 ms keverési idő alatt a víz elnyomására [14, 15] 64 65 536 pontot vizsgáltunk, amelyek 12 335 Hz-t fedtek le, és a Fourier-transzformáció előtt 65 536 komplex pontig töltöttük nullát. exponenciális ablakfüggvényt alkalmaztunk 1,0 Hz vonalvastagsági tényezővel. A spektrumokat automatikusan fázisban és kiindulási helyzetben korrigáltuk, és a belső standardra (TMSP; δ 0,0 ppm).
A cső feltöltése után az egyes minták maradványaiból 30 μl-t egyesítettünk, hogy összegyűjtöttük a minta mintát. Az egyesített mintát alikvotizáltuk, és kétdimenziós (2D) NMR spektrumok megszerzésére használtuk fel, hogy elősegítsük a széklet metabolitjainak hozzárendelését. A 2D kísérletek halmaza tartalmazta a J-elhatározás (J-res), 1 H- 1 H korrelációs spektroszkópia (COZY), 1 H - 1 H teljes korrelációs spektroszkópia (TOCSY), 1 H - 13 C heteronukleáris egyszeri kvantum korreláció (HSQC) és 1 H - 13 C heteronukleáris többszörös kötés korrelációs spektroszkópia ( HMBC) a Topspin 3.0-ban (Bruker Biospin, Németország) bevezetett standard paraméterek alkalmazásával.
NMR adatfeldolgozás
Az NMR adatokat tovább dolgoztuk a Matlab 2014a (The Mathworks, Inc., USA) és a Python 2.7 (Python Software Foundation, www.python.org) munkáiban. Röviden, a kapott 1 H spektrumokat újra megvizsgáltuk a hibás alapvonalakra, és korrigáltuk az 5. fokú polinomiális illesztéssel. A 0,5–9,7 ppm spektrumtartományt az adaptív intelligens hegesztés házon belüli algoritmusával hígítottuk, amely a eredeti cikk De Meyer és mtsai. [16]. A kezdeti tálcaszélességet 0,02 ppm-re állítottuk be, és a végső változó tartályméretet a csúcsok helyzete és a spektrumok szélessége alapján számítottuk ki. A spektrum régiót a maradék vízcsúccsal (4,5 - 5,1 ppm) kizártuk az adatokból. A végső adatok 429 kukából álltak, amelyeket a valószínűségi Quotients Normalization módszerrel [17] normalizáltak, hogy korrigálják a mintadarabok közötti hígítási különbségeket. Az adatokat először egységnyi területre normalizáltuk, majd az egyes minták változóit elosztottuk egy referencia minta, ebben az esetben a medián spektrum értékével. Ezután az egyes mintákat a medián hányadosa alapján méreteztük, amely a legvalószínűbb hígítási tényezőt képviseli. Végül a normalizált adatokat a statisztikai elemzés előtt automatikusan skálázták.
Adatelemzés
Az összes elemzést az R statisztikai szoftverkörnyezetben (http://www.r-project.org/, R verzió 3.2.3.) Végeztük. A feltáró adatok elemzését a „pcaMethods” [18] csomag segítségével hajtották végre. A változó kiválasztást a „glmnet” csomaggal hajtottuk végre [19]. Az adatok megjelenítéséhez a „ggplot2”, „GGally” és „gridExtra” csomagokat használták.
Eredmények
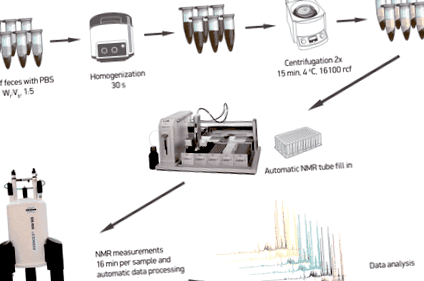
A minta előkészítésének optimalizálása
A minta előkészítés munkafolyamatának sematikus vázlata
A 2. ábra egy összesített minta 1H spektrumát mutatja be az azonosított metabolitok feljegyzésével. Összességében 62 metabolitot jegyeztek fel a pool mintában a 2D NMR spektrumok és a Bruker Biorefcode adatbázis (Bruker Biospin, Németország) felhasználásával. A kimutatott vegyületek a metabolitok széles skáláját fedik le, ideértve az aminosavakat és származékaikat, rövid láncú zsírsavakat (SCFA), karbonsavakat és származékaikat, aminokat, szénhidrátokat, purinokat, alkoholokat és másokat. A metabolitok teljes listáját a 2. ábra jelmagyarázata sorolja fel.
Az ebben a vizsgálatban használt összes székletkivonat medenceminta-keverékének 600 MHz-es 1D1H-NMR-spektrumának régiói. A tetején lévő régiók 16-szorosak a jobb megjelenítés érdekében. 60 széklet metabolitot azonosítottak, amelyek többségét annotálták a spektrumon. Metabolitok és számozásuk az ábrán látható módon: 1: 2-metilbutirát; 2: Valerát; 3: n-butirát; 4: Leucin; 5. izoleucin; 6: Valine; 7: Propionát; 8. izobutirát; 9: 3-metil-2-oxo-izovalerát; 10: 2-oxo-izovalerát; 11. etanol; 12: 3-hidroxi-butirát; 13. Treonin; 14: Laktát; 15: 2-hidroxi-izobutirát; 16: 3-hidroxi-2-butanon; 17: Alanin; 18: lizin; 19: timin; 20: acetát; 21: 5-amino-pentanoát; 22: ornitin; 23: Prolin; 24: Glutamát; 25. metionin; 26. Glutamin; 27: Szukcinát; 28: 2-oxoglutarát; 29: 3-fenil-propionát; 30: Aszpartát; 31. metil-amin; 32: Malát; 33. Trimetil-amin; 34: tirozin; 35: Malonát; 36: Kolin; 37: D-glükóz; 38: Taurin; 39: metanol; 40: glicin; 41: D-xilóz; 42: D-galaktóz; 43: Fruktóz; 44: dihidroxi-aceton; 45: Uracil; 46: Fumarát; 47: Urocanate; 48 .: Etanol-amin; 49: Xantin; 50: hipoxantin; 51: Nikotinát; 52: 3-hidroxi-fenil-acetát; 53: Triptofán; 54: fenilalanin; 55: Orotate; 56; UDP-glükuronát; 57: Formátum; 58: benzoát; 59: 4-aminohippurát; 60: Homovanillát; 61: Putrescine; 62: Aszparagin
Az adatok feltáró elemzése
A feltáró adatelemzés fő célja, hogy feltárja az adatok főbb tendenciáit, valamint az esetleges elemzési és/vagy biológiai zavarokat. Az ilyen elemzéshez általában a fő komponens elemzést (PCA) használják. A 3. ábra a PCA modell első három fő összetevőjének kombinált pontszámdiagramját mutatja. Az első három komponens csaknem 50% -át fedi le (
49) az adatok teljes szórása, de a fertőzés állapota nyilvánvalóan nem mutat látható tendenciát az adatokban. Mivel a kezdeti PCA-modell nem írt le semmilyen tendenciát a tanulmánytervhez kapcsolódó adatokban, kétosztályos részleges legkisebb négyzetek diszkrimináns elemzés (PLS-DA) modellt építettünk, amelynek fertőzési státusa osztályazonosító volt. A modell statisztikailag gyengének bizonyult, és az adatokat szűkebben írta le, mint egy véletlenszerűt (az adatokat nem mutatjuk be). Az eredményeket a fertőzés állapota és a széklet metabolikus összetétele közötti összefüggés hiányaként értelmezhetjük. A PLS-DA modell teljesítménye egyértelműen alátámasztja ezt az értelmezést. Adathalmazunk felépítése (30 megfigyelés és 429 változó) azonban olyan, hogy a prediktív változók száma (p) sokkal nagyobb, mint a minták száma (n). A PLS-DA módszer, annak ellenére, hogy az egyik legnépszerűbb osztályozási módszer a metabolomikai elemzésben, szuboptimális választás a p>> n adatsorok számára [20]. Ezért úgy döntöttünk, hogy alternatív adatelemzési stratégiát alkalmazunk, amely egy változó szelekciós lépést tartalmaz, amely meghatározhatja a prediktorok részhalmazát, amelyek relevánsak a vizsgálat tervezéséhez.
Az első három komponens PCA pontszám diagramjai
A kiválasztott részhalmaz változó kiválasztása és érvényesítése
Box-diagramok a lasszó regresszióval kiválasztott változókhoz. A változó hozzárendelések és a hozzájuk tartozó o-értékeket a 2. táblázat mutatja
Vita
Következtetések
Összefoglalva, a székletminták metabolikus profilozásának/fenotipizálásának egyszerű módszeréről számoltak be és tesztelték egy kísérleti opisthorchiasis kohorton. Tudomásunk szerint ez az első jelentés egy NMR-alapú székletelemzésről a helmintikus fertőzések összefüggésében. Ezzel a vizsgálattal megkísérelték kiterjeszteni a széklet analízisének hagyományos módját, és egy olyan további dimenziót adtak hozzá, amely felhasználható a betegek metabolikus fenotipizálására, a gazda-parazita kölcsönhatás mélyebb feltárására és metabolikus morbiditás vagy/és fertőzés felkutatására. markerek. Az NMR-alapú metabolikus profilalkotás kínálta lehetőségek kibővítéséhez és teljes kihasználásához sokkal nagyobb kohorszokra van szükség, mint amit ebben a tanulmányban alkalmaztunk, lehetőleg még a különböző endémiás területeken is összegyűjtve. Ezzel a jelentéssel azonban egy egyszerű koncepciót bizonyítunk, amelynek célja egy jól bevált technológia bevezetése a fertőző betegségek és a székletanyag-elemzés területén, és ezzel elindítja a jövőbeni ilyen irányú vizsgálatokat.
Rövidítések
1 H-1 H korrelációs spektroszkópia
Heteronukleáris többszörös kötés korrelációs spektroszkópia
- Az elemzés kevés bizonyítékot talál az étrendi beavatkozások alátámasztására az autizmus Spectrum Autism Research számára
- Az elemzés kevés bizonyítékot talál az étrendi beavatkozások alátámasztására az autizmus Spectrum Autism Research számára
- A rákmegelőzési ajánlásokról A World Cancer Research Fund International
- Absztrakt S2-2 Az elhízás és a betegségektől mentes túlélés többváltozós elemzése csomópontos betegeknél
- 3 étel a gombás fertőzések leküzdésében