A génexpresszió indukálható kontrollja destabilizált Cre-vel
Társított adatok
Absztrakt
Az agy gén- és fehérjefunkciójának akut manipulálása elengedhetetlen az idegrendszer fejlődésének, a plaszticitásnak és az információfeldolgozásnak a mechanizmusainak megértéséhez. Itt leírunk egy olyan destabilizált Cre rekombinázon (DD-Cre) alapuló technikát, amelynek aktivitását az antibiotikum, a TMP szabályozza. Megmutattuk, hogy a DD-Cre in vivo kiváltja az egér idegsejtjeiben a „lebegtetett” allélok gyors TMP-függő rekombinációját, és validálják ennek a rendszernek az alkalmazását a neurobehaviorális kutatásokban.
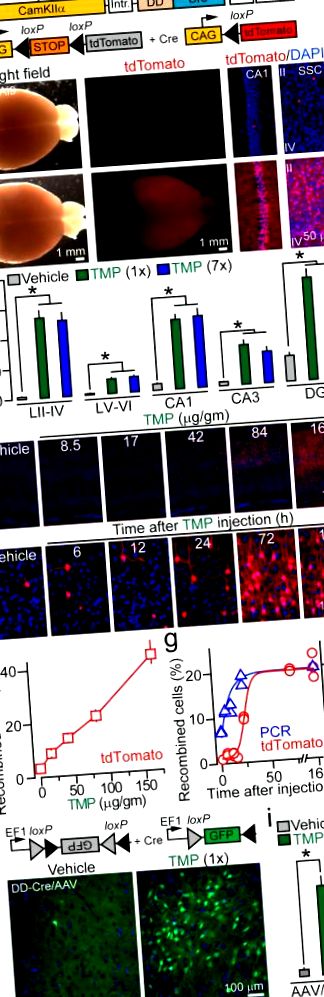
a, A CamKIIα: DD-Cre és R26 Ai9 Cre riporter allélok sematikus ábrázolása.
b, Képek a teljes agyakról és a DAPI-vel festett metszetekről, amelyeket vivőanyaggal és TMP-vel injektált DD-Cre/Ai9 mutánsokból izoláltak. SSC = szomato-szenzoros kéreg (II – IV. Réteg).
A gyógyszer beadását követően 24, illetve 48 órával (1e., G. Ábra). A tdTomato indukciójának ez a késése nem meglepő, mivel fehérjeszintézist igényel.
A Rosa26 lokusz relaxált kromatinszerkezettel rendelkezik, amely megkönnyíti Cre számára a hozzáférést (ez valószínűleg hozzájárul a megfigyelt háttérhez is), ezért megkérdeztük, hogy a DD-Cre képes-e más DNS-szubsztrátok rekombinációjára. Ennek érdekében egy „floxolt” GFP riportert (AAV2.5 DIO-GFP) kódoló adeno-asszociált vírusokat injektáltunk a DD-Cre egerek kérgeibe. A TMP ebben az esetben is potenciálisan kiváltotta a rekombinációt, a GFP-pozitív idegsejtek sűrűségének nyilvánvaló növekedése nélkül az ismétlődő gyógyszeres kezelések után (1h, i. Ábra és 1. kiegészítő táblázat). Megállapítottuk azt is, hogy a gyógyszer által közvetített, minimális háttérrel rendelkező rekombináció a vírustiterek beállításával érhető el (8. ábra).
A DD-Cre viselkedési vizsgálatokban való alkalmazhatóságának értékeléséhez létrehoztunk egy DD-Cre-t hordozó egér törzset és egy tetanusz toxin Cre indukálható formáját (TeNT), amely a vezikuláris SNARE fehérje VAMP/Syb2 (R26 floxstop) lehasításával gátolja a neurotranszmitter felszabadulását. -TeNT, 2a. Ábra) 18. A DD-Cre/TeNT-t és kontroll alomtársaikat TMP-vel kezeltük, és agyukat megvizsgáltuk TeNT, Syb2 és Zif268/Egr1 immunfestéssel, amely egy közvetlen korai gén terméke, amelynek transzkripcióját szinaptikus gerjesztés indukálja. A gyógyszerrel injektált állatok csökkent Zif268/Egr1 és Syb2 immunreaktivitással bírtak (2b – e. Ábra). Az immunblottozással kiderült, hogy a Syb2 hasadása elkezdődik
6 órával a gyógyszer beadása után, tükrözve a DN-Cre által közvetített TeNT akut indukcióját (2f., G. Ábra). Az agyszeletek elektrofiziológiai felvételei megerősítették a gerjesztő szinaptikus erő TMP-függő veszteségét DD-Cre/TeNT egerekben (2h. Ábra és 2. kiegészítő táblázat).
a, A CamKIIα: DD-Cre és R26 floxstop-TeNT allélok sematikus ábrázolása.
lenni, A jelzett genotípusú P30 egereket vivőanyaggal vagy TMP-vel (170 μg/gm) injektáltuk, és a kezelés után 7 nappal a Zif268/Egr1, a TeNT és a Syb2 immunfestésével elemeztük. b, A koronális agy metszeteinek tipikus képei a Zif268/Egr1 expresszió globális mintázatát mutatják. c – e, A Zif268/Egr1 és Syb2 immunreaktivitás elemzése az SSC-ben. A grafikonok a Zif268/Egr1 festés átlagos intenzitását mutatják neurononként (Vehicle versus TMP, P 3a ábra és 9. kiegészítő ábra és 3. kiegészítő táblázat). A TMP beadása DD-Cre/TeNT egereknek azonban eltörölte a felismerést és a térbeli memóriát, amit az új tárgyak iránti érdeklődés hiánya, a Barnes labirintus tesztben a célnégyzetek preferenciájának elvesztése és a megfordítás során elkövetett hibák megnövekedett gyakorisága bizonyít. teszt. Ezzel szemben ezek a memóriaformák épek voltak a vivőanyaggal injektált DD-Cre/TeNT és TeNT, valamint a TMP-vel kezelt TeNT törzsekben. (3b., C. Ábra és 9. ábra és 3. kiegészítő táblázat). Érdekes módon mind a négy állatcsoport normális asszociatív memóriával rendelkezett (az adatokat nem mutatjuk be). Ennélfogva sem a TMP önmagában, sem a DD-Cre/TeNT egerek agyában lévő konstitutív DD-Cre aktivitás nem befolyásolja a szabadtér viselkedését és a memória megszerzését/visszakeresését, míg a neurotranszmisszió indukálható blokádja megzavarja a specifikus kortikális és hippokampus-függő feladatokat.
A jelzett genotípusú egerek mozgásszervi aktivitását és memóriaszerzését/-keresését tesztelték. Az állatokat 48 órával a viselkedési vizsgálatok megkezdése előtt kezeltük hordozóval vagy TMP-vel (170 μg/gm).
a, A teljes vízszintes mozgásszervi aktivitást fotocella gerendákkal értékeltük 2 órán át, 5 perc időközönként.
b és c, Új tárgyfelismerés és térbeli memória tesztek. b, Az egyes egércsoportok által kezdeményezett érintkezések átlagos száma régi (O) és újszerű (N) tárgyakkal (O versus N: TeNT + jármű, P = 0,035; TeNT + TMP, P = 0,038; DD-Cre/TeNT + jármű, P = 0,007; DD-Cre/TeNT + TMP, P = 0,94). c, A Barnes labirintus szondatesztben a helyes cél (T) és más (O) kvadránsokban töltött idő átlagos százalékos aránya (DD-Cre/TeNT + TMP és DD-Cre/TeNT + jármű, P = 0,026; DD-Cre/TeNT + TMP és TeNT + TMP, P = 0,019; DD-Cre/TeNT + TMP és TeNT + jármű, P = 0,024; DD-Cre/TeNT + jármű és TeNT + TMP, P = 0,9; DD-Cre/TeNT + jármű szemben TeNT + jármű, P = 0,98; TeNT + TMP és TeNT + jármű, P = 0,92). Az összes mérést P60 állatokkal végeztük (n = 7–9 egér csoportonként), és átlag ± S.E.M-ként ábrázoltuk. További viselkedési adatokat lásd még a 9. ábra és a 3. táblázatban.
A gyors kinetika, a széles dinamikatartomány és a kimutatható TMP mellékhatások hiánya a DD-Cre rendszert vonzó eszközzé teszi a neurogenetikai alkalmazások széles spektrumában. A DD-Cre időbeli ellenőrzése in vivo gyorsabb, mint a Cre-ERT2 és a tTA/rtTA, amelyek általában ismétlődő expozíciót igényelnek a 3,7,8,19,20 indukáló gyógyszerekkel szemben. A DD-Cre erős TMP dózisfüggése ideális eszközzé teszi a kis sejtpopulációk egyidejű zavarását és jelölését a sejt-autonóm mechanizmusok tanulmányozásához. A többi kémiai-genetikai módszerhez hasonlóan a DD-Cre is konstitutív háttérrel rendelkezik. Bár elemzéseink nem mutatják az ilyen háttér viselkedési következményeit felnőtt DD-Cre/TeNT egerekben, és arra utalnak, hogy szigorú szabályozás érhető el sejtszinten in vitro és in vivo, a promóter erőssége, a DD-Cre expressziójának fejlődési profilja és annak érzékenysége az új egér törzsek tervezésénél figyelembe kell venni a downstream célpontokat.
Szélesebb körben tekintve eredményeink keretet adnak a destabilizált fehérjéket meghatározott szövetekben és sejttípusokban hordozó állatmodellek jövőbeni fejlesztéséhez. Például a DD-címkék transzkripciós faktorokhoz, membránreceptorokhoz és szignálmolekulákhoz való kötése lehetővé teheti a különböző fehérjefunkciók széleskörű ellenőrzését, és megkönnyítheti a sejtek differenciálódásának és anyagcseréjének kutatását. Ezenkívül ezek a címkék potenciálisan felhasználhatók más közös elemekkel, például az FLP-vel és a tTA/rtTA-val (kettős farmakológiai kontrollhoz) kombinálva. A DD-P.O.I. Ezért az új DD rendszereket mindig validálni kell a tenyésztett sejtekben, mielőtt elkövetnék az in vivo kísérleteket.
ONLINE MÓDSZEREK
Lentivírus transzfer vektorok és in vitro vizsgálatok
A DD-YFP, DD-Cre, Cre-ERT2, Cherry-H2B, GFP és floxstop-GFP kódoló szekvenciákat szintetikus neuronális Synapsin promotert tartalmazó lentivírus shuttle vektorokba szubklónoztuk. A KD + DD-Syb2 vektor H1 promóterből állt, amely hajtotta az egér Syb2 specifikus hajtűjét (GTGCAGCCAAGCTCAAGCG), majd a Synapsin promoter és a DD-Syb2 mentő cDNS szekvencia, amely nem kódoló mutációkat tartalmaz, amelyek letiltják az RNS interferenciát. A neuronkultúrák előállításának, a lentivírus termelésének és fertőzésének, az immunfestésnek, az immunblotolásnak és az elektrofiziológiának az előbbi módszereit 17,21 .
Konstitutív CamKIIα: Cre vezető vonalat, az R26 Ai9 Cre riportert és az R26 floxstop-TeNT allélt korábban 18, 22, 23 jellemezték. A CamKIIα: DD-Cre transzgén törzsek előállításához egy DD-Cre-t kódoló szekvenciát (2. kiegészítő ábra) illesztettünk be a 8 kb-os CamKIIα promotertől lefelé egy olyan célzási vektorba, amely tartalmazta a cDNS-t határoló 5 'és 3' intronokat és egy 3 'SV40 polyA jel. A célzó konstrukciót linearizáltuk, és a TSRI egérgenetikai magnál használtuk a pronukleáris mikroinjekcióhoz. A pozitív alapítókat PCR-rel azonosítottuk a következő primer párokkal: GGCAATTGAGATCTACCATGATCTCTCTGATTGCCG CGCCGCTAGCTAATCGCCATCTTCCAGCAG; (1,3 kb termék specifikus a DHFR-Cre-re) és a CTCCGTTTGCACTCAGGAGCAC/GCGCGGCGCGCCTCTCCTTTCCAGGATCTCAAAG (0,9 kb méretű termék specifikus CamKIIa promoterre és ecDHFR-re). Az alapítókat ezután Ai9 vagy R26 floxstop-TeNT alléleket hordozó egerekkel párosítottuk (vegyes C57/Bl6 és 129/sv háttér), utódaikat genotipizálva kísérletekhez használtuk.
In vivo gyógyszer injekció
A trimetoprimot (Sigma, T7883) DMSO-ban oldjuk 100 mg/ml telített koncentrációban. Ezt az oldatot minden kísérlethez frissen készítettük, és közvetlenül az injekciók beadása előtt 0,9% -os sóoldattal hígítottuk. Az intra-peritonealis (i.p.) injekciókat egy 29 g-os tűvel hajtottuk végre, hogy 8 és 170 μg/g testtömeg közötti TMP-dózist juttassunk be. Kontrollként sóoldatot és DMSO-t tartalmazó vivőoldatot használtunk. A TMP farmakokinetikáját vad típusú C57/BL6 egerekben vizsgálták a baktériumok növekedésének gátlásán alapuló in vitro biológiai vizsgálattal. Az agykivonatokban a TMP elérte a maximális koncentrációt, 1 μg/ml-t egyetlen perc után (50 μg/gm). A maximális napi TMP-dózis nem haladta meg a 170 μg/gm-t, hogy elkerülje a gyógyszer lehetséges szorongását és kicsapódását. A mutáns állatokat a gyógyszeres kezelést követően különböző időpontokban elemeztük, amint azt az ábrák magyarázata mutatja. A tamoxifent kukoricaolajban oldjuk (10 mg/ml), és 100 μg/testtömeg-gammal injektáljuk.
In vivo vírusinjekció
Koncentrált lentivírusokat házban állítottak elő. Az AAV2.5 DIO-GFP-t a Salk vektormagban állítottuk elő, egy 1,26 kb-s EF1a-promóterből és egy inverz GFP-szekvenciából álló transzfervektort használva, amelyet két pár loxP-hely szegélyezett. A vírustitereket PCR-rel határoztuk meg. Az újszülött kölyköket jégen érzéstelenítettük, és egy üveg mikropipetta (10 μm hegyátmérő) segítségével 0,5 μl vírusállományt injektáltunk hozzájuk. A kölyköket ezután 1-2 percig izzólámpa alatt melegítették, és a kísérletekig visszatették háziketreceikbe.
Immunhisztokémia
Az egereket izofluoránnal altattuk és 4% PFA-val perfundáltuk. Az agyakat egy éjszakán át 0,5% PFA-ban inkubáltuk, és vibrációs szekvenciával PBS-ben szeleteltük. A 90 μm vastag agyi szakaszokat rövid ideig 0,1 M citrátoldatban forraljuk az antigén visszaszerzéséhez, majd 5 percig citrátpufferbe helyezzük (40,5 ml 0,1 M nátrium-citrát, 9,5 ml 0,1 M citromsav, pH 6,0). A metszeteket ezután PBS-ben mostuk, 3 órán át blokkoltuk 4% BSA-ban, 2% lószérumban, 0,5% Tritonban és egy éjszakán át inkubáltuk blokkoló oldatban hígított primer antitestekkel, majd PBS-ben mostuk és DAPI-vel inkubáltuk és/vagy megfelelő fluoreszcensen inkubáltuk. jelzett másodlagos antitestek.
Antitestek
A monoklonális anti-Syb2 (Cl69.1) és a poliklonális anti-Syt1 antitestek Dr. Thomas Südhof kedves ajándékai voltak. Anti-β-tubulin, anti-Zif268/Egr1 és anti-SPO antitesteket a Sigma (Cat # T2200), a Cell Signaling Technologies (Cat # 4153S) és a Synaptic Systems (Cat # 102-002) cégektől vásároltunk. Az összes antitestet 1: 1000 arányú hígításban használtuk az immunblotoláshoz és az immunhisztokémiához.
In situ hibridizáció
A DD-Cre és a tdTomato transzkriptumok próbáit a Roche RNS jelölőkészlet segítségével szintetizáltuk, elektroforézissel és szekvenálással validáltuk, és FITC-vel vagy DIG-kel jelöltük. Az agyszelvényeket a fent leírtak szerint készítettük el, és acetilezettük trietanol-amint és ecetsavanhidridet tartalmazó pufferben. Ezután a metszeteket 65 ° C-on előzetesen hibridizáltuk 50% formamidot, 5x sóoldat-nátrium-citrátot, 5X Denhardtot, 250 μg/ml élesztő tRNS-t, 500 μg/ml hering spermium DNS-t, 50 μg/ml heparint, 2,5 mM tartalmazó pufferben. EDTA, 0,1% Tween-20, 0,25% CHAPS, majd egy éjszakán át inkubálás hődenaturált próbákkal ugyanabban a pufferben hígítva. A jelzett részeket 0,2x SSC-ben mostuk, 100 mM Tris-HCl-ban (pH 7,5) és 150 mM NaCl-ban kiegyensúlyoztuk, és 0,5% -os Perkin-Elmer blokkoló reagenssel blokkoltuk TN pufferben. A metszeteket ezután 0,05% Tween20-ban mostuk, majd tiramid amplifikációt (Perkin-Elmer TSA Plus rendszer), majd szekvenciális kezeléseket anti-FITC-POD és FITC-Tyramiddal. A peroxidáz aktivitás 3% -os hidrogén-peroxiddal történő leállítása után a metszeteket anti-DIG-POD-val (1: 500) kezeltük, mostuk és elemzés céljából felszereltük.
Képszerzés és adatelemzés
A képeket a Nikon C2 konfokális mikroszkóp alatt gyűjtöttük 10 ×, 20 × és 60 × olajmerítési célok felhasználásával. A digitális képeket kezdetben a Nikon Elements szoftvercsomaggal dolgozták fel. A digitális manipulációkat minden pixelre egyformán alkalmazták. A riporter-pozitív idegsejtek sűrűségét a Metamorph szoftver segítségével automatikusan kiszámoltuk. A 7. ábrán bemutatott GC háromdimenziós rekonstrukcióit a Neurolucida csomaggal hajtottuk végre.
Genom DNS-t izoláltunk a DD-Cre/TeNT egerek kérgeiből a TMP injekció beadása után különböző időpontokban, és PCR-rel elemeztük a rekombinált allélra specifikus következő primerpárokkal:.
Elektrofiziológia
Az érzéstelenített egereket oxigénnel telített Ca 2+ mentes aCSF-oldatba dekapitáltuk, amely 124 mM NaCl, 2 mM KCl, 1,25 mM KH2PO4, 2 mM MgS04, 26 mM NaHCO3, 10 mM dextróz, pH 7,4 volt. 400 μm-es agymetszéseket készítettünk vibratómával. A szeleteket 2 mM Ca 2+ -ot tartalmazó aCSF-be vittük át, és a felvételek előtt 1 órán át 30 ° C-on hagytuk helyreállni. A gerjesztő mező potenciálját DG granulátum cellákból 2M NaCl-dal (
3MΩ). A szinaptikus válaszokat extracelluláris elektród (Concentric bipolar electrode, FHC) váltotta ki perforáns út közelében, és 20 μm Gabazine jelenlétében rögzítettük. Az adatokat Multiclamp700B erősítővel vettük mintába, és offline módon elemeztük a Clampfit10 és az Origin8 szoftvercsomagokkal.
- A súlykontroll második természetessé tétele, vékony természetes életmód
- Lelinta - Kompressziós tartályos nők hasüreg-vezérlő Cami Shaper karcsúsító kamzsi alakformáló felsőkkel
- Leptin génterápia; jobb lehet, mint a fogyókúra; fogyáshoz
- Hely a palacsintának az étrendben - Kalóriaszabályozó Tanács
- Leipurin súlykontroll kenyér - Használt betűtípusok