A markáns fogyás hatása az adiponektin gén expressziójára és a plazma koncentrációira
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozás Központ, Washington Egyetem Orvostudományi Kar, 660 South Euclid Avenue, Campus Box 8031, St. Louis, MO 63110. E-mail: [email protected] További szerzői cikkek keresése
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozási Központ, Washington Egyetem Orvostudományi Kar, St. Louis, Missouri.
Emberi Táplálkozás Központ, Washington Egyetem Orvostudományi Kar, 660 South Euclid Avenue, Campus Box 8031, St. Louis, MO 63110. E-mail: [email protected] További szerzői cikkek keresése
Absztrakt
Célkitűzés: Az adiponektin a leggyakoribb fehérje, amelyet a zsírszövet választ ki, és fordítottan összefügg az adipozitással és az inzulinrezisztenciával. A tanulmány célja annak a hipotézisnek az értékelése volt, hogy a gyomor bypass műtét (GBS) által kiváltott jelentős súlycsökkenés növeli az adiponektin gén expressziót mind a felső, mind az alsó szubkután testzsírban, és növeli a plazma adiponektin koncentrációt.
Kutatási módszerek és eljárások: Az adiponektin szubkután hasi és femorális zsírszövet gén expresszióját, amelyet kvantitatív reverz transzkriptáz-polimeráz láncreakcióval határoztak meg, és az enzimhez kapcsolt immunszorbens assay alkalmazásával meghatározott adiponektin plazmakoncentrációt hat rendkívül elhízott nőnél értékelték (BMI = 57,1 ± 4,1 kg/m 2) GBS előtt és után 1 évvel.
Eredmények: A GBS után az alanyok elvesztették kezdeti testsúlyuk 36 ± 5% -át, és fokozott inzulinérzékenységet mutattak, ami az inzulinrezisztencia homeosztázis-modelljének értékelésének 10,7 ± 4,1-ről 1,4 ± 0,3-ra történő szignifikáns csökkenésével járto
Bevezetés
Az adiponektin a leggyakoribb szekréciós fehérje, amelyet a zsírszövet termel, és fontos élettani hatása számos szervrendszerre. Az adiponektin növeli a máj inzulinérzékenységét, csökkenti a máj glükóztermelését ((1)), és növeli a vázizom glükózját és a zsírsav oxidációját ((2), (3), (4)). A plazma adiponektin koncentrációja fordítottan összefügg az elhízással ((5), (6)), az inzulinrezisztenciával ((3), (7)), a 2-es típusú cukorbetegséggel ((7), (8), (9)), a metabolikus szindrómával ((10), (11)) és a koszorúér-betegség ((8), (12), (13)). Feltehetően a zsírszövet adiponektin termelése az elsődleges meghatározója a plazma adiponektin koncentrációinak, és azoknak a betegeknek, akiknek alacsony a zsírszövet adiponektin gén expressziója, alacsony a plazma adiponektin koncentrációja ((14)).
A súlycsökkenés hatása az adiponektin transzkripciójára és a plazmakoncentrációra nem egyértelmű, a különböző vizsgálatok ellentmondó eredményei miatt. Az étrend által kiváltott súlycsökkenést tartalmazó vizsgálatok adatai azt mutatták, hogy az adiponektin plazmakoncentrációja csökkent ((15)), emelkedett ((8), (16), (17)) vagy nem változott ((11), (18), (19), (20)), míg a zsírszövet gén expressziója vagy megnőtt ((16)), vagy nem változott ((19), (21), (22)). A bariatrikus műtétek által kiváltott súlycsökkenéssel kapcsolatos vizsgálatok adatai azt mutatták, hogy az adiponektin plazmakoncentrációja emelkedett ((23), (24), (25), (26), (27), (28), (29)), vagy nem változás ((30)); Ez utóbbi vizsgálatok egyike sem vizsgálta a zsírszövet adiponektin gén expresszióját. A vizsgálatok közötti eredménykülönbségeket a fogyás súlyának különbségei okozhatják a vizsgálat résztvevői között; lehetséges, hogy jelentős súlycsökkenésre van szükség a zsírszövet adiponektin termelésében bekövetkező változások stimulálásához.
A tanulmány célja a gyomor bypass műtét (GBS) által kiváltott jelentős súlyvesztés hatásának értékelése volt, 1 1 Nem szabványos rövidítések: GBS, gyomor bypass műtét; GCRC, Általános Klinikai Kutatóközpont; SAT, szubkután hasi zsírszövet; SFT, szubkután femoralis zsírszövet; HOMA ‐ IR, az inzulinrezisztencia homeosztázis modelljének értékelése.
az adiponektin szubkután hasi és femorális zsírszövet gén expressziójáról és plazmakoncentrációiról. Feltételeztük, hogy a jelentős súlycsökkenés egyidejűleg növeli az adiponectin gén expresszióját mind a felső, mind az alsó test zsírraktáraiban, és megnöveli a plazmakoncentrációt.
Kutatási módszerek és eljárások
Tanulmányi tárgyak
Hat rendkívül elhízott nőt (életkora, 41,2 ± 3,9 év) vontak be ebbe a vizsgálatba, akiket a Barnes-Zsidó Kórházban GBS-re terveztek (1. táblázat). A műtét előtt minden alany elvégezte az orvosi értékelést, beleértve az anamnézist és a fizikális vizsgálatot, a rutinos vérvizsgálatokat és a 2 órás orális glükóz tolerancia tesztet. Az egyik alany újonnan diagnosztizálták 2-es típusú cukorbetegségét az orvosi értékelés befejezése után, de a műtét előtt vagy után nem kapott orvosi kezelést cukorbetegségben. Minden alany írásos beleegyezését adta, mielőtt részt vett ebben a tanulmányban, amelyet a St. Louis-i Washingtoni Egyetem Orvostudományi Karának Humántudományi Bizottsága és az Általános Klinikai Kutatóközpont (GCRC) tudományos tanácsadó bizottsága jóváhagyott.
| Súly (kg) | 152,6 ± 9,0 | 98,3 ± 9,8 * |
| BMI (kg/m²) | 57,1 ± 4,1 | 36,9 ± 4,3 * |
| Glükóz (mg/dl) | 115,5 ± 13,7 | 84,7 ± 3,3 |
| Inzulin (μU/ml) | 32,7 ± 8,3 | 6,6 ± 1,5 † |
| HOMA ‐ IR | 10,7 ± 4,1 | 1,4 ± 0,3 † |
- GBS, gyomor bypass műtét; HOMA ‐ IR, az inzulinrezisztencia homeosztázis modelljének értékelése.
- Az érték jelentősen eltér a Before GBS értékétől;
- * o † o
Kísérleti protokoll
Az alanyokat a mintavétel előtti esténként vették fel a GCRC-be, és 19: 00-kor szokásos étkezést fogyasztottak, amely ~ 6 kcal/testtömeg-kg volt, amely az összes energia 55% -át tartalmazta szénhidrátként, 30% -ot zsírként és 15% -ot. % fehérjeként. Másnap reggel, miután az alanyok egy éjszakán át (12 órán keresztül) böjtöltek, vérmintákat vettünk a plazma adiponektin-, glükóz- és inzulinkoncentrációk meghatározására. A vért EDTA-t tartalmazó hűtött csövekbe gyűjtötték az adiponektin-koncentráció meghatározása céljából, valamint az EDTA-t és aprotinint tartalmazó hűtőcsövekbe (Trasylol; Bayer Pharmaceuticals Corp., West Haven, CT) az inzulin-koncentrációk meghatározása céljából. A vérmintákat azonnal jégre helyezték és a begyűjtéstől számított 30 percen belül centrifugálták a plazma elválasztására. A plazmamintákat az elemzés elvégzéséig -78 ° C-on tároltuk. A plazma glükózkoncentrációjának meghatározásához kapott vért azonnal centrifugáltuk és automatizált glükózanalizátorral elemeztük.
A vérmintagyűjtést követően a szubkután hasi zsírszövetből (SAT) és a szubkután combcsont zsírszövetből (SFT) származó biopsziákat nyertük. A biopsziás helyeket előkészítettük és lefedtük, és steril körülmények között zsírszövetet kaptunk. Miután a bőrt és a szubkután zsírt lidokainnal elaltatták, a zsírszövetet a periumbilicalis és a femorális területekről szívták fel egy 14 ml-es tűvel, 5 ml-es fecskendőhöz csatlakoztatva. Körülbelül 2 gramm zsírszövetet szívtunk le, azonnal öblítettünk sóoldattal és folyékony nitrogénben fagyasztottuk le, mielőtt -78 ° C-on tároltuk.
Három alany nyitott, három alany laparoszkópos Roux ‐ en ‐ Y GBS-n esett át. Egy kicsi (~ 20 ml) proximális gyomortáskát állítottak össze a gyomorba tűzéssel. A Roux végtagot úgy alakítottuk ki, hogy a jejunumot 30 cm-re disztálisan transzformáltuk Treitz szalagjához; egy 75 cm-es végtagot készítettek azoknak az alanyoknak, akiknek BMI 2-e volt, és 150 cm-es végtagot készítettek azoknak, akiknek BMI-értéke ≥50,0 kg/m 2 volt. Az összes eljárást ugyanaz a sebész (J. C. E.) végezte.
Egy évvel a GBS után minden alanyot visszavittek a GCRC-be, ahol vérmintákat, SAT-t és SFT-t nyertek a fent leírt eljárásokkal.
Minta elemzések
Vérminták
A plazma adiponektin-koncentrációkat humán adiponektin enzimmel kapcsolt immunszorbens vizsgálati rendszer (ALPCO Diagnostics, Salem, NH) alkalmazásával határoztuk meg. Az inter-assay és az intra-assay variációs koefficiensek az adiponektin méréseknél 6,7%, illetve 7,7% voltak. A plazma inzulin koncentrációit radioimmun vizsgálattal határoztuk meg. A plazma glükózkoncentrációkat automatizált glükóz-analizátorral (Yellow Springs Instruments, Yellow Springs, OH) határoztuk meg.
Zsírszövetminták
A teljes RNS-t a zsírszövetből izoláltuk a TRI-REAGENT protokoll (Sigma Chemical Co., St. Louis, MO) alkalmazásával, további centrifugálási lépéssel a trigliceridfelesleg eltávolítására a gyártó utasításainak megfelelően. Az RNS-koncentrációt két hígítás spektrofotometrikus abszorbanciájával határoztuk meg.
Az első szálú cDNS-t reverz transzkripcióval állítottuk elő 500 ng teljes RNS és az Applied Biosystems (Foster City, Kalifornia) reverz transzkripciós készlet felhasználásával. A valós idejű polimeráz láncreakciót az ABI PRISM 7500 szekvencia detektáló rendszer és a PowerSYBR keverék (Applied Biosystems) segítségével hajtottuk végre. Az adiponektin mRNS tetszőleges egységeit 36B4 RNS-tartalomra korrigáltuk a terhelés ellenőrzése érdekében. A következő primer készleteket alkalmaztuk: adiponektin [előre: TCTGTTTCCCACCTCACCTGA; hátra: CAGGACGTCATCATAGAACCACTT ((31))] és 36B4 [előre: GCAGACAACGTGGGCTCCAAGCAGAT; fordított: GGTCCTCCTTGGTGAACACGAAGCCC ((32))].
Számítások
Az inzulinrezisztenciát a homeosztázis modell kiértékelésével számoltuk ki [HOMA ‐ IR = éhomi inzulin (μU/ml) × éhomi glükóz (mM)/22,5] ((33), (34)).
Statisztikai elemzések
Diákok t párosított minták tesztjét alkalmaztuk az értékkülönbség statisztikai szignifikanciájának értékelésére a GBS előtt és után 1 évvel. Minden tanuló t tesztek kétfarkúak voltak, kivéve a HOMA-IR kiértékelését, amelyhez egyfarkú tesztet alkalmaztak, a GBS által kiváltott fogyás után az inzulinrezisztencia ismert csökkenése miatt ((23), (26)). A o a ≤0,05 értéket statisztikailag szignifikánsnak tekintettük. Az adatok átlag ± standard hiba formájában kerülnek bemutatásra.
Eredmények
Testtömeg és anyagcsere paraméterek
A GBS után egy évvel az alanyok testsúlya 36 ± 5% -kal csökkent; az átlagos fogyás 54,3 ± 9,1 kg volt (o
Adiponektin-paraméterek
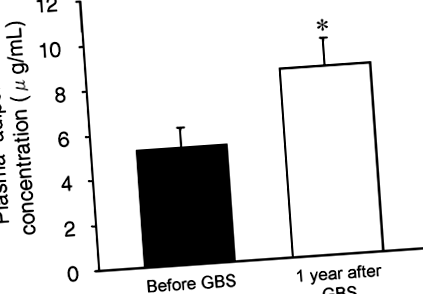
A bariatrikus műtétek által kiváltott súlycsökkenés az átlagos plazma adiponektin koncentráció 77 ± 31% -os növekedését okozta (5,2 ± 0,9-ről 8,4 ± 1,2 μg/ml-re; o
Plazma adiponektin-koncentráció a GBS előtt és után 1 évvel. Az érték jelentősen eltér a Before GBS értékétől; *o
Az adiponektin gén expressziója a szubkután hasi zsírszövetben (SAT) (felső panel) és a szubkután combcsont zsírszövetben (SFT) (alsó panel) a GBS előtt és után 1 évvel. Az érték jelentősen eltér a Before GBS értékétől; *o
Vita
Az adiponektin a leggyakoribb zsírszöveti szekréciós fehérje, és fontos szabályozó hatása van az inzulin működésére, valamint a glükóz és zsírsav anyagcserére. E tanulmány eredményei azt mutatták, hogy a bariatrikus műtét által kiváltott jelentős súlycsökkenés növeli a zsírszövet adiponektin gén expresszióját és a plazma adiponektin koncentrációját. Sőt, a szubkután zsírszövet-adiponektin gén expressziója egyidejűleg nőtt a hasi és a comb zsírraktáraiban. Ezek az eredmények arra utalnak, hogy a súlyosan elhízott alanyok súlyvesztése általános reakciót vált ki a szubkután zsírszövetben, ami fokozott adiponektin termelést és plazmakoncentrációt eredményez. Ezért valószínű, hogy a súlyvesztés által kiváltott anyagcsere-változások a zsírszövetben maga is hozzájárulnak a fogyáskor bekövetkező inzulinérzékenység növekedéséhez.
A zsírszövet adiponektin termelésének súlycsökkenés okozta pontos mechanizmusa (i) nem ismertek. Azonban a zsírszövet által termelt gyulladásos citokinek részt vehetnek az adipocita adiponektin termelésének szabályozásában autokrin, parakrin és szisztémás utakon. A szubkután hasi zsírszövet inkubálása az interleukin-6-tal és annak oldható receptorával ((16) vagy a tumor nekrózis-faktor α ((16), (35)) elnyomja az adiponektin gén expresszióját. Bár vizsgálatunk során nem értékeltük a plazma citokineket, más kutatók kimutatták, hogy a súlycsökkenés csökkentheti a plazma interleukin ‐ 6 ((16), (26) és a tumor nekrózis faktor α ((36), (37)) koncentrációját. Ezenkívül az androgének csökkentik a plazma adiponektin-koncentrációt ((38), (39)), a súlycsökkenés pedig a keringő androgének ((40)) csökkenését eredményezi. Ezért lehetséges, hogy az adipokin és az androgén metabolizmusának változásai hozzájárultak az adiponektin expresszió növekedéséhez, amelyet a GBS után észleltünk.
Kevés tanulmány értékelte az adiponektin gén expressziójának homogenitását a zsírszövet depóiban, és ezeknek a vizsgálatoknak az eredményei nem következetesek. Egy tanulmányban az adiponektin expressziója a zsigeri, mint a szubkután zsírban volt nagyobb a túlsúlyos egyéneknél ((14)), míg más vizsgálatokban az adiponektin expresszió ugyanolyan volt a zsigeri és a szubkután zsírban elhízott egyéneknél ((41), (42), (43)). Nincs tudomásunk olyan vizsgálatról, amely a súlycsökkenés adiponektin expresszióra gyakorolt hatását értékelte volna a különböző szubkután zsírraktárakban. Megállapítottuk, hogy mind a bazális adiponektin expresszió, mind a súlyvesztés által kiváltott adiponectin expresszió felfelé történő szabályozása hasonló volt a szubkután felső és alsó test zsírraktáraiban. Ezért az adiponektin gén expresszióját és feltehetően az adiponektin termelését szabályozó tényezők az egész testben befolyásolják a szubkután zsírt.
A testsúlycsökkenés a betegek teljes plazma adiponektin-koncentrációjának ~ 75% -os növekedését eredményezte. A keringő adiponektin változása az inzulinrezisztencia markáns csökkenésével járt, ami a HOMA ‐ IR értékek ~ 75% -os csökkenésével járt. Az adiponektin növeli a máj inzulinérzékenységét, csökkenti a máj glükóztermelését és növeli a vázizmok glükózoxidációját ((1), (2), (3), (4)). Vizsgálatunkból azonban nem határozható meg az adiponektin-koncentráció növekedésének relatív jelentősége az inzulinérzékenység javításában. Korábbi vizsgálatok adatai azt mutatták, hogy a mérsékelt súlyvesztés (a testtömeg 7–8% -a) javította az inzulinérzékenységet, a HOMA ‐ IR segítségével értékelve, anélkül, hogy a plazma adiponektin koncentrációja megemelkedett volna ((19), (20)). Ezért az adiponektin-koncentráció változásai nem kizárólag felelősek a fogyás okozta inzulinhatás javulásáért.
Összefoglalva: a GBS által kiváltott súlyvesztés a rendkívül elhízott nőknél jelentősen megnöveli az adiponektin szubkután zsírszövet gén expresszióját és a plazmakoncentrációt. A keringő adiponektin növekedése valószínűleg hozzájárul a GBS után megfigyelt inzulinérzékenység javulásához. További vizsgálatokra van szükség azonban a plazma adiponektin-koncentráció változásainak súlycsökkenéstől független jótékony hatásának az inzulinhatásra és a sejtszintű mechanizmus (ok) ra, amelyek felelősek a fogyás okozta adiponektin-termelés növekedéséért.
Köszönetnyilvánítás
A szerzők köszönetet mondanak Jennifer McCreanek és Michele Croce-nak a technikai segítségért. Ezt a vizsgálatot az NIH Grants DK37948, RR00036 (Általános Klinikai Kutatóközpont) és DK56341 (Klinikai Táplálkozási Kutatóegység) támogatta.
- A jelentős súlyvesztés hatása az adiponektin gén expressziójára és a plazma koncentrációira - PubMed
- Határok Adiponectin, Leptin és Visfatin hipoxiában és hatása az elhízás fogyására
- Az étrend okozta elhízás és fogyás megváltoztatja az epesav-koncentrációt és az epesav-érzékeny gént
- Az étrend megválasztásának engedélyezése a fogyásra A belgyógyászat véletlenszerű vizsgálati évkönyvei Vol
- Az L-karnitin hatása a hipokalor táplálékkal etetett patkányok fogyására és testösszetételére - PubMed