Máj ketogenezis, amelyet egerek középső agyi artériájának elzáródása vált ki
Farmakológiai Tanszék, FB 14, Goethe Egyetem, Frankfurt, Németország
Farmakológiai Tanszék, FB 14, Goethe Egyetem, Frankfurt, Németország
Farmakológiai Tanszék, FB 14, Goethe Egyetem, Frankfurt, Németország
Farmakológiai Tanszék, FB 14, Goethe Egyetem, Frankfurt, Németország
Farmakológiai Tanszék, FB 14, Goethe Egyetem, Frankfurt, Németország
Farmakológiai Tanszék, FB 14, Goethe Egyetem, Frankfurt, Németország
Absztrakt
Háttér
A keton testekről ismert, hogy a glükózt mint agyi üzemanyagot helyettesítik, ha a glükóz rendelkezésre állása alacsony. A ketogén étrendeket neuroprotektívnek írták le. Hasonló adatokról számoltak be a triheptanoinról, egy zsíros olajról és anaplerotikus vegyületről. Ebben a tanulmányban az energia metabolitjainak változását figyeltük meg a májban, a vérben és az agyban átmeneti agyi ischaemia után, hogy teszteljük a kísérleti stroke által kiváltott keton testképződést.
Módszerek és eredmények
Az egereket szokásos szénhidrátban gazdag táplálékkal vagy 2 zsírban gazdag étrendet etették, egyet triheptanoinnal és 1 szójaolajban dúsítva. A stroke-ot egerekben középső agyi artéria elzáródása indukálta 90 percen keresztül, majd reperfúziót. Az egereket feláldoztuk, és vérplazmát, valamint máj- és agyhomogenátumokat kaptunk. 1 kísérletben mikrodialízist hajtottak végre. A metabolitokat (pl. Glükóz, β-hidroxi-butirát, citrát, szukcinát) gázkromatográfia – tömegspektrometriával határoztuk meg. 90 perces agyi ischaemia után a β-hidroxi-butirát szintje drámai módon megemelkedett a májban, a vérben és az agy mikrodializátumában és az agy homogenátumában, de csak zsírban gazdag étrenddel táplált egerekben. A vér és az agy glükózszintje ellentétes módon változott. A reperfúzió 60 perc alatt csökkentette a β-hidroxi-butirátot és növelte a glükózszintet. A stroke által kiváltott ketogenezist a propranolol, a β-receptor antagonista blokkolta. A zsírban gazdag étrend mérsékelten növelte a citrátot és a szukcinátot, és a stroke után nem változott.
Következtetések
Arra a következtetésre jutunk, hogy az agyi iszkémia a májban β-hidroxi-butirát (ketogenezis) képződését és az agyban a β-hidroxi-butirát fogyasztását indukálja. Úgy tűnik, hogy ezt a hatást a β-adrenerg receptorok közvetítik.
Bevezetés
A stroke a halálozás és a fogyatékosság egyik vezető oka, 1, 2. Ezt a helyzetet részben a sikeres kezelések, például a rekombináns szöveti plazminogén aktivátorral végzett farmakológiai beavatkozások vagy a mechanikus trombectomia szűkössége okozza. 3, 4 A neuroprotektív szerekkel végzett sikertelen klinikai vizsgálatok nagy száma miatt az elmúlt évtizedben népszerűvé vált az agyi iszkémia súlyosságának csökkentésére szolgáló 5, 6 diétás megközelítés. Noha a glükóz az agyi anyagcsere fő forrása, 3 ketontest, mint például az acetoacetát és a β-hidroxi-butirát (BHB), a glükóz akár 50% -át is képes pótolni az agy működéséhez szükséges anyagcsere-energia biztosításához. Ez a hozzájárulás különösen fontos a korai életkorban és az éhezés idején. 4 Az agyi iszkémiában a hiperglikémia káros, míg a keton testek jelentős előnyökkel járnak. Valójában zsírban gazdag és ketogén étrendet javasoltak neuroprotektorként, 5 és az állatokkal kapcsolatos adatok a kísérleti stroke-vizsgálatokban a ketogén étrend jótékony hatásait mutatják. 6 Ráadásul a BHB beadásáról kiderült, hogy megakadályozza az idegsejtek pusztulását sejttenyészetekben és a neurológiai betegség állatmodelljeiben. 7, 8, 9
A ketogén étrend alternatívája lehet a triheptanoin, egy triglicerid, amely heptanoátot tartalmaz, egy páratlan C7-zsírsavat. A triheptanoinról feltételezik, hogy anaplerotikus vegyületként működik, és pótolja a citromsav-ciklus szubsztrátjait, például a szukcinátot. 10 A triheptanoin előnyös a hosszú láncú mitokondriális β-oxidációs rendellenességekben. 11 A legújabb munka azt is kimutatta, hogy a triheptanoin hasznos az epilepsziában, ahol a ketogén étrendnek már régóta helye van a kezelésben. 12 Korábban beszámoltunk arról, hogy a triheptanoinban gazdag étrend csökkentette az idegsejtek pusztulását az egerek átmeneti agyi iszkémiája után. 13 Mivel laboratóriumunk előzetes adatai azt mutatták, hogy a triheptanoin ketogenezist is kiváltott, megkezdtük a jelenlegi vizsgálatot, amelyben összehasonlítottunk egy szokásos étrendet, egy triheptanoinban gazdag étrendet és egy szójaolaj-étrendet a máj, a vér glükóz- és BHB-szintjére gyakorolt hatásuk miatt., és az agy. Drámai, stroke-indukálta ketogenezist találtunk zsírban gazdag étrendben lévő egerekben, amelyet ellentétes glükózszint-változások kísértek, és amelyet adrenerg β-receptorok blokkolása akadályozott meg.
Mód
Kísérleti csoportok
Nőstény CD-1 egereket (29–32 g; Charles River Laboratories) használtunk a kísérletekhez. Normál ketrecekben tartottuk őket 60% páratartalom mellett, 22 ° C hőmérsékleten és 12 órás fény/sötét ciklus alatt. Étel és víz ad libitum volt elérhető. A vizsgálatot a helyi állatbizottság (Regierungspräsidium Darmstadt) regisztrálta. A GV-Solas irányelveknek megfelelően az összes eljárást úgy tervezték meg, hogy minimalizálja a kísérleti állatok szenvedését.
Az egereket véletlenszerű számgeneráláshoz számítógépes program segítségével randomizálták vizsgálati csoportokba. Összesen 173 egeret használtak ehhez a vizsgálathoz. Összességében 24 kísérletet nem lehetett végigkövetni műtéti problémák miatt (a középső agyartér elégtelen blokádja, folyamatos vérzés a reperfúzió alatt), és az egereket fel kellett áldozni. 17 kísérletben az analitikai problémák kudarcot okoztak az adatok megszerzésében (a perfúzió hiánya a mikrodialízis szondában, problémák a minta feldolgozása és a gázkromatográfia – tömegspektrometriás mérések során). Az 1., 2., 3., 4., 5–6. Ábrán bemutatott eredményeket 132 sikeres kísérletből nyertük (csoportonként átlagosan 8 kísérlet). Külön kísérleteket hajtottak végre az ábrák előállításához, azzal a különbséggel, hogy a 3. és 5. ábra eredményei ugyanazon állatcsoportból származnak. Az analitikai méréseket gázkromatográfiával – tömegspektrometriával három különböző kutató végezte, azonos eredményekkel.
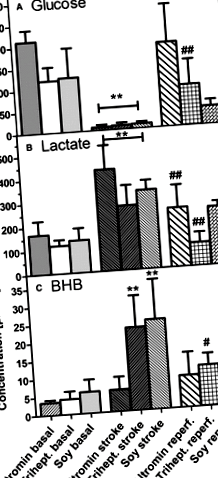
1.ábra. A metabolitszint változásai a mikrodializátumokban (bazális), átmenet (stroke) és (reperf.) Átmeneti (90 perc) középső agyi artéria elzáródása előtt: (A) glükóz, (B) laktát, (C) β-hidroxi-butirát (BHB) ). Az egereket 3 hétig szénhidrátban (szokásos étrend; altromin), triheptanoinban (Trihept.) Vagy szójaolajban (szója) gazdag étrendben tartottuk. Az adatok olyan koncentrációk, amelyeket a stroke előtt, alatt vagy után vett 6 minta alapján számítottunk ki, és 6 kísérlet átlagának ± SD értéke. A statisztikákat egyutas ANOVA-val és Tukey utópróbával számoltuk; **P # P ## P
2. ábra. A β-hidroxi-butirát (BHB) koncentrációi (A) májhomogenátumban, (B) vérplazmában és (C) agyhomogenátumban (ischaemiás félteke). A mintákat kezeletlen állatoktól (Ctl.) Vagy közvetlenül a 90 perces átmeneti agyi artéria elzáródása (stroke) után vettük standard egereken (standard) vagy szójaolajban (szójaolajban) gazdag étrenden tartott egerekben. Az adatokat átlag ± SD-ként adjuk meg (n = 6). A statisztikákat egyutas ANOVA-val és Tukey utópróbával számoltuk; *P
3. ábra. A glükóz koncentrációi az (A) májhomogenátumban, (B) vérplazmában és (C) agyhomogenátumban (ischaemiás félteke). A mintákat kezeletlen állatoktól (Ctl.) Vagy közvetlenül a 90 perces átmeneti agyi artéria elzáródása (stroke) után vettük standard egereken (standard) vagy szójaolajban (szójaolajban) gazdag étrenden tartott egerekben. Az adatokat átlag ± SD-ként adjuk meg (n = 6). A statisztikákat egyutas ANOVA-val és Tukey utópróbával számoltuk; **P ## P
4. ábra. Az (A) β-hidroxi-butirát (BHB) és (B) glükóz változásai 60 perces reperfúzió után, a bal (iszkémiás) agyféltekékben mérve. A mintákat közvetlenül a 90 perces átmeneti agyi artéria elzáródása (stroke) befejezése után, vagy 60 perces reperfúzió (Reperf.) Után vettük egerekben standard étrenden (standard) vagy szójaolajban gazdag étrenden (szója diéta). ). Az adatokat átlag ± SD-ként adjuk meg (n = 6). A statisztikákat egyutas ANOVA-val és Tukey utópróbával számoltuk; **P ## P
5. ábra. A citrát koncentrációja (A) májhomogenátban, (B) vérplazmában és (C) agyhomogenátumban (ischaemiás félteke). Mintákat vettünk kezeletlen állatoktól (Ctl.), Vagy 90 perces átmeneti agyi artéria középső elzáródása (stroke) után egerekben standard étrenden (standard) vagy szójaolajban gazdag étrenden (szója diéta). Az adatokat átlag ± SD-ként adjuk meg (n = 6). A statisztikákat egyutas ANOVA-val és Tukey utópróbával számoltuk; *P # P ## P
6. ábra. Az (A) β-hidroxi-butirát (BHB) és (B) glükóz változásai a máj homogenizátumaiban, kezeletlen egerekből (Ctl.), 90 perc átmeneti középső agyi artéria elzáródás után kezeletlen egerekben (stroke) vagy olyan egerekben, amelyek kezeltek propranolol (prop; 2 mg/kg IP) a stroke kiváltása előtt. Az egereket 3 hétig szokásos étrenddel (standard) vagy szójaolajban gazdag étrenddel (szója diéta) táplálták. Az adatokat átlag ± SD-ként adjuk meg (n = 6). A statisztikákat egyutas ANOVA-val és Tukey utópróbával számoltuk; *P ## P
Három étrendi csoportot alkalmaztak: a szokásos szénhidrátban gazdag étrendet, a triheptanoinban gazdag étrendet és a szójaolajban gazdag étrendet. A diéták izokalorosak voltak, és 3 hétig táplálták őket, étellel és vízzel ad libitum szerint. A szokásos étrend (Altromin 1326 egereknél; Altromin Co) 64% szénhidrátot, 24% fehérjét és 12% zsírt tartalmazott (kalóriaszázalékként számolva). A triheptanoin diéta (Ssniff Co) 14% triheptanoint tartalmazott (tömeg/tömeg), ami a teljes kalóriabevitel 35% -át teszi ki (szénhidrátok 48%, fehérje 17%). A zsírban gazdag étrend azonos kalóriamennyiségű szójaolajból (35%), 48% szénhidrátból és 17% fehérjéből állt, és a Ssniff Co. is elkészítette. A rost (4%) és a hamu (5,5%) mennyisége azonos volt a három étrendben, csakúgy, mint az élelmiszer-adalékanyagok, amelyek A-, C-, D3-, E-, K3-vitamint és rézet tartalmaztak.
A tanulmány 2 részből állt. Az első részben (1. és 2. ábra) összehasonlítottuk a triheptanoinban gazdag étrendet a szójaolaj-étrenddel, hasonlóan a korábbi vizsgálatokhoz. 12., 13. Mindkét étrend összetétele azonos volt, kivéve a zsír alkotóelemét (lásd fent). Ebben a kísérletben az egereket mikrodialízis szondákkal ültették be a stroke indukciója előtt, és a metabolit szinteket mértük dializátumokban. Ezenkívül a BHB és egyes energia-metabolitok (citrát, szukcinát, fumarát, malát) koncentrációit gázkromatográfiával - tömegspektrometriával mértük a plazmában, valamint a máj és az agy homogenizátumaiban.
A vizsgálat második részében (2., 3., 4., 5–6. Ábra) az egereket vagy szójaolaj alapú zsírban gazdag táplálékkal, vagy szénhidrátban gazdag szokásos étrenddel etették (Altromin 1326). Ebben a kísérletben a glükóz, a BHB és az energia metabolitokat gázkromatográfiával - tömegspektrometriával mértük a májban, a vérben és az agy homogenizátumaiban. Egyes kísérletekben 2 mg/kg (±) -propranolol-hidrokloridot (99% -os tisztaságú, sóoldatban oldva; Sigma-Aldrich) intraperitoneális injekcióval adtak 15 perccel a stroke kiváltása előtt.
Átmeneti középagyi artéria elzáródás
Gázkromatográfia – tömegspektrometriás mérések
A vérplazma-, máj- és agymintákat az egerek lefejezése után azonnal összegyűjtöttük, folyékony nitrogénben lefagyasztottuk, és a mérésig -80 ° C-on tároltuk. Az agy- és májhomogenátumokat kétfázisú Folch-eljárással extraháltuk, a vizes felülúszót nitrogénáram alatt szárítottuk, és a száraz maradékokat BSTFA-val (N, O-bisz [trimetil-szilil] trifluor-acetamid) és TMCS-vel (trimetil-klór-szilán; 99: 1). A plazmamintákban a fehérjéket metanol: víz (9: 1) hozzáadásával kicsapjuk és centrifugáljuk, és a felülúszókat a korábban leírtak szerint kezeljük. A mikrodializátum mintákat egyszerűen szárítottuk és közvetlenül BSTFA/TMCS-sel (99: 1) derivatizáltuk.
A mintákat egy HP-6890 sorozatú GC rendszeren (Hewlett Packard) mértük, amely egy Agilent Mass Selective Detector 5973 (Agilent) és egy Agilent Autosampler 7683 volt. Technologies) szililezett előoszloppal (5 m). A metabolitok (a NIST adatbázishoz igazított spektrumok) kvalitatív elemzése után megállapítottunk egyionos monitorozási paramétereket, és ezeket alkalmaztuk a glükóz, a BHB, a citrát, a szukcinát, a fumarát és a malát számszerűsítésére. A számításokat belső és külső standard módszerekkel végeztük.
Statisztikai analízis
Az értékeket n kísérlet átlagának ± SD-ként fejezzük ki. A kezelési csoportok közötti statisztikai szignifikanciát egyutas ANOVA-val értékeltük Tukey utáni teszttel, a GraphPad Prism 5.0 verziójával.
Eredmények
A zsírban gazdag étrend hatása az energia metabolitokra és a keton testképződésre az agyi iszkémia során
Vizsgálatunk első kísérletében 2 zsírban gazdag étrendet, a triheptanoinban gazdag étrendet és a szójaolaj étrendet hasonlítottuk össze a szokásos étrenddel. Bár a zsírtartalom a 2 zsírban gazdag étrendben megegyezett a kalóriatartalommal, meg kell jegyezni, hogy a szójaolajban magas a C16/18 zsírsavmennyiség, míg a triheptanoin a C7-heptánsavvá észterezett glicerinből áll. A mikrodialízist az iszkémia előtt, alatt és után végezték. Az adatok (1. ábra) azt mutatják, hogy a korábbiakban leírtak szerint a 14 agyi iszkémia az agy glükózjának gyors csökkenését és a laktát jelentős növekedését eredményezte mind a három étrendi csoportban. A glükóz- és laktátszintek normalizálódtak a reperfúzió során, a szójaolaj-étrenden lévő egereknél a laktát kevésbé gyors helyreállást mutatott, mint a másik 2 diétás csoportnál (1A. És 1B. Ábra). Az ellenkezőjét figyeltük meg a glükóz esetében (1A. És 1B. Ábra). Érdekes módon azonban a BHB jelentős ≈5-szeres emelkedését figyelték meg a zsírban gazdag étrendben lévő két étrendi csoportban (1C. Ábra), és a reperfúzió során is normalizálódott. A standard étrendben az egereknél nem tapasztaltak szignifikáns BHB növekedést (1C. Ábra).
A következő kísérletek során a metabolit szintet mértük a májban, a vérplazmában és az agyi iszkémiás félteke homogenátumaiban. Megállapítottuk, hogy az ischaemiás stroke a keton testek masszív képződését indukálja a májban (2A. Ábra), amely szerv elsősorban a ketogenezisért felelős. A triheptanoinnal táplált egerek májában a BHB az agyi ischaemia során 181 ± 97-ről 2031 ± 787 μmol/L-re emelkedett, ami 11-szeres növekedést jelent. A szójaolajjal táplált csoportban a BHB 258 ± 46-ról 3,688 ± 1179 μmol/L-re emelkedett, ami 14-szeres növekedést jelent. Ehhez képest ez a hatalmas növekedés nem volt megfigyelhető a szokásos étrendet fogyasztó egereknél. Noha a máj BHB szintje> 2-szeresére emelkedett (406 ± 108-ról 1095 ± 525 μmol/L-re) ezekben az egerekben, ez a növekedés nem volt statisztikailag szignifikáns (2A. Ábra).
A májban a keton testképződés mellett a triheptanoinnal táplált egerekben a BHB plazmakoncentrációja 187 ± 69-ről 641 ± 203 μmol/l-re, szójaolajjal táplált egerekben pedig 61 ± 42-ről 924 ± 565 μmol/l-re emelkedett.; a standard étrendben lévő egerek ismét sokkal kevésbé szembetűnő növekedést mutattak (124 ± 46-ról 261 ± 152 μmol/l-re) átmeneti középső agyi artéria elzáródása után. Végül a BHB növekedése az agy homogenizátumaiban is megmutatkozott: a triheptanoinnal táplált bazális szint 134 ± 90 μmol/L és a szójaolajjal táplált egerekben 105 ± 33 μmol/L volt, míg az iszkémia során az értékek 1207 ± 380-ra és 1387 ± 561 μmol/L. A standard étrendben lévő egerekben a BHB szintje nem változott szignifikánsan (2. ábra). Ezek az adatok azt mutatják, hogy az agyi ischaemia drámai ketogenezist okoz a májban, ami viszont a BHB többszörös növekedéséhez vezet a vérplazmában és az agyban. Ez a ketogenezis csak azoknál az egereknél fordul elő, amelyeket korábban triheptanoin-diétával vagy szójaolaj-diétával tápláltak, a szokásos szénhidrátalapú étrendet nem.
Az agyi iszkémia hatása az energia-anyagcserére: A szokásos étrend és a szójaolaj-étrend összehasonlítása
A 3. ábra összefoglalja a máj, a plazma és az agy glükózszintjének adatait. Megállapítottuk, hogy a máj glükózkoncentrációja kétszer magasabb volt a szokásos étrend után, mint a szójaolaj-diétás csoport (P 18, 19, 20 A ketogenezis (BHB-képződés) nagyrészt a májban fordul elő, és olyan fiziológiai válasz, amelyet például éhezés vált ki. 21 Vizsgálatunk fő megállapítása az, hogy az agyi ischaemia, amelyet egerek középső agyi artériájának elzáródása indukál, keton testek hatalmas képződését idézi elő a májban, majd az agyban a BHB növekedését. Ez a hatás az étrendtől függ, és nagyrészt csak a zsírban gazdag étrendet fogyasztó egereknél jelentkezik.
A vizsgálat első részében összehasonlítottuk a szokásos étrendet 2 zsírban gazdag étrenddel, szójaolaj-étrenddel és triheptanoinban gazdag étrenddel; mindkét esetben a zsírtartalom az összes kalória 35% -át tette ki. A szigorúan ketogén étrenddel korábbi megállapításainkkal ellentétben 22 ezek a diéták önmagukban nem okoztak súlyos ketózist (1. és 2. ábra), de megkönnyítették a szisztémás ketózist, amikor agyi ischaemia indukálódott. Mikrodialízisünk adatai azt mutatják, hogy zsírban gazdag étrend mellett az agyi iszkémia a BHB többszörös növekedéséhez vezet az agy extracelluláris terében, míg a szokásos étrend után nem tapasztalható növekedés. A BHB köztudottan agyáteresztő és plazma szintjétől függően jut be az agyba. A BHB-szintek részletesebb elemzése> 10-szeresére emelkedett BHB-koncentrációt (elérve a 2–4 mmol/l-t) zsírban gazdag étrendben szenvedő egerek májában 90 perces átmeneti agyi ischaemia után mért értékeket mutatott. A szokásos étrenden lévő egerek kisebb, kétszeres BHB-képződéssel reagáltak (2. ábra). Egyidejűleg zsírban gazdag étrend mellett a BHB szint magas volt mind a vérplazmában, mind az agy homogenátumában (≈1 mmol/l).
Általánosan elfogadott, hogy a máj a ketontest termelésének túlsúlya, míg más szervek, beleértve az agy gliasejtjeit is, képesek kis mennyiségű BHB képződésére. 4, 24 A keton testképződés jellemzően alacsony glükózszintnél figyelhető meg, amikor alternatív szubsztrátokra van szükség az üzemanyag-fogyasztáshoz. Kezünkben a BHB és a glükóz szintje ellentétes módon változott a stroke után (2. és 3. ábra). A stroke után a plazma glükózszintje erősen csökkent, míg a BHB magas volt. A máj glükózszintje továbbra is magas maradt, de ez részben a fokozott glikogén lebontásnak tudható be, amelyet tanulmányunkban nem mértek. Hasonlóképpen az agy glükózszintje csökkent, amikor a BHB szint emelkedett. Amikor megengedték a reperfúziót, az agy BHB-szintje 1 órán belül elérte a normális szintet, míg a glükózkoncentráció a normális szint fölé emelkedett (reaktív hiperglikémia) (4. ábra). Összességében a stroke hipoglikémiás választ váltott ki, melyet máj BHB-termelés és a BHB felvétele kísért az agyban, amit a BHB megnövekedett extra- és intracelluláris koncentrációja tükröz.
- FEJEK A; A rendszerek áttekintése; for Adolescents Journal of Ethics Amerikai Orvosi Szövetség
- Egészséges testsúly és elhízás megelőzése JACC Health Promotion Series Journal of American College
- Az étrendi mangán hatása az egerek kísérleti vastagbélgyulladására - Choi - 2020 - The FASEB Journal -
- Étrendünk ellen fordítja-e a bélmikrobiómát ∗ Az Amerikai Kardiológiai Főiskola folyóirata
- A gasztrointesztinális traktus lipomáinak képalkotása és eredményei American Journal of Roentgenology Vol