A pantetin, a B5-vitamin származéka kedvezően megváltoztatja a teljes, az LDL- és a nem HDL-koleszterinszintet alacsony vagy közepesen súlyos kardiovaszkuláris rizikójú betegeknél, akik statinterápiára jogosultak: hármas-vak, placebo és étrend-kontrollos vizsgálat
Malkanthi Evans
1 KGK Synergize Inc., London, ON, Kanada
John A Rumberger
2 Princeton Longevity Center, Princeton, NJ, USA
Isao Azumano
3 Daiichi Fine Chemical Co, Ltd., Toyama, Japán
Joseph J Napolitano
4 Független tanácsadó, Allentown, Pennsylvania, USA
Danielle Citrolo
5 Kyowa Hakko USA, New York, NY, USA
Toshikazu Kamiya
5 Kyowa Hakko USA, New York, NY, USA
Absztrakt
Bevezetés
A magas koleszterinszint kimutatásával, értékelésével és kezelésével foglalkozó nemzeti koleszterinoktatási program (NCEP) szakértői csoportja (Felnőtt Kezelőpanel III [ATP-III]) bizonyítékokon alapuló ajánlásokat nyújt a magas koleszterinszint és a kapcsolódó rendellenességek kezelésére. Az ATP-III jelentések az alacsony sűrűségű lipoprotein koleszterint (LDL-C) határozták meg a koleszterinszint csökkentő terápia elsődleges célpontjaként. Számos prospektív tanulmány kimutatta, hogy a magas szérum LDL-C koncentráció a koszorúér-betegség (CHD) egyik fő kockázati tényezője. 1,2 Az epidemiológiai vizsgálatok és a randomizált kontroll vizsgálatok összegyűjtött bizonyítékai alapján az ATP-III kezelési algoritmus az LDL-C-csökkentő terápiához. Az ATP-III algoritmus szerint a személyeket három kockázati kategóriába sorolják: 1) megállapított CHD és CHD kockázat egyenértékek; 2) több (kettő vagy több) kockázati tényező; és 3) nulla egy kockázati tényező. A CHD kockázati egyenértékei magukban foglalják a klinikai érelmeszesedéses betegség, a cukorbetegség nem koronáris formáit, valamint a többszörös (két vagy több) CHD kockázati tényezőt, amelyeknél a CHD 10 éves kockázata> 20%. Minden CHD vagy CHD kockázat egyenértékű személy magas kockázatúnak tekinthető
Diétás beavatkozás és diétavezetés
Egy regisztrált dietetikus utasította a résztvevőket a TLC diétára. Az opcionális 10-25 g/nap viszkózus rostok és/vagy 2 g/nap növényi sztanolok/szterolok és/vagy szójafehérje hozzáadása kizárt az előírt étrendből. A résztvevőknek 4 hétig követniük kellett a TLC étrendet, amely a tanulmányhoz vezetett (átvilágítás az alapszintig), hogy a TLC étrend lipidszintjükre gyakorolt hatását a kiegészítés megkezdése előtt értékelni lehessen. Ez kiküszöbölte a résztvevők közötti változatos étrendből származó potenciális hozzájárulást. A résztvevőknek a vizsgálat időtartama alatt a TLC diétán kellett maradniuk, és a következő látogatás előtt 3 napos étkezési rekordot kellett kitölteniük bármely 2 hétköznapra és 1 hétvégi napra. A TLC étrend betartásának elősegítése érdekében az étkezési nyilvántartásokat minden tanulmányi látogatás alkalmával kitöltötték és átadták felülvizsgálatra és tanácsadásra a dietetikus számára. Az ételrekordokat elemezték fehérje, zsírok, szénhidrátok és rostok átlagos napi energiafogyasztására vonatkozóan.
Véletlenszerűség és elvakítás
A 4 hetes TLC diéta bevezetésének befejeztével a résztvevőket 1: 1 arányban randomizálták, vagy pantetint, vagy placebót kaptak. A randomizáláshoz kettő blokkoló tényezőt alkalmaztunk. A vakítás megőrzése érdekében a vizsgálati tabletták és a nem aktív placebo tabletták megjelenésükben azonosak voltak, és azonos, csak randomizációs szám alapján azonosítható buborékfóliákban voltak lezárva.
Vizsgálati termék
A vizsgálati termék gyógyszerészeti minőségű, szabadalmaztatott termék volt, a Pantesin HF55. Minden tabletta 300 mg hatóanyagot tartalmazott, és az Eagle Nutritionals (Carlstadt, NJ, USA) gyártotta. A buborékcsomagolásokat a Generic Pharmaceutical Services (Hauppauge, NY, USA) gyártotta, és a jó klinikai gyakorlat harmonizációjával foglalkozó nemzetközi konferencia irányelveinek, valamint az alkalmazandó helyi előírásoknak megfelelően címkékkel látták el. Minden buborékfóliában két hatóanyag-tabletta és egy placebo tabletta volt (600 mg/nap adag, az 1. és 8. hét között), három hatóanyag-tabletta (900 mg/nap adag a 9. és 16. hét között) vagy három placebo tabletta. A résztvevők mindkét csoportban naponta háromszor egy tablettát szedtek a teljes vizsgálati időszak alatt, a kiindulástól a 16. hétig. A megfelelőséget a visszaküldött buborékfóliák áttekintésével értékelték.
Klinikai értékelések
A résztvevők a 0., 2., 4., 8., 12. és 16. héten tértek vissza a klinikára, és minden látogatás alkalmával éhomi (12 órás) vért gyűjtöttünk a lipid elemzéséhez (Gamma-Dynacare Medical Laboratories, London, ON, Kanada) panel (TC, HDL-C, LDL-C, TG, VLDL-C, Apo-B és lipoprotein), és a biztonsági markerek; CBC, elektrolitok, valamint máj- és vesefunkciós tesztek. A TG-t Roche P800 klinikai kémiai analizátorral végzett enzimatikus kolorimetriás vizsgálattal elemeztük, a VLDL-C-t a TG-értékekből számítottuk (a TG-t 2,18-mal osztva), a lipoproteint pedig egy Siemens BN II Nephelometer-mel végzett nephelometrikus vizsgálattal. A hs-CRP-t, a homociszteint és a CoQ10-et a 0., 4., 8., 12. és 16. héten mértük. A hsCRP-t egy Dade Behring BNII nephelométerrel, az FPIA technológiával (Gamma-Dynacare Medical Laboratories) elemzett homociszteint elemeztük. A teljes CoQ10 elemzést HPLC-vel, UV-detektálással végeztük a KGK Synergize Laboratory (London, ON, Kanada) részéről. A HPLC módszert Mosca és munkatársai adaptálták (36)
A résztvevők a nemkívánatos eseményeket (AE) naplóba rögzítették, és a nyomozó figyelemmel kísérte őket attól az időponttól kezdve, amikor rendelkeztek legalább egy adag vizsgálati termékkel a kezelés végéig. A nemkívánatos jeleket és tüneteket, beleértve az esetleges rendellenes laboratóriumi eredményeket, betegségeket vagy a már meglévő állapotok súlyosbodását, amelyek időbeli összefüggést mutattak a vizsgálati termék használatával, AE-nek tekintették. A vizsgálat nyomozója értékelte az AE-ket, és az ok-okozati összefüggést a vizsgálati termékkel a legvalószínűbbnek, valószínűbbnek, lehetségesnek, valószínűtlenebbnek vagy nem összefüggőnek jelölte meg.
statisztikai elemzések
A demográfiai és a kiindulási jellemzők csoportok közötti elemzését kovariált kiigazítással hajtottuk végre a tanulmányi végpontok összehasonlításához, és ahol hiányoztak a kiindulási értékek, a szűrővizsgálat során kapott értékeket használtuk.
Az elsődleges és a másodlagos végpontok, valamint a biztonsági paraméterek csoportok közötti elemzését kiigazítottuk a kiindulási értékhez, és a csoportokat párosítatlan t-teszttel hasonlítottuk össze. Az Anderson – Darling-tesztet használták annak megállapítására, hogy az adatok nem normálisan oszlanak-e meg. Ahol az adatok nem voltak normálisan elosztva, ott a csoportok közötti összehasonlításokat nem paraméteres teszttel végeztük. A csoporton belüli összehasonlításokat Student-féle t-teszttel vagy Wilcoxon jelölt rangú teszttel végeztük. Az „utolsó érték átvitt” technikát ott is alkalmazták, ahol a 2. hét után hiányoztak az adatok, a statisztikai elemzésekhez az utolsó rendelkezésre álló postrandomization megfigyelést használták.
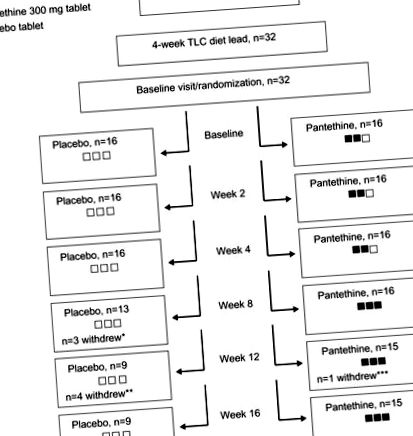
A nemkívánatos eseményeket tapasztaló résztvevők arányának csoportok közötti elemzését Fisher pontos tesztjével végeztük. Az összes statisztikai elemzést R és valószínűségi értékek felhasználásával végeztük (1. táblázat). Összesen 32 résztvevő fejezte be a 4 hetes TLC étrend bevezetését, és 1: 1 arányban randomizálták őket pantetinnek vagy placebónak. Végül 24 résztvevő fejezte be a 16 hetes kiegészítést (1. ábra).
Megjegyzések: * Két alany nemkívánatos események miatt kivonult a vizsgálatból, egy pedig elköltözött a városból. A jelentett mellékhatások a következők voltak: megfázási tünetek (n = 1); és a vér jelenléte a székletben (n = 1). ** Négy alany kivonult a vizsgálatból nemkívánatos események miatt. A jelentett nemkívánatos események a következők voltak: az LDL-C emelkedett ATP III magas kockázatú kategóriába (n = 3); és egy alany nem akarta folytatni a tanulmányt, miután megbetegedett a torokgyulladásban (n = 1). *** Egy alany kilépett a vizsgálatból az LDL-C szintjének ATP III magas kockázatú kategóriába történő növekedése miatt. A fekete dobozok a pantetintablettákat jelölik, amelyek a vizsgálati terméket jelentették, a fehér dobozok pedig a placebót. A vakítás fenntartása érdekében minden alany 3 tablettát kapott. A 8. héten a pantetin csoportban megemelték az adagot, így három pantetintablettát kaptak (három fekete doboz).
Rövidítések: ATP III, Felnőtt Kezelő Testület III (Szakértői testület a magas koleszterinszint kimutatásáról, értékeléséről és kezeléséről felnőtteknél); LDL-C, alacsony sűrűségű lipoprotein koleszterin; TLC, terápiás életmódváltás.
Asztal 1
A pantetin és a placebo csoport résztvevőinek kiindulási fizikai jellemzői
| Életkor (év) | 54,4 ± 7,3 | 47,2 ± 12,1 | 0,051 |
| Magasság (cm) | 164,8 ± 6,9 | 169,3 ± 7,5 | 0,083 |
| Nem (%) | |||
| Női | 87,50 | 56.25 | 0,113 |
| Férfi | 12.50 | 43,75 | |
| Verseny (%) | |||
| fehér | 87,50 | 93,75 | > 0,999 |
| Egyéb | 12.50 | 6.25 | > 0,999 |
Megjegyzések:
Változások a szérumban (A) TC, (B) LDL-C, (C) nem HDL-C, és (D) Apo-B-szintek a szűrés, az alapvonal és a vizsgálati időszak 2., 4., 8., 12. és 16. hetében.
2. táblázat
A pantetin és a placebo csoport résztvevőinek biokémiája és klinikai jellemzői
Megjegyzések: Valószínűségi értékek P * P-értékek, amelyek csoportonként szignifikánsan különböztek. A vörösvérsejtek csoportos statisztikai szignifikanciája, az MPV és az AST értékek közötti különbség a normál laboratóriumi referencia tartományban maradt.
Rövidítések: ALT, alanin-transzamináz; AST, aszpartáz-aminotranszferáz; CoQ10, Q10 koenzim; eGFR, becsült glomeruláris szűrési sebesség; hs-CRP, nagy érzékenységű C-reaktív fehérje; MCH, átlagos corpuscularis hemoglobin; MCV, átlagos korpuszkuláris térfogat; MPV, a thrombocyta átlagos térfogata; RDW, vörösvértest-eloszlás szélessége; SD, szórás.
Mellékhatások
A jelenlegi vizsgálatban a placebo csoport egyik résztvevőjében összesen egy, a vizsgálati gyógyszeres kezelésnek tulajdonítható tünetet regisztráltak. Összesen két, a vizsgálati gyógyszerrel potenciálisan összefüggő tünetről (hasmenés és puffadás) számoltak be a pantetinnel kezelt résztvevők. A hasmenés közepes intenzitású volt, 3 napig tapasztalták a 600 mg/nap adagolási periódus alatt, és az adag emelésekor nem ismétlődött meg. Az egyik résztvevő által jelentett puffadás mindkét adagolási időszakban tapasztalható volt, enyhe intenzitású és a vizsgálat vége előtt megszűnt. A neutropenia egyetlen enyhe epizódját találták a placebóval kezelt résztvevőknél.
Vita
Megalapozott, hogy a megemelkedett plazma lipidszintek nagy szerepet játszanak az érelmeszesedéses betegség kialakulásában és előrehaladásában.37–39 Az LDL-C szintjének csökkentése egyénnél csökkenti a CVD kockázatát és a kardiovaszkuláris kimenetek előfordulását., a koleszterinszint-csökkentő gyógyszerek, például a sztatinok, az alacsonyabb LDL-C szint és a szív- és érrendszeri események előfordulása. 6–8 Az intenzív sztatin-használathoz azonban társult cukorbetegség, izom- és májkárosodás, valamint kognitív károsodás. 42
Az ATP III azt javasolja, hogy az abnormális LDL-C-értékű betegek első kezelési vonala a TLC-étrend legyen. Ezt követően az egyéneket a kockázati tényező profilja és/vagy az FRS alapján kategorizálják, és akkor tekinthetők jogosultnak a sztatin-kezelésre, ha az LDL-C szint meghaladja a meghatározott célt. 34 Egy korábbi, pantetinnel foglalkozó tanulmány a pantetinkezelés hatékonyságát vizsgálta alacsony kockázatú ( FRS 10 éves kockázat 10%, de 160 mg/dl; vagy mérsékelt FRS [> 10, de 130 mg/dl]. Vizsgálatunk eredményei megerősítették azt a hipotézist, miszerint a pantetin jelentősen javítja a koleszterin anyagcserét azáltal, hogy csökkenti a TC és az LDL-C szintjét, anélkül, hogy komoly AE-t okozna statin-terápiára jogosult alacsony és közepes-CVD kockázatú egyénekben. A pantetinnek nem volt hatása a TG szintjére, valószínűleg azért, mert a beiratkozott résztvevők normál TG szintet értek el a kiinduláskor. A vizsgálat elsődleges következtetése az, hogy a TLC diéta önmagában nem eredményezett szignifikáns változást a lipidprofilban, de a pantetrin és a TLC diéta együttesen szignifikánsan csökkentette a TC és az LDL-C szintet a résztvevőkben a 16 hetes vizsgálat során.
A Framingham utódok tanulmánya szexuális hatást javasolt az LDL-C-ra.43. A pantetin-csoport nő és férfi aránya magasabb volt, mint a placebo csoportban. A nemek vonatkozásában egy alcsoport-elemzés azt mutatta, hogy az átvilágításkor vagy a 4 hetes TLC étrend bevezetése után nem volt szignifikáns különbség az LDL-C-ben, mindkét csoport résztvevőinek hasonló LDL-C értékek voltak a kiinduláskor. A kiegészítés megkezdése után azonban a pantetin csoport nagyobb csoporton belüli LDL-C csökkenést mutatott, a 4. hétre elérte a 11% -ot. A női résztvevők a 8. hétre 13% -os csökkenést mutattak, amelyet ezután a 12. és 16. héten is fenntartottak. Ezek a csoporton belüli százalékos változások szignifikánsak voltak a csoportok között a 8. és a 16. héten, ami arra utal, hogy a nőknél az LDL-C javulása pantetin-kiegészítéssel járt. A pantetinnel rendelkező nőknél az Apo-B szint szintén szignifikáns csökkenést mutatott a kiindulási értékhez képest a 2., 4., 8., 12. és 16. héten; a placebót kapók az Apo-B növekedését mutatták a vizsgálat során. A pantetint szedő férfi résztvevők nem mutattak különbséget a lipid paraméterekben, valószínűleg a kisebb mintaszám miatt.
A kiindulási értéktől a 16. hétig nem volt szignifikáns változás a homocisztein szintben, és a szintek mindkét csoportban a normál tartományban maradtak (≤15 μmol/L). A homocisztein hatása a CVD kockázatára továbbra is bizonytalan. A homocisztein szint a mortalitás és a CVD események prognosztikus markere azoknál a betegeknél, akiknek már fennálltak a CVD kockázati tényezői. 54 Másrészről a meta-vizsgálatok kimutatták, hogy a homociszteinszint vitamin-kiegészítéssel történő csökkentése nem csökkentette a súlyos kardiovaszkuláris események kockázatát vagy a teljes mortalitást érrendszeri betegségben szenvedő betegek.55,56 Mivel a pantetin hatásmechanizmusa a koleszterinszint csökkentésében nem teljesen ismert, fontos volt mérlegelni a pantetinpótlás - ha van ilyen - hatását a homociszteinre.
A vizsgált terméknek tulajdonított nemkívánatos események 6,3% volt a placebo és 12,5% a pantetin esetében. A placebo csoportban megoldatlan enyhe vér- és csontvelő AE-t (neutropenia) figyeltek meg. A pantetin csoportban felfúvódásról és hasmenésről számoltak be, de ez a két esemény megszűnt a vizsgálat során. Az ebben a vizsgálatban jelentett AE-k összhangban voltak a pantetin korábban jelentett AE-értékeivel. 32,34 Korábbi klinikai vizsgálatok kimutatták, hogy a pantetint jól tolerálják, a mellékhatások alacsony előfordulása 600-1200 mg/nap dózisban fordul elő.
A sztatinok nagy dózisban történő hosszan tartó alkalmazásának egészségügyi kockázatai közé tartozik a myalgia és a diabetes mellitus kialakulásának fokozott kockázata. Ezek összefüggenek az in vivo CoQ10 termelés egyidejű csökkentésével. Bár a csoportok között nem szignifikáns, a CoQ10 szint szignifikánsan emelkedett a kiindulási értéktől a 4. hétig, és a 16. héten is emelkedett maradt mind a pantetin, mind a placebo csoportban. Lehetséges, hogy a TLC diéta magasabb CoQ10-szintet tartalmazó ételeket eredményezett, mint azok az étkezések, amelyeket a résztvevők a vizsgálat megkezdése előtt fogyasztottak. Ezenkívül a plazma CoQ10-szintek nem feltétlenül tükrözik a szöveti CoQ10-szinteket.57 A sztatinokkal ellentétben, amelyek HMG-CoA reduktáz inhibitorok, amelyek gátolják a CoQ10 bioszintézisét, a pantetin nem blokkolta a CoQ10.58-at. Mivel a pantetin nem befolyásolja a CoQ10 termelést, a kombinált A pantetin és az alacsony dózisú sztatinok szinergikusan hatnak az LDL-C szint csökkentésére, miközben minimalizálják a magas statin dózishoz kapcsolódó káros hatásokat. A hipotézis teszteléséhez további kutatásokra van szükség.
Következtetés
Ez a tanulmány megerősíti, hogy a pantetin csökkenti a CVD kockázati markereit az alacsony vagy közepesen súlyos CVD kockázatú résztvevőknél, akik az NCEP irányelvei szerint sztatinra jelöltek. A placebóval összehasonlítva a pantetinnel kezelt résztvevők 16 hetes kezelés után jelentős csökkenést mutattak az LDL-C, HDL-C és TC szintekben. Ezenkívül, ellentétben a sztatinokkal, amelyek káros szintre emelik a CoQ10-et, mind a pantetin-, mind a placebo-csoport szignifikánsan növelte CoQ10-szintjét az alapvonal felett. Ez a tanulmány kimutatta, hogy a TLC diéta önmagában nem befolyásolta szignifikánsan a lipidprofilokat, de a pantetin kiegészítéssel együtt szignifikánsan csökkentette a lipidszintet. Ezért a pantetinnel történő kiegészítés opcionális kiegészítő terápiának tekinthető alacsony vagy közepes CVD-kockázattal rendelkező betegek számára.
Köszönetnyilvánítás
A szerzők köszönetet szeretnének mondani e tanulmány önkénteseinek a protokoll betartásában tanúsított hajlandóságukért és szorgalmukért. Larry Stittnek, a Nyugat-Ontariói Egyetem biostatisztikai egységének igazgatóhelyettesének köszönetet mondunk a statisztikai tervezéshez és elemzéshez nyújtott hozzájárulásáért. Köszönettel tartozunk Sonya Barr-nak a vizsgálat elvégzéséért, Josh Baisley-nek a minőségbiztosításért és technikai szakértelméért, valamint Hui Jun Chew-nek a kézirat áttekintéséért és szerkesztéséért. Ezt a tanulmányt a Daiichi Fine Chemical Co, Ltd. támogatta.
Lábjegyzetek
Közzététel
A JJN kutatási forrásokat kapott, vagy tanácsadóként tevékenykedett több táplálék- és étrend-kiegészítő cégnél. Az IA a Daiichi Fine Chemical Co, Ltd. alkalmazottja. A TK és a DC a Kyowa Hakko USA, Inc. alkalmazottja. A szerzők nem jelentenek más összeférhetetlenséget ebben a munkában.
- Kérem, ne „fogyókúrázzon” - Alkímia teljes wellness
- Ha statint szed, akkor is, ha a koleszterinszintje normális Harvard Health
- Ppc fogyókúrás injekció Igaz szépség karcsúsító tea vitamin-kiegészítők a fogyás hitéhez
- Prémium CBD olaj 1000mg; B12-vitamin guarana fogyás (Combo) Grouponnal
- Természetes vitamin-kiegészítők hajhulláshoz Viviscal