A perivascularis zsírszövet, mint az elhízás kardiovaszkuláris kockázatának releváns zsírraktára
Rafael M. Costa
1 Farmakológiai tanszék, Ribeirao Preto Orvostudományi Kar, São Paulo Egyetem, Ribeirao Preto, Brazília
Karla B. Neves
2 Kardiovaszkuláris és Orvostudományi Intézet, British Heart Foundation, Glasgow Kardiovascularis Kutatóközpont, Glasgowi Egyetem, Glasgow, Egyesült Királyság
Rita C. Tostes
1 Farmakológiai tanszék, Ribeirao Preto Orvostudományi Kar, São Paulo Egyetem, Ribeirao Preto, Brazília
Núbia S. Lobato
3 Egészségtudományi Intézet, Goias Szövetségi Egyetem, Jatai, Brazília
Absztrakt
Bevezetés
Az elhízás gyorsan növekvő probléma, amely világszerte eléri a járvány nagyságát, mind a gyermekeket, mind a felnőtteket érintve (Ogden et al., 2016; Lim et al., 2017). Ezt az állapotot a testmagasság aránytalan testsúlyaként határozzák meg, túlzott zsírfelhalmozódással, amelyet gyakran enyhe, krónikus, szisztémás gyulladás kísér (Gonzalez-Muniesa et al., 2017). Egyre több tudományos, orvosi és magatartási adat mutat be, amelyek azt mutatják, hogy a zsírszövet központi lerakódása a kardiovaszkuláris szövődmények, köztük agyvérzés, pangásos szívelégtelenség, miokardiális infarktus és kardiovaszkuláris halál miatt megnövekedett morbiditási és mortalitási kockázattal jár, és ez független az elhízás, a metabolikus szindróma és más kardiovaszkuláris kockázati tényezők közötti összefüggéstől (Arnlöv et al., 2010; Williams et al., 2015). Korábban ezt az egyetértést támogatta az American Heart Association 1998-ban, amely az elhízást a koronária szívbetegség (CHD) egyik fő, módosítható rizikófaktorává minősítette (Eckel és Krauss, 1998).
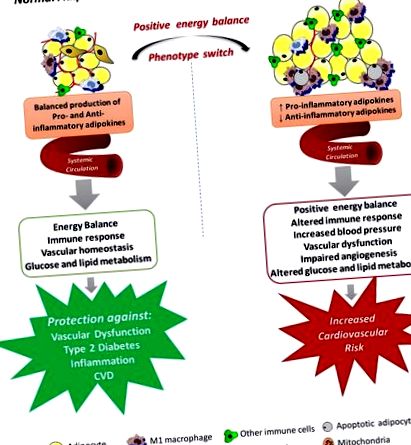
Amellett, hogy a fehér zsírszövetet (WAT) a test legnagyobb energetikai tárolójának tartják, figyelemre méltóan összetett endokrin szervként ismerik el, amely számos anyagot termel és választ ki endokrin, parakrin és autokrin funkcióval, és a szisztémás energia homeosztázisának fő szabályozójaként működik. (Rosen és Spiegelman, 2014). Elhízás esetén a zsírszövet működésképtelenné válhat, és nem képes megfelelően bővülni a felesleges energia tárolására. Ez méhen kívüli zsírlerakódást eredményez más szövetekben, amelyek szabályozzák a metabolikus homeosztázist (Tchoukalova et al., 2010). A WAT expanzió számos helyi következménnyel járt együtt, beleértve a gyulladást (Apovian et al., 2008), a fibrózist (Henegar et al., 2008), a hipoxiát (Jiang et al., 2011), a szabályozatlan adipokin szekréciót (Jernås et al., 2006; Skurk et al., 2007), és megzavarta a mitokondriális funkciót (Heinonen et al., 2015). A WAT diszfunkció egész testének következményei közé tartozik a rendellenes glükóz- és lipid-anyagcsere, az inzulinrezisztencia, a vérnyomás emelkedése, a véralvadás, a fibrinolízis, a gyulladás és az endothel diszfunkció, amelyek mindegyike fontos mechanizmusokat biztosít az elhízás és a szív- és érrendszeri betegségek (CVD) összekapcsolására.
Elhízás és kardiovaszkuláris kockázat
Azok a mechanizmusok, amelyekkel a szisztémás zsírszövet-diszfunkció vaszkuláris diszfunkció kialakulásához vezethet az elhízásban. A zsírszövet különféle kemokineket, citokineket és hormonokat termel, amelyek kiválasztódnak a keringési rendszerbe, és számos fiziológiai folyamatban játszanak szerepet, ideértve az energiaegyensúlyt, az immunválaszokat, a vérnyomást, az érrendszeri homeosztázist és az angiogenezist, a glükóz és a lipid anyagcserét. A zsírszövet kitágulása nekrotikus és/vagy apoptotikus sejthalálhoz vezet, és ezt párosítja az aktivált makrofágok beszivárgása, a gyulladásgátló adipokinek és a reaktív oxigénfajok fokozott termelése, elősegítve a szisztémás endothelsejt-aktiváció állapotát és az érrendszeri diszfunkciót. amelyek hozzájárulhatnak az elhízással járó megemelkedett kardiovaszkuláris kockázathoz.
A perivaszkuláris zsírszövet hatása az ér működésére
A PVAT szerkezeti és élettani jellemzői helyétől függően változnak. A mesenterialis artériákban a PVAT hasonlít a WAT-ra, kevésbé differenciált adipocitákkal, gyenge vaszkularizációval, a citokinek termelésének/szekréciójának sajátos profiljával, valamint makrofágok, fibroblasztok és az immunrendszer sejtjeinek infiltrátumait tartalmazza (Guzik et al., 2013). Másrészt a legújabb vizsgálatok kimutatták, hogy a mellkasi aorta PVAT-jának olyan tulajdonságai vannak, amelyek inkább a BAT-hoz hasonlítanak, mint a WAT-hoz (Fitzgibbons et al., 2011; Chang et al., 2012), beleértve a magasan vagy kizárólag a BAT-ban kifejezett gének expresszióját, a multilokuláris adipociták jelenléte és a mitokondriumok magas bősége. A BAT-hoz hasonlóan a PVAT-t is hideg aktiválja és hőt termel. Érdekes módon a hidegben kiváltott termogenezis aktiválása a PVAT-ban együtt jár az ateroszklerotikus folyamat gyengülésével apolipoprotein E-hiányos egerekben (ApoE -/-), míg ilyen védelem elvész azokban az egerekben, ahol nincs PVAT (Chang et al., 2012), jelezve, hogy a PVAT termogén tulajdonságai az érvédő hatásait is közvetítik.
Bár ebben a kéziratban nem tudunk részletesen foglalkozni a témával, fontos megjegyezni, hogy sok más mechanizmust is leírtak, amelyek részt vesznek a PVRF által kiváltott kontraktilis hatásokban. Lu és munkatársai az alsó vena cava gyűrűk felhasználásával PVAT és endothelium hiányában és jelenlétében azt találták, hogy az endothelium eltávolítás megszünteti a PVAT kontraktilis reakcióját. Ugyanez a kutatócsoport azt javasolta, hogy a PVAT felszabadítsa az Ang 1–7-et, amely az endothelium receptoraira hatva nitrogén-oxid (NO) felszabaduláshoz és a Kv-csatornák aktivációjához vezet, ezt követő vaszkuláris relaxációval (Lu et al., 2011) . A PVRF hatással lehet endothelium-független mechanizmusokon keresztül, amelyek hidrogén-peroxid (H2O2) termelést és a guanilil-cikláz (sGC) ezt követő aktiválását eredményezik (Gao et al., 2007).
A perivaszkuláris zsírszövet diszfunkció, mint az elhízással kapcsolatos érrendszeri diszfunkció fő tényezője
A perivaszkuláris zsírszövet diszfunkciója és az elhízással járó vaszkuláris diszfunkció. A perivaszkuláris zsírszövet (PVAT) biológiailag aktív molekulák széles választékát választja ki, beleértve az adipokinokat, amelyek modulálják az érrendszeri tónust, a simaizomsejtek vándorlását és proliferációját, a neointimális hiperpláziát, a gyulladásos reakciókat és az oxidatív stresszt. Az elhízás a PVAT szerkezeti és funkcionális változásaival társul, ami egyensúlyhiányhoz vezet az érszűkítő és gyulladáscsökkentő anyagok, az adipociták hipertrófiája, valamint az inzulin jelátviteli utak megváltozásában. SMC, simaizomsejt; ROS, reaktív oxigénfajok; NO, nitrogén-oxid.
A mitokondriális elektrontranszportlánc (mETC), amely a ROS jelentős forrása, szintén integráns komponensként szerepel a vaszkuláris funkció fiziológiai szabályozásában, amelyet a PVAT végez. Nemrégiben kimutattuk, hogy a mETC-ből származó O 2 -termelés megnövekszik a PVAT-ban a noradrenalin (NE) által kiváltott aorta izom-összehúzódás során. O 2 - ezt követően a mangán SOD (Mn-SOD) H2O2-val dismutálja, amely viszont modulálja a VSMC összehúzódását (Costa és mtsai, 2016). Ezeket a megállapításokat követően a következőkben egyértelmű bizonyítékokat szolgáltattunk, amelyek a mitokondriumokat összekapcsolják a PVAT-hoz kapcsolódó oxidatív stresszel és a kísérleti elhízás során megfigyelt PVAT kontraktilis hatások későbbi elvesztésével (da Costa és mtsai, 2017). Ilyen körülmények között a PVAT által közvetített ROS-generáció növekedése a fokozott érösszehúzódás fontos jelévé válik. Mivel a PVAT-nak a BAT-hoz hasonló fenotípusa van, beleértve az UCP-1 expresszióját, amely szükséges a nem didergő termogenezishez, amint azt fentebb tárgyaltuk, és figyelembe véve, hogy a hőmérséklet változásai által kiváltott helyi energia-anyagcsere befolyásolja az érrendszer működését és az aterogenezist (Brown és mtsai. ., 2014) felvethető, hogy az elhízás esetén a PVAT-ban megnövekedett energiatermelés az érbiológiát is befolyásolja, elősegítve a CVD kialakulását.
Ezek a megállapítások, azon megfigyelések mellett, miszerint a zsírszövet helyi felhalmozódása következetesen összefügg az áramlás által közvetített értágulat csökkenésével (Albu et al., 2005), az éhomi inzulinszinttel és az emberek inzulinrezisztenciájával (Rittig et al., 2008), támogatják a PVAT-eredetű faktorok bevonása parakrinként, nem pedig mind a mikrovaszkuláris diszfunkció, mind az inzulinrezisztencia endokrin közvetítői az elhízás során. Ezekben az utakban is óriási redundancia van, amelyek alátámasztják azt a nézetet, hogy a PVAT és a kardiometabolikus kockázati tényezők közötti összefüggés nem egyszerűen a teljes adipozitás következménye lehet, hanem potenciálisan további kockázati tényezőt is jelent. Figyelembe véve, hogy a hiperglikémia és a hiperinsulinémia közvetlenül károsíthatja az érrendszer működését és következésképpen a glükóz elhelyezkedését, arra is lehet javaslatot tenni, hogy a PVAT diszfunkció ördögi körforgása hozzájáruljon az inzulin homeosztázis károsodásához és súlyosbítsa azt.
Gyulladás a perivaszkuláris zsírszövetben: kapcsolat az elhízás és a szív- és érrendszeri betegségek között?
A PVAT-gyulladás az adipokinek és más adipocita-eredetű relaxációs faktorok megváltozott felszabadulásával is társulhat (Antonopoulos et al., 2015; Woodward et al., 2017). E megértés kezdeti alátámasztása azokból a megállapításokból származott, amelyek szerint az atherosclerotikus betegségben nem szenvedő emberek és egerek perivascularis adipocytái megemelkedett proinflammatorikus állapotot mutatnak, és bazális körülmények között csökkent az adipocytic differenciálódás, összehasonlítva a szubkután és visceralis zsírraktárakból származó adipocytákkal, és hogy a magas zsírtartalmú táplálkozás az adipocyta-asszociált génexpresszió további csökkenése, miközben a proinflammatorikus génexpresszió felemelkedik (Chatterjee et al., 2009). Pontosabban, a gyulladásgátló adipokin-adiponektin szekréciója jelentősen csökken, míg az IL-6, IL-8 és MCP-1 proinflammatorikus citokineké szignifikánsan megnő a perivaszkuláris adipocitákban. Ezek a változások közvetlen hatással vannak a PVAT vazoaktív tulajdonságaira is, amit állat- és emberi kisartériás vizsgálatok igazolnak, ahol a hipoxia és a gyulladás oxidatív stressz hatására csillapítja a PVAT helyi vazoaktív tulajdonságait (Greenstein és mtsai, 2009).
Összességében ezek a megállapítások nemcsak a PVAT gyulladásos összetevőjének többféle potenciális mediátorát biztosítják az elhízásban, hanem egyértelműen bizonyítják, hogy a szisztémás metabolikus gyulladás és a helyi immunkomponensek közötti kétirányú kölcsönhatások kritikus szempontok a társult fiziológiai és kóros érrendszeri eredmények meghatározásakor. elhízással. A PVAT, mint a gyulladásos citokinek és más mediátorok gazdag forrásának közelsége, valamint a szövetben bekövetkező változások alátámasztják azt az elgondolást, hogy a helyi zsírszövet-depók specifikus változásai hozzájárulnak a szomszédos érfal betegségfolyamataihoz.
A perivaszkuláris zsírszövet klinikai mérése az elhízással összefüggő kardiovaszkuláris kockázatbecslés során: a lényeg megtalálása
A PVAT és a CVD kockázati tényezői közötti kölcsönös kapcsolat kezdeti gondolatait és megfontolásait olyan klinikai eredmények szolgáltatták, amelyek összefüggést mutatnak mind a perivascularis, mind az epicardialis zsírszövet és a metabolikus szindróma fő antropometriai és klinikai paraméterei között (Iacobellis et al., 2003b). Valójában nagyon jó korreláció figyelhető meg az echokardiográfiával értékelt epikardiális zsírszövet és a derék kerülete, a diasztolés vérnyomás, az éhomi plazma inzulin, az LDL koleszterin és a plazma adiponektin között (Iacobellis et al., 2003b). Fontos, hogy az inzulinérzékenység és az alacsony adiponektinszint összefüggése az epikardiális zsírvastagsággal független a BMI-től, ami arra utal, hogy a PVAT-értékelés érzékenyebb és specifikusabb mérőszámot adhat a valódi viscerális zsírtartalomról (Iacobellis et al., 2003a). Ezen megállapítások alátámasztására a közzétett jelentések nemrégiben készült metaanalízise arra a következtetésre jutott, hogy az echokardiográfiai epikardiális zsírvastagság szignifikánsan magasabb a metabolikus szindrómában szenvedő betegeknél, mint azoknál, akiknél ez nincs (Pierdomenico et al., 2013).
Összegzés
A PVAT-ból származó tényezők által megváltoztatott vaszkuláris jelátviteli utak további boncolása valószínűleg funkcionális stratégiákat fog feltárni a rendellenes zsírszövet-felesleg CVD-szövődményekre gyakorolt negatív hatásainak elnyomására anélkül, hogy megváltoztatná a normál zsírraktárak jótékony hatásait. Az ezen a területen fennmaradó kihívások két különböző területen azonosíthatók. Hogyan kezdődnek a PVAT szerkezeti és funkcionális változásai az elhízásban, és melyik ponton válik káros? Melyek a megfelelő modellrendszerek és utak az emberi CVD megelőzésére vagy kezelésére szolgáló ismeretlen mechanizmusok tisztázására? Az új jellemzett adipokinek hozzájárulását illetően számos érdekes és kialakuló fogalom is létezik. Tekintettel ezekre a kihívásokra, valamint olyan terápiás megközelítések szükségességére, amelyek nem befolyásolják tartósan a PVAT teljes fiziológiai hatásait, a kísérleti betekintés sikeres klinikai beavatkozásokba történő átadása együttműködő és sokszínű keresztvizsgálatokat, új kísérleti megközelítéseket és a genetikai variációk más környezeti környezettel történő integrálását igényli módosítók, hogy kapcsolatot teremtsenek a komplex kardiovaszkuláris fenotípusokkal, és megkönnyítsék az emberi betegségre való sikeres fordítást.
Szerzői hozzájárulások
Az RC, KN, RT és NL egyaránt hozzájárult a papír kidolgozásához, a kézirat elkészítéséhez és jóváhagyta annak végleges változatát.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
- Elhízás, fogyás és feltételes kardiovaszkuláris kockázati tényezők - Tzotzas - 2011 - Elhízási vélemények
- Elhízás és a légúti fertőzések kockázata egy fertőzés-napló alapú kohorsz vizsgálat eredményei
- Platina fogyókúrás tabletták - Csökkenti a szív- és érrendszeri betegségek kockázatát. RSP Nutrition Quadralean - St
- Elhízás, ivás; Az egészségtelen étrend növeli a köszvény kockázatát - A reumatológus
- Az elhízás növeli a méhnyakrák kockázatát