A primer szklerotizáló cholangitis kezelése gyermekeknél
Trevor J Laborda
Utah Egyetem Gyermekgyógyászati Osztálya, Salt Lake City, UT 84113, Egyesült Államok
M Kyle Jensen
Utah Egyetem Gyermekgyógyászati Osztálya, Salt Lake City, UT 84113, Egyesült Államok
Marianne Kavan
Utah Egyetem Gyermekgyógyászati Osztálya, Salt Lake City, UT 84113, Egyesült Államok
Mark Deneau
Utah Egyetem Gyermekgyógyászati Osztálya, Salt Lake City, UT 84113, Egyesült Államok. [email protected]
Levelező szerző: Mark Deneau, MD, MSc, egyetemi docens, Utah Egyetem Gyermekgyógyászati Tanszéke, Salt Lake City, 81 North Mario Capecchi Drive, UT 84113, Egyesült Államok. [email protected]
Telefon: + 1-801-2133599 Fax: + 1-801-5877539
Absztrakt
Alap tipp: Ez a felülvizsgálat bizonyítékokon alapuló keretet nyújt az elsődleges szklerotizáló kolangitiszben szenvedő gyermekek endoszkópos és orvosi kezeléséhez.
BEVEZETÉS
Az elsődleges szklerotizáló cholangitis (PSC) egy krónikus gyulladásos betegség, amelyet kolesztázis, valamint az intrahepatikus és extrahepatikus epefa progresszív szűkítése és elpusztítása jellemez. A PSC ritka az általános gyermekpopulációban, előfordulási gyakorisága és előfordulása 0,2, illetve 1,5 eset/100000 gyermek. A PSC gyakori a gyulladásos bélbetegségben (IBD) szenvedő gyermekeknél, a fekélyes vastagbélgyulladásban szenvedő gyermekek legalább 10% -át érinti [1].
A PSC etiológiája összetett, genetikai és környezeti tényezőket egyaránt magában foglal. A „bél-máj tengely” mentén több rendellenességet azonosítottak, többek között az immunszabályozás, a máj- és az epe-védelem mechanizmusai, az epesav-anyagcsere, a mikrobiom és a bél permeabilitása hibáit. A betegek hepatobiliaris fibrózis, cirrhosis és végstádiumú májbetegség (ESLD) révén változó progresszióban szenvednek, a kolangiokarcinóma (CCA) kockázata jelentősen megnő. A gyermekgyógyászatban a PSC legtöbb esete kezdetben komplikációk nélkül jelentkezik. Kevesebb, mint 5% -uknál van diagnosztizálva ESLD vagy domináns biliaris szűkület (DS). A diagnózis felállításától számított tíz éven belül a gyermekek 50% -ánál jelentkeznek klinikai szövődmények, köztük 30% -uknál májtranszplantációra van szükség [2].
Jelenleg nincs olyan orvosi terápia, amely késleltetheti a májbetegség progresszióját vagy a klinikai szövődmények megjelenését a PSC-ben. A betegségről a hepatológia egyik legnagyobb kielégítetlen igényét ismerik el [3]. Az urzodeoxikolsavat (UDCA) és az orális vankomicin terápiát (OVT) széles körben alkalmazzák gyermekeknél, de a PSC lassan progresszív jellege akadályozta a kellő erejű klinikai vizsgálatokat. A fejlett endoszkópia fontos szerepet játszik a PSC palliatiójában, az endoszkópos retrográd kolangiopancreatográfiára (ERCP) gyakran szükség van az epe szűkületének sztenteléséhez és ballonos dilatációjához. Az LT továbbra is az egyetlen lehetőség az ESLD-ben szenvedő PSC-betegek számára [4]. Itt áttekintjük a gyermekek PSC-jének gyakori és kialakulóban lévő kezelési stratégiáit, és azok szerepét a menedzsmentben a legújabb irodalom alapján.
URSODEOXIKOLSAV
A PSC patogenezisének egyik aspektusa a kóros epesav-medence [5-7]. A hidroPHOBIC epesavak hepatotoxikusak lehetnek, és a PSC-ben jelen lévő magas koncentrációk citotoxikusnak tűnnek az epefán. A PSC-betegeknél hiányozhat egy hatékony „hidrogén-karbonát esernyő” pufferréteg a kolangiociták és az epeüreg között [8], ami ezt a hatást fokozza. Az UDCA egy hidroprofil epesav, citoprotektív hatással, amely orálisan könnyen felszívódik. Az UDCA növeli az epe hidrofil epesavainak szintjét [9,10], és csökkenti a hisztokompatibilitású antigén megjelenítést a hepatociták részéről [11]. Az UDCA hatékony az epevezetékeket célzó primer biliaris cholangitisben szenvedő felnőtteknél [12,13]. A PSC-ben betöltött szerepe azonban ellentmondásos.
KEZELÉSI CÉLOK ÉS ENDPOINOK
A biomarkerek helyettesítő végpontként történő hitelesítésére van szükség a gyermekkori PSC-ben. Jelenleg nincs elfogadott helyettesítő végpont, amely megbízhatóan megjósolná a klinikai eredményeket a PSC-ben. Nincs hivatalos megállapodás arról, hogy mely biokémiai, radiográfiai vagy szövettani markerek jelentik a legjobban a remisszió igazolását vagy a beteg „alacsony kockázatú” vagy „magas kockázatú” rétegzését a májkimenetelre való progresszió szempontjából. A betegség aktivitásának helyettesítő markerének validálása kritikus fontosságú a klinikai vizsgálat tervezésében is. Mivel a PSC lassan, évek vagy akár évtizedek alatt halad előre, előnyösebb egy nagy klinikai vizsgálatot végrehajtani a biomarker normalizálódásának kimutatására hat hónap alatt, nem pedig a klinikai események csökkenése 5-10 év alatt.
2014-ben a Nemzetközi Elsődleges Szklerotizáló Cholangitis Tanulmányi Csoport egy Delphi-folyamatot indított a jelölt szubsztrát-végpontok azonosítására. Az ALP-t, a rezgésvezérelt tranziens elasztográfiát (VCTE), a máj szövettanát, az ALP-t és a máj szövettanát kombinációban, valamint a szérum teljes bilirubint választották a későbbi vizsgálatokhoz és validáláshoz [116]. A gyermekkori PSC-t azonban ebben a Delphi-folyamatban külön nem vették figyelembe, és az ALP nem hasznos biomarker a gyermekek májbetegségében. A normális ALP gyermekek és serdülők között nagyon eltérő. Az 500 NE/L feletti érték normális a 12-13 éves fiúknál és lányoknál a gyors növekedés és a csontforgalom miatt [117,118], és az ezres értékek normálisak a jóindulatú átmeneti hiperfoszfatémiában szenvedő kisgyermekeknél [119]. Az ALP májspecifikus izozimszintjének mérése a klinikai gyakorlatban nem rutinszerű. A gyermekgyógyászati klinikai gyakorlatban a GGT-szinteket rutinszerűen mérik. A GGT-nek nincs csontforrása, ami elkerüli a csontváz növekedésének zavaró hatását az ALP-vel.
Egyre több bizonyíték áll rendelkezésre a GGT mint jelölt helyettesítő végpont hasznosságáról a gyermekkori PSC-ben. A gyermekek PSC diagnosztizálásakor a GGT korrelál a hosszú távú kimenetelekkel, az ALP azonban nem [2]. A GGT-válasz párhuzamosan más markerekkel, beleértve az ALP-t is, a norursodeoxi-sav-sav klinikai vizsgálatában [7]. A GGT csökkenése egy év alatt hosszú távú eredményt jósolt a gyermekkori PSC-ben [24]. Az ALP és a GGT emelkedése a PSC-ben a kolesztázis és a relatív epeelzáródás és gyulladás hasonló jelenségét képviseli. Mint korábban leírtuk, amikor az ALP normalizálódik PSC-ben szenvedő felnőtteknél, a prognózis kiváló [21]. A GGT normalizálása tehát a gyermekek számára a legpraktikusabb kezelési célnak tűnik. Minél nagyobb a GGT csökkenése, az általános prognózis jobb, 75% -nál nagyobb csökkenés jelenti a legjobb választ. Azoknál a betegeknél, akiknél a GGT értéke kevesebb, mint 50 NE/L, a prognózis összességében a legjobb [24]. További kutatásokra van szükség az optimális GGT-válasz rövidebb időn belüli meghatározásához. A gyakorlatban a klinikai tapasztalatok azt sugallják, hogy az optimális GGT válasz 8-12 héten belül látható, a betegek ezen a ponton elérik a potenciális GGT legalacsonyabb szintjét, a folyamatban lévő terápiával alig vagy egyáltalán nem javulnak.
MÁJ TRANSZplantáció
Az LT az egyetlen hatékony terápia a PSC számára, amely végstádiumú májbetegségben szenvedő cirrhosissá vált. A PSC az LT egyik vezető indikációja, amely az összes LT 5% -át teszi ki az Egyesült Államokban [122]. A PSC-be történő átültetés utáni eredmények kedvezőek és összehasonlíthatók más gyermekkori májbetegségekkel, amelyeknél a beteg és az oltvány túlélése 5 év alatt meghaladja a 90% -ot [123, 124].
A máj- és epebélrák nem gyakori indikáció az LT számára gyermekeknél, de ezek az esetek előfordulnak. A gyermekkori PSC-betegek körülbelül 1% -ánál alakul ki CCA, elsősorban tizenéves férfiaknál. A neoadjuváns kemoradiáció, amelyet LT követ, kedvező eredményeket kínál a kiválasztott betegek számára [128], valószínűleg jobb, mint a transzplantáció nélküli primer műtéti reszekcióval elért eredmények. Gyermek PSC-betegek nagy csoportjában nem voltak megerősített hepatocelluláris karcinóma esetek [2], de elméletileg ez a kockázat fennáll bármely krónikus májbetegség esetén. A műtéti tervezés elősegítése érdekében erősen ajánlott konzultáció az LT-ben tapasztalt beutalóközponttal hepatobiliaris rákos megbetegedések előtt, mielőtt bármilyen helyi reszekciós műveletet elvégeznének.
Az LT a PSC-ben egyedülálló perioperatív szempontokkal rendelkezik. Sok betegnél a transzplantáció előtt visszatérő bakteriális kolangitis fordul elő, ismételt vagy krónikus expozícióval széles spektrumú antibiotikumokkal szemben. Különösen aggasztóak a multirezisztens szervezetek. Ezen túlmenően, a PSC-ben szenvedő gyermekeknél az együttesen fennálló IBD és autoimmun hepatitis magas aránya miatt sok beteg immunszuppresszív gyógyszerekkel transzplantálódik, ami további kockázatot jelent az opportunista és atipikus fertőzések kialakulásához. Az OVT gyermekek PSC-ben történő fokozódó alkalmazásával ügyelni kell a betegek VRE-szűrésére. A fertőzéses megbeszélés ajánlott az optimális perioperatív antimikrobiális profilaxis meghatározásához.
Az LT-t körülvevő IBD kezelése a PSC számára összetett. Egyetlen immunszuppressziós protokoll sem bizonyult a leghatékonyabbnak az IBD pre-LT szabályozásában, és az elfogadott IBD kezelés a leggyakrabban ajánlott. Hasonlóképpen, az immunszuppressziós kezelési mód megválasztása az LT után bonyolult. Egyetlen adag sem hatékonyabb. A ciklosporin és az azatioprin védőhatásai voltak az IBD utáni LT-re a PSC számára, míg a mikofenolát és a takrolimusz károsak voltak [129]. Az amino-szalicilátok védőhatást nyújthatnak az IBD megismétlődéséből. Mindazonáltal annak ellenére, hogy a poszt-LT jelentős immunszuppresszióval jár, a betegek több mint 50% -ának aktív IBD-betegsége van, ami további terápiát igényel [130]. Továbbá nincs konszenzus az LT-hez kapcsolódó colectomia optimális időzítésével kapcsolatban. Míg az adatok arra utalnak, hogy a pre-LT kolektómia megakadályozhatja a PSC megismétlődését, nem állnak rendelkezésre megfelelő adatok a rutinos colectomiára utalva minden beteg esetében [131]. A colectomia időzítését személyre kell szabni, figyelembe véve az olyan tényezőket, mint a portális hipertónia súlyossága és a mögöttes IBD súlyossága. A diszplasztikus elváltozások jelenléte a vastagbélben abszolút javallat a kolectomia számára az LT előtt.
A transzplantáció elhunyt és élő donoroknál hasonló sikerrel történhet. Egyes adatok arra utalnak, hogy az élethez kapcsolódó adományozás túlélést jelenthet [132]. Ez összefüggésben lehet rövidebb várakozási időkkel és kevésbé betegekkel a transzplantáció idején, vagy immunológiai hasonlóságok és alacsonyabb PSC-kiújulás miatt. A Roux-en-Y choledochojejunostomia és a csatorna-csatorna biliáris anasztomózis hasonló egyéves páciens- és graft-túlélést mutatott meta-analízis során [133]. A PSC-betegeknél az LT után fokozott a vaszkuláris trombózis kockázata [134], és gondos posztoperatív megfigyelést és antikoaguláns profilaxist igényelnek.
A PSC gyakran ismétlődik (rPSC) az átültetett májban. Az rPSC-t akkor diagnosztizálják, amikor a PSC-szerű duktális elváltozások és kolesztázis a transzplantáció után legalább hat hónappal jelentkezik. Ügyelni kell arra, hogy a ductularis elváltozásokat kizárják az érrendszeri szövődményekből (májartéria-szűkület vagy trombózis), az anasztomotikus epe-szűkületeket és a CMV-fertőzéseket. Az rPSC a felnőtt transzplantált betegek 16% -ában fordul elő 6 éves mediánban [135]. Gyermekeknél az LT utáni ötéves visszatérési kockázat a PSC esetében 23%. A graft túlélése a kiújulás után gyenge: 53% öt év után [136]. A mögöttes etiológia ismeretlen, de a kapcsolódó kockázati tényezők közé tartozik a fiatalabb életkor a PSC diagnózis és/vagy a transzplantáció során, az IBD együttélése és a timoglobulin indukció [137]. Egy tanulmány kimutatta, hogy a rituximab megakadályozhatja a betegség kiújulását, ideértve az ABO-val nem kompatibilis LT adományt is [138]. Az rPSC megelőzése folyamatos vizsgálatot igényel, mint olyan tényezők, mint például a kolektómia (fentebb említettük), valamint az optimális indukciós és fenntartó immunszuppresszív kezelési rendek.
Az LT után a colorectalis carcinoma aránya különösen magas [139]. A vastagbélrák az összes transzplantált beteg közel 20% -ában fordul elő követés során. Az IBD-ben szenvedő LT betegeknek éves endoszkópos megfigyelésre van szükségük vastagbélrák miatt.
KÖVETKEZTETÉS
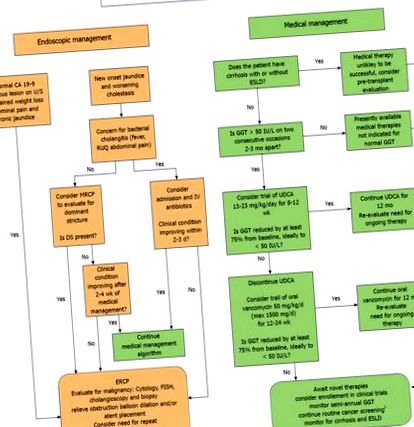
Jelenleg nincsenek külön irányelvek a PSC-ben szenvedő gyermekek kezelésére. Az adatok korlátozottak, és sok munkát kell elvégezni a következetesen hatékony terápia azonosítása és a kezelésre adott legjobb helyettesítő biomarkerek meghatározása érdekében. Legalább néhány beteg reagál az UDCA-ra vagy az OVT-re, és a PSC-ben szenvedő gyermekek túlnyomó többsége már kipróbálja az egyik vagy mindkét terápiát. Annak érdekében, hogy a szolgáltatóknak és a betegeknek keretet nyújtsunk a kezelés standardizált megközelítéséhez, javasoljuk, hogy a következő, 1. ábrán, 1. ábrán részletezett, tényeken alapuló kezelési algoritmust frissítsék, mivel az elkövetkező években további adatok állnak rendelkezésre.
Endoszkópos és orvosi menedzsment algoritmus a gyermekkori primer szklerotizáló kolangitishez. 1 figyelembe veszi a CA 19-9-et és a hasi ultrahangot 6-12 havonta minden 15 évesnél idősebb beteg esetében, és a felügyeleti kolonoszkópiát 1-2 évente minden esetben primer szklerotizáló cholangitis-gyulladásos bélbetegségben szenvedő betegeknél.
Lábjegyzetek
Összeférhetetlenségi nyilatkozat: A szerzők nem jelentenek összeférhetetlenséget.
Kézirat forrása: Meghívott kézirat
A szakértői értékelés megkezdődött: 2018. augusztus 29
Első döntés: 2018. október 8
Cikk a sajtóban: 2019. január 6
Specialitás típusa: Gasztroenterológia és hepatológia
Származási ország: Egyesült Államok
Peer-review jelentés osztályozása
A osztály (Kiváló): 0
B fokozat (nagyon jó): 0
C fokozat (jó): C, C
P- Ellenőr: Tenca A, Xia Q S- Szerkesztő: Cui LJ L- Szerkesztő: A E- Szerkesztő: Tan WW
Közreműködői információk
Trevor J Laborda, Utahi Egyetem Gyermekgyógyászati Klinika, Salt Lake City, UT 84113, Egyesült Államok.
M Kyle Jensen, Utah-i Egyetem Gyermekgyógyászati Osztálya, Salt Lake City, UT 84113, Egyesült Államok.
Marianne Kavan, Utah Egyetem Gyermekgyógyászati Osztálya, Salt Lake City, UT 84113, Egyesült Államok.
- Pajzsmirigy-kezelés nincs gyors javítás a gyermekek fogyása szempontjából - ScienceDaily
- A székrekedés kezelése gyermekeknél NIDDK
- Jelölje be a harapásokat a gyermekek kezelésében, tüneteiben és eltávolításában
- Kezelési programok túlsúlyos és elhízott gyermekeknél Hogyan lehet életmódot váltani ScienceDirect
- Hipoplasztikus és hipokalcifikált állandó molárisok kezelési lehetőségei gyermekeknél