A szelektív szerotonin újrafelvétel-gátló fluvoxamin testtömegre gyakorolt hatását Zucker patkányokban kortikotropin-felszabadító hormon közvetíti.
Absztrakt
Az agy szerotonin döntő szerepet játszik az étkezés és a testtömeg homeosztázisának szabályozásában. Korábbi adatok kölcsönhatásra utalnak a kortikotropin-felszabadító hormonral (CRH). Ezen neurotranszmitterek kölcsönhatásának további vizsgálatához intraperitoneálisan adták a szelektív szerotonin újrafelvétel-gátló (SSRI) fluvoxamint a fa/fa Zucker patkányok a CRH-receptor-antagonista α-helikális CRH-val és anélkül intracerebroventrikulárisan (i.c.v.) adták be. A sóoldattal kezelt állatok híztak. A fluvoxamin jelentős súlycsökkenéshez vezetett, miközben nem befolyásolta az étel bevitelét. Továbbá ebben az állatmodellben az inzulinszint csökkent a fluvoxamin beadását követően. Ezeket a hatásokat az a-helikális CRH antagonizálta, és ezért valószínűleg CRH vagy CRH-szerű peptidek közvetítik.
Bevezetés
A szelektív szerotonin-újrafelvétel-gátlókat (SSRI) általában depressziós rendellenességek esetén használják gyógyszerként. Ezekről a gyógyszerekről jól ismert, hogy központilag befolyásolják a táplálékfelvételt és a testtömeg homeosztázisát. Ez összhangban áll a kísérleti adatokkal, amelyek a szerotonin erős anorektikus tulajdonságait mutatják be, amikor a paraventrikuláris magba (PVN) és más hipotalamusz területekre injektálják őket. 1,2
Jelen tanulmányban az ssri fluvoxamin anorektikus tulajdonságaira összpontosítottunk, amely a szerotoninra specifikusabb, összehasonlítva e gyógyszercsoport más vegyületeivel, például a fluoxetinnel, kevésbé befolyásolva a noradrenalin újrafelvételét. 3
Korábbi adatok arra utalnak, hogy a PVN-en belül a szerotonin és a kortikotropin-felszabadító hormon (CRH) kölcsönhatásba lépnek az élelmiszer-bevitel megváltoztatásával, és a szerotonin-injekciót követően ebben a bizonyos magban fokozott CRH-szintézist mutattak ki. 4,5 Ezenkívül a szerotonin-felszabadító szer, a D-fenfluramin stimuláló hatását a CRN-t expresszáló sejtek neuronális aktiválására a PVN-ben kimutatták. 6 A CRH központilag injektálva egyértelműen anorektikus tulajdonságokkal rendelkezik. 7 A szerotonin neurotranszmitter és a CRH neuropeptid között ok-okozati összefüggést még nem bizonyítottak. Anorektikus hatásai mellett a CRH a rágcsálók szimpatikus idegrendszerének aktiválásával serkenti a barna zsírszövet anyagcseréjét, ha központilag alkalmazzák, 8,9 potenciálisan növelheti az energiafelhasználást.
Ban ben fa/fa Zucker-patkányok, a CRH2-receptor mRNS-je csökken a ventromedialis hipotalamuszban (VMH), ami arra utal, hogy a CRH-idegsejtek részt vehetnek a genotípus csökkent energiafelhasználásában; Ezen túlmenően ezeknél az állatoknál a hiperinzulinémia, amely a hasnyálmirigy vagális efferenseinek megnövekedett aktivitásának tulajdonítható, a 11 csökken a CRH VMH-ra történő helyi alkalmazása után.
Ennek a tanulmánynak az volt a célja, hogy tovább vizsgálja az agy szerotonin és CRH kölcsönhatásának jellegét a testtömeg szabályozásában, amelyet hosszú távon még nem vizsgáltak in vivo kísérlet.
Mód
A klór-hidrátot és az a-spirális CRH-t a Sigma Chemie-től (Deisenhofen, Németország) szereztük be. A fluvoxamin-maleátot a Solvay Duphar cégtől kaptuk. Az inzulint a Pharmacia és az Upjohn Diagnostics AB (Svédország) RIA 100 inzulinnal határoztuk meg.
Férfi homozigóta fa/fa patkányokat vizsgáltak Harlan-Winkelmann-ból (Borchem, Németország). A kísérlet kezdetén az állatok 12 hetesek voltak, súlyuk 300 és 400 g között volt. Az állatokat egyetlen ketrecekben tartottuk 23 ° C állandó szobahőmérsékleten, 12 órás világos és sötét ciklus alatt, és a műtét előtt legalább 4 napig hagytuk őket alkalmazkodni a tartási körülményekhez. Az α-helikális CRH és a fluvoxamin dózisait más szerzők 12 bizonyították hatékonynak, és egy kísérleti tanulmányunkban teszteltük őket.
Az állatokat négy kísérleti csoportba soroltuk: 1–0,5 ml sóoldat i.p. és 10 µl sóoldat iv., n= 7; 2. csoport - fluvoxamin i.p. (25 mg/testtömeg-kg 0,5 ml sóoldatban) és α-CRH i.c.v. (25 µg 10 µl sóoldatban), n= 5; 3. csoport - fluvoxamin i.p. (25 mg/testtömeg-kg 0,5 ml sóoldatban) és 10 µl sóoldat iv., n= 6; és a 4–0,5 ml sóoldat i.p. és a-CRH i.c.v. (25 µg 10 µl sóoldatban), n= 4.
A femorális artéria defektjét és a katéter beültetését végeztük a vérmintavételhez. Klór-hidrátot 0,4 g/testtömeg-kg dózisban adunk i.p. érzéstelenítésre. A műtét során a testhőmérsékletet szabályozott hővédő párna tartotta. Sztereotaxiás műszer segítségével egy üveg kapillárt helyeztünk a bal oldali kamrába injekció céljából. A szükséges koordinátákat a Paxinos és Watson atlaszból vettük. Az első posztoperatív napon a kísérleti állatokat egy speciális ketrecbe helyezték, amely zavartalan hozzáférést biztosít a patkányhoz. 30 perces adaptációs periódus után szérummintát vettünk a kiindulási inzulinérték meghatározásához, és az i.p. injekciót hajtottak végre. Az injekció beadása után a vérmintákat 30, 60, 90 és 120 perc múlva vettük. A kihúzott mennyiséget minden egyes gyűjtés után azonnal sóoldattal helyettesítettük; a vett vér összmennyisége nem haladta meg az 1,5 ml-t minden állatban. A mintákat azonnal centrifugáltuk; a szérumot összegyűjtötték és -70 ° C-on fagyasztották az inzulin elemzéséig.
Az állatok táplálékfelvételét és testtömegét a következő 7 napban dokumentálták. A patkányok testtömegét a műtét napján és a megfigyelési időszak alatt naponta egyszer 12 és 14 óra között mértük. A kísérleti állatok az i.p. és i.c.v. hét egymást követő napon reggel 8 órakor. A patkányokat 13:30 és 14:30 között leöltük, a világos/sötét ciklus világos fázisának közepén.
A statisztikai elemzéseket az SPSS, a Windows 8.0 verziójával végeztük. ANOVA ismételt mérésekhez nyers adatokon, 2 × 2 ANOVA normalizált adatokon. Tukey-é t-tesztet használtuk post hoc teszt az összehasonlításokhoz az ismételt mérések után ANOVA.
Eredmények
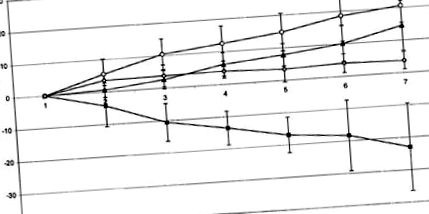
Az 1. ábra a testtömeg alakulását mutatja a kísérlet során. Míg az állatok sóoldat kombinációjával kezeltek, i. és sóoldat i.c.v. (1. csoport) a vizsgálat végén összesen 20,57 ± 5,63 g testtömeget nyert, az állatokat fluvoxaminnal kezelték i.p. és sóoldat i.c.v. (3. csoport) -22,97 ± 14,34 g súlycsökkenést mutatott. A fluvoxamin együttes beadása után i.p. és a-helikális CRH i.c.v. (2. csoport) az állatok súlygyarapodása részben helyreállt (14,47 ± 8,29 g). Az a-helikális CRH-val kezelt állatok i.c.v./saline i.p. (4. csoport) 3,74 ± 2,85 g-ot nyert a megfigyelési időszak alatt. Az 1., 2. és 4. csoport nem különbözött szignifikánsan egymástól, míg a 3. csoport súlycsökkenése szignifikánsan alacsonyabb volt a többi csoporthoz képest (P 1.ábra
A kumulatív táplálékfelvétel hasonló volt az 1–3. Csoportban (1. csoport; 42,55 ± 8,11 g; 2. csoport: 68,35 ± 33,98 g; 3. csoport: 56,82 ± 26,97 g), míg a 4. csoportban alacsonyabbnak találták (14,61 ± 6,0 g). A testtömeg-növekedés és a táplálékfelvétel aránya a különböző csoportokban szignifikánsan különbözött egymástól: 1. csoport: 0,5 ± 0,2, 2. csoport, 0,2 ± 0,2; 3. csoport, -0,4 ± 0,3; és a 4. csoport 0,3 ± 0,1. Annak ellenére, hogy a kizárólag fluvoxamint kapó csoportban 56,8 ± 27,0 g kumulált táplálékfelvétel történt, ez az arány egyértelműen alacsonyabb volt, mint a többi csoportban (α = 0,048–0,002). Ezenkívül a perifériás (fluvoxamin/sóoldat) és a központi (a-CRH/sóoldat) kezelés szignifikáns kölcsönhatását figyelték meg az összes csoportban.
Fluvoxamin beadása után i.p. sóoldattal i.c.v. A szérum inzulin hozzávetőlegesen 30% -os csökkenését figyelték meg (1. táblázat), összehasonlítva az i.p. és i.c.v. A fluvoxamin együttes beadását követően i.p. és a-helikális CRH iv., az ssri hatása egyértelműen csökkent és a szérum inzulin stabil maradt az alapértéknél. A sóoldat beadása i.p. és a-helikális CRH i.c.v. nem volt hatással a szérum inzulin koncentrációira.
Vita
A bazális hiperinzulinémia a fa/fa A Zucker patkányokat a fokozott paraszimpatikus kiáramlás magyarázza az endokrin hasnyálmirigybe 2,20, és ezt iv. a CRH beadása. 13 Adataink egyértelműen alátámasztják azt az elképzelést, hogy a fluvoxamin inzulinszekrécióra gyakorolt hatása a CRH révén közvetített, mivel az α-helikális CRH legalább részben felszámolta őket.
Összefoglalva, kísérleteink eredményei egyértelműen azt sugallják, hogy a CRH vagy CRH-szerű peptidek erősen részt vesznek a testtömeg szerotoninerg szabályozásában.
Hivatkozások
Leibowitz SF. A hipotalamusz viselkedési vizsgálata. In: Morgane PJ, Panksepp J (szerk.). A hipotalamusz kézikönyve 1. kötet, A. rész: Marcel Dekker: New York 1980 299–437.
Leibowitz SF, Brown LL. Agyi neurotranszmitterek és étvágyszabályozás Psychopharmac Bull 1980 21: 412–418.
Jordan S, Kramer GL, Zukas PK, Moeller M, Petty F . In vivo biogén amin kiáramlás a mediális prefrontális kéregben, imipraminnal, fluoxetinnel és fluvoxaminnal Szinapszis 1994 18.: 294–297.
Laflamme N, Bovetto S, Richard D, Rivest S. A dexfenfluramin hatása a CRF és 1-es típusú receptorának transzkripciós aktiválódására a patkány hipotalamusz paraventricularis magjában Br J Pharmac 1996 117.: 1021–1034.
Bovetto S, Rouillard C, Richard D. A CRF szerepe az 5-HT-receptor agonisták táplálékfelvételre és anyagcserére gyakorolt hatásában Am J Physiol 1996 271: R1231–1238.
Kamradt MC, Van de Kar LD, Gray TS. A D-fenfluramin szerotonin-közvetített Fos-expressziót indukál a kortikotropin-felszabadító faktor és a hipotalamusz oxitocin-neuronjaiban, és szerotonin-független fos-expressziót az amygdala enkefalin- és neurotenzin-neuronjaiban. Idegesség 1999 90: 851–858.
Hotta M, Shibasaki T, Yamauchi N, Ohno H, Benoit R, Ling N, Demura H. A kortikotropin-felszabadító faktor krónikus központi alkalmazásának hatása az élelmiszer-bevitelre, a testtömegre és a hipotalamusz – hipofízis – mellékvese hormonokra Life Sci 1991 48: 1483–1491.
Rohner-Jeanrenaud F, Walker CD, Greco-Perotto R, Jeanrenaud B. A központi kortikotropin-felszabadító faktor beadása megakadályozza a genetikailag elhízott túlzott testtömeg-növekedést (fa/fa) patkányok Endokrinológia 1989 124: 733–739.
Egawa M, Yoshimatsu H, Bray GA. A stresszválaszok központi szabályozása: az autonóm idegrendszer és a zsigeri működés szabályozása kortikotropin-felszabadító faktor-41 segítségével Am J Physiol 1991 260: R328 – R334.
Richard D, Rivest R, Naimi N, Timofeeva E, Rivest S. A kortikotropin-felszabadító faktor és receptorainak expressziója a sovány és elhízott Zucker patkányok agyában Endokrinológia 1996 137: 4786–4795.
Rohner-Jeanrenaud F, Hochstrasser AC, Jeanrenaud B. Preobese és elhízott hyperinsulinemia fa/fa patkányok részben vagus ideg közvetített Am J Physiol 1983 244: E317 – E322.
Krahn DD, Gosnell BA, Grace M, Levine AS. A CRF antagonista részben megfordítja a CRF és a stressz által kiváltott hatásokat a táplálkozásra Brain Res Bull 1986 17.: 285–289.
Paxinos G, Watson C. . A patkány agy sztereotaxiás koordinátákban Academic Press: San Diego, Kalifornia 1986
Schulz C, Lehnert H. Noradrenerg neuronok aktiválása a locus coeruleusban kortikotropin-felszabadító faktor segítségével - mikrodialízis vizsgálat Neuroendokrinológia 1996 63: 454–458.
Barna MR, szürke TS, Fisher LA. Kortikotropin-felszabadító faktor receptor-antagonista: hatások a vegetatív idegrendszerre és a kardiovaszkuláris működésre Regul Pept 1986 16.: 321–329.
Heinrichs SC, Pich EM, Miczek KA, Britton KT, Koob GF. A kortikotropin-felszabadító faktor antagonistája közvetlen neurotrop hatással csökkenti az érzelmeket a társadalmilag legyőzött patkányokban Brain Res 1992 581: 190–197.
Lehnert H, Schulz C, Dieterich K. Az agyban a kortikotropin-felszabadító faktor akcióinak fiziológiai és neurokémiai szempontjai: a locus coeruleus szerepe Neurochem Res 1998 23: 1039–1052.
Krahn DD, Gosnell BA, Grace M, Levine AS. A CRF antagonista részben megfordítja a CRF és a stressz által kiváltott hatásokat a táplálkozásra Brain Res Bull 1986 17.: 285–289.
Rothwell NJ és Lee FR. Termogenezis, barna zsírszövet és dexfenfluramin állatkísérletekben Int J Obes Relat Metab Disord 1992 16.: (3. kiegészítés): S67 – S71.
Egawa M, Yoshimatsu H, Bray GA. A kortikotropin-felszabadító hormon preoptikus területinjekciója stimulálja a szimpatikus aktivitást Am J Physiol 1990 259: R799 – R806.
Köszönetnyilvánítás
A fluvoxamint a Pharmacia & Upjohn, Svédország szerezte. Az állatokra és gondozásukra vonatkozó kísérleti protokollok összhangban voltak a német törvényekkel, és az állatgondozási bizottság jóváhagyta őket. Minden kísérlet megfelelt a humánus állatgondozás legmagasabb követelményeinek.
Szerzői információk
Hovatartozások
Endokrinológiai és Metabolizmus Tanszék, Otto-von-Guericke Egyetem, Magdeburg, Németország
I Wieczorek, C Schulz és H Lehnert
Szülészeti és Nőgyógyászati Tanszék, Göttingeni Georg-August Egyetem, Németország
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
A PubMed Google Scholar alkalmazásban is kereshet erre a szerzőre
- A laktáció hatása az energia- és fehérjefogyasztásra, a szülés utáni testsúly változására és a testre
- Victoria Beckham diéta, súly, életkor, magasság, testméretek - 2018
- Téli súlygyarapodás A hideg hőmérséklet miatt valóban teste zsírraktár
- Victoria Beckham Súlymagasság Teststatisztika Méret, Cím Telefon E-mail, Hobbi Kedvenc dolgai;
- A paradicsom csökkenti a testsúlyt Az elhízás ellensége