A veleszületett nyiroksejtek a védelemben, a patológiában és az adaptív immunitásban az apicomplexan fertőzés során
Daria L. Ivanova
1 Molekuláris biológia, Wyomingi Egyetem, Laramie, WY, Egyesült Államok
Stephen L. Denton
1 Molekuláris biológia, Wyomingi Egyetem, Laramie, WY, Egyesült Államok
Kevin D. Fettel
1 Molekuláris biológia, Wyomingi Egyetem, Laramie, WY, Egyesült Államok
Kerry S. Sondgeroth
2 Állatorvos-tudományok, University of Wyoming, Laramie, WY, Egyesült Államok
Juan Munoz Gutierrez
3 Mikrobiológia, immunológia és patológia, Állatorvostudományi és Orvostudományi Főiskola, Colorado Állami Egyetem, Fort Collins, CO, Egyesült Államok
Berit Bangoura
2 Állatorvos-tudományok, University of Wyoming, Laramie, WY, Egyesült Államok
R. Dunay Ildiko
4 Gyulladás- és neurodegenerációs intézet, Otto-von-Guericke Universität Magdeburg, Magdeburg, Németország
Jason P. Gigley
1 Molekuláris biológia, Wyomingi Egyetem, Laramie, WY, Egyesült Államok
Absztrakt
Bevezetés
Az Apicomplexa a protozoon paraziták nagy családja, amelyek a melegvérű állatok intracelluláris parazitái. Szinte mindegyiket az egész világon az embereket és az állatállományt fenyegető jelentős egészségügyi fenyegetésnek tekintik. Ide tartoznak, de nem kizárólag, a Toxoplasma gondii (T. gondii), a Plasmodium spp., A Cryptosporidium spp., Az Eimeria spp. És a Babesia spp. Mások léteznek, de ez az áttekintés a fent felsorolt nemzetségekre összpontosít. Általában vektoros vagy orálisan terjedő kórokozókra oszthatók. Az apikomplexek genommérete csökkent a magasabb eukariótákhoz képest, de többféle effektor fehérjét kódolnak, amelyek lehetővé teszik számukra, hogy nagyon összetett kapcsolatot alakítsanak ki gazdáikkal, és hozzájáruljanak a virulenciához. A vektor által hordozott apicomplexans közé tartozik a szúnyogok által terjesztett Plasmodium spp. és a kullancs által hordozott Babesia spp. A szájon át fertőző apikomplexek közé tartozik a T. gondii, a Cryptosporidium spp. és az Eimeria spp. Plasmodium spp. megfertőz
200 millió ember és évente körülbelül 400 000 ember hal meg (1). Babesia spp. az emberek újonnan megjelenő parazita fertőzése (2, 3). A Toxoplasma gondii megfertőz
Az emberek 30% -a világszerte, és az élelmiszer-eredetű megbetegedések harmadik fő oka az Egyesült Államokban (4). Átlagosan 750 000 új eset fordul elő Cryptosporidium spp. évente csak az Egyesült Államokban, és a parazita világszerte elterjedt (5). Eimeria spp. a fertőzések pusztítóak lehetnek a csirke- és marhahús-gazdaságokban, de nem tűnik fertőzőnek az emberek számára (6). Ezen protozoon paraziták közül sok problémás lehet a károsodott immunrendszerrel rendelkező emberek számára, különösen a HIV/AIDS szenvedők számára. Ezenkívül immunképes egyéneknél e fertőzések többsége jelentős szöveti morbiditást és patológiát okozhat, ami hosszú távú károsodást okozhat a gazda számára. A T. gondii fertőzés esetében egyre több bizonyíték van arra, hogy a tartós fertőzés hozzájárulhat a pszichiátriai rendellenességekhez és a neurodegeneratív rendellenességekhez (7). Ezért fontos e kórokozók elleni védekezésben szerepet játszó immunfaktorok, valamint az immunopatológiához hozzájáruló tényezők jobb megértése a gyakori fertőzések által okozott negatív egészségügyi eredmények csökkentése érdekében.
Az apikomplexek immunszabályozása nagyban függ az adaptív immunitás indukciójától az 1-es típusú T segítő (Th1) válaszon keresztül és az IFNy (8) termelésétől. A Th1 válasz mellett IL-17 termelés és a kapcsolódó gyulladás is indukálódik (9–12). Sok esetben úgy tűnik, hogy ez a Th17 válasz hozzájárul az ezen fertőzésekhez kapcsolódó immunpatológiához. A Th1 vagy Th17 válasz kialakulásához veleszületett immunsejteket kell kiváltani, hogy előállítsák azokat a citokineket, amelyek fontosak annak irányításában, hogy mely típusú T helper válaszok alakulnak ki. Összehasonlítva a vírusfertőzésekkel, ahol sok minden ismert a veleszületett immunsejt-összetételről és arról, hogy ezek a sejtek hogyan működnek a védelemben és az immunopatológiában, kevésbé ismert az apicomplexan-fertőzés összefüggésében. Aktív kutatási területek vannak a protozoon fertőzéssel kapcsolatos ismeretek bővítésére, beleértve annak megértését, hogy a veleszületett immunválaszok miként járulnak hozzá a kontrollhoz, okoznak patológiát és befolyásolják az adaptív válaszok kialakulását. Azonban továbbra is jelentős hiányosságok vannak a protozoon fertőzések során toborzott és aktivált összes veleszületett immunsejtpopuláció megértésében, valamint abban, hogy mindegyiküknek milyen szerepe van a védelemben, patológiát okozva és/vagy adaptív immunválaszokat szabályozva.
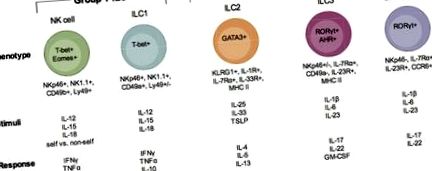
Az ILC részhalmazok leírása. Az ILC-nek három csoportja van, az 1. csoport ILC, a 2. csoport ILC és a 3. csoport ILC. Ezen csoportok mindegyikén belül a sejtek alcsoportjai vannak feltüntetve (1. csoport: NK sejtek és ILC1; 2. csoport: ILC2; 3. csoport ILC3 és LTi-szerű ILC3). Mindegyik ILC-t a fejlődésük és működésük szempontjából fontos transzkripciós faktorokkal, a felületi fenotípusukkal, az ismert módon aktiváló ingerekkel és az aktiválásukkor és a fertőzésre reagálva képződő immunfaktorokkal szemléltetik.
1. csoport ILC
2. csoport ILC
3. csoport ILC
ILC plaszticitás
Az ILC altípusok közötti határ pontosabban meghatározódott, azonban, amint azt a fentiekben megjegyeztük, az ILC nagyon képlékeny, és az általuk tapasztalt környezettől függően képesek egymásra átalakulni (23). Például bizonyos gyulladásos körülmények között az ILC2 és az ILC3 képes expresszálni a T-bet, és Th1 citokineket termel (27, 29, 33). Amikor a körülmények megengedik, ezek az újonnan létrehozott ILC1 visszaalakulhatnak ILC2 és ILC3 alakúra. Ez a sejtplaszticitás valószínűleg elengedhetetlen a kórokozókkal szembeni optimális válaszok kialakításához és a szövetek integritásának fenntartásához. Az ILC változatosság ezen új felértékelődése miatt nem határozták meg jól, hogy a különböző ILC populációk hogyan vesznek részt az apicomplexan fertőzés elleni immunitásban. Ezután megvitatjuk, mi ismert jelenleg az ILC-kről ezen parazita fertőzések során, és kiemeljük azokat a helyzeteket, ahol különböző ILC-k lehetnek érintettek. Megbeszéljük azt is, hogy a különböző ILC-k hogyan kapcsolódhatnak az adaptív immunitáshoz ezekhez a kórokozókhoz.
ILC és Toxoplasma gondii
Kevés tanulmány vizsgálta, hogy az NK-sejtek parazitafertőzése befolyásolja-e viselkedésüket (47–49). Az NK-sejtek parazitálhatók, azonban ez nagyon alacsony gyakorisággal fordul elő in vitro és in vivo. Ezek a fertőzött NK-sejtek hipermotilitási fenotípust és hibás funkciót mutatnak. Egy nemrégiben végzett tanulmány azt mutatja, hogy a fertőzött NK-sejtek nem járulnak hozzá az egerekben a parazita terjesztéséhez (47). Így az NK-sejtek közvetlen parazitafertőzése hogyan befolyásolja a betegség lefolyását, és nem szükséges tovább vizsgálni.
Még mindig sok a nyitott kérdés az ILC-k és a T. gondii fertőzés különböző populációinak szerepéről. Az egyes ILC altípusok fontosságát nem sikerült teljes körűen kezelni, és vannak olyan kérdések az NK-sejtekkel kapcsolatban, amelyeket újra meg kell vizsgálni, mivel a fertőzés összefüggésében megnő a különböző ILC-alcsoportok ismerete. A T. gondii fertőzés során az ILC-ket vizsgáló számos tanulmány a fertőzés akut stádiumára összpontosított. Jelentőségük a parazita hosszú távú védekezésében még mindig nem egyértelmű, különösen a krónikus T. gondii fertőzés és a központi idegrendszer esetében, amely laboratóriumunk jelenlegi fókusza.
ILC és plazmodium
Egerekben lép-, máj- és perifériás NK (NK1.1 +) sejtek IFNγ és TNFα termelésével védenek a maláriafertőzés korai stádiumai ellen (59–62). Az anti-ASGM1 kezelés és az NK sejtek kimerülése után az IFNγ termelés csökkenése és a parazitémia növekedése volt megfigyelhető egerekben (59, 60). Emberben úgy gondolják, hogy az NK-sejtek az első sejtek, amelyek a fertőzés során IFNy-t termelnek (1, 58). Az emberi NK-sejtek (CD56 +) IFNy-t és TNFa-t termelnek a Plasmodium falciparum fertőzés után (63–65). Humán NK-sejtek (IFNy-t képesek termelni plazmodiummal fertőzött vörösvértestekkel történő stimulálás után in vitro (66). Az IFNy-termelés mellett a perifériás vér NK-sejtjeiről úgy gondolják, hogy citotoxikusakként stimulálják a parazitafertőzést (67, 68). sejtek citotoxikus molekulákat szabadítanak fel, ha fertőzött hepatocitákkal és eritrocitákkal in vitro tenyésztik őket. Megfigyelték, hogy az NK sejtek közvetlenül lépnek kölcsönhatásba a fertőzött eritrocitákkal, konjugátumokat képezve (66, 69, 70). Az emberi NK sejtekről kimutatták, hogy elpusztítják a fertőzött eritrocitákat (71). Az NK sejtspecifikus citotoxicitás fontos a parazita elleni védekezésben, az in vivo még mindig nem egyértelmű, és hivatalosan még tesztelni kell a fertőzés egérmodelljeiben vagy az emberekben.
Egy másik nyitott kérdés, amelyet még nem vizsgáltak a Plasmodium spp. fertőzés az, hogy az ILC populációk képesek-e és hogyan szabályozni az adaptív immunválaszokat. Az ILC-k pozitívan és negatívan is szabályozhatják az adaptív immunitást. Az NK-sejt IFNy segíthet a T-sejtek reakcióinak kitöltésében a Plasmodium spp során. fertőzés (72). A T. gondii fertőzés során az NK sejtek és/vagy más ILC termelnek IL-10-et (55, 56). Ez az NK-sejt IL-10 negatívan szabályozhatja az immunparatológiát valószínűleg megakadályozó parazita elleni adaptív immunválaszt. Egy nemrégiben végzett tanulmány bebizonyította, hogy az egerek IL-15 komplextel (IL-15C) történő kezelése stimulálja az NK-sejteket IL-10 termelésére a Plasmodium berghei ANKA fertőzés során (93). Ennek az NK-sejtnek az IL-10 volt szükséges a CM elleni védelemhez. Akár NK sejt, akár más ILC IL-10 termelés a Plasmodium spp. a fertőzés hatással van a Plasmodium spp. a fertőzés további fontosságú lesz.
ILC és Cryptosporidium
ILC és Eimeria
ILC és Babesia
Hogy más ILC-k reagálnak-e és szerepet játszanak-e a Babesia spp. fertőzés nem ismert. Ennek a fertőzésnek a helye (vér és lép) miatt azonban más ILC kevésbé lehet fontos a fertőzés szempontjából. Érdekes módon a Babesia spp. a jelek szerint túlnyomórészt Th1 választ vált ki, mivel az IL-17 és IL-22 szintek nem változtak szignifikánsan a fertőzés egérmodelljében (2). Az ILC részhalmazainak részletesebb vizsgálatára lesz szükség ahhoz, hogy teljes mértékben értékeljük e sejtek szerepét a Babesia spp elleni immunitásban. fertőzés. Ez magában foglalja azokat a vizsgálatokat, amelyek feltárják, hogy az ILC hogyan képes pozitívan és negatívan befolyásolni az adaptív immunválaszokat.
ILCS és Apicomplexa következtetések és jövőbeli irányok
Szerző közreműködései
JG megfogalmazta a felülvizsgálatot. JG, DI, SD és KF írta az értékelést. JG, DI, SD, KF, KS, JM, BB és ID segítettek az értékelés szerkesztésében.
Összeférhetetlenségi nyilatkozat
A szerzők kijelentik, hogy a kutatást bármilyen kereskedelmi vagy pénzügyi kapcsolat hiányában végezték, amely potenciális összeférhetetlenségként értelmezhető.
Lábjegyzetek
Finanszírozás. Ezt a munkát az American Heart Association (AHA 17GRNT33700199) és az NIH Wyoming INBRE DRPP P20 GM103432 támogatásai támogatják, amelyeket JG és NIH Wyoming INBRE végzős hallgató GA kapott DI-nek. Ezt a projektet részben az Országos Általános Orvostudományi Intézet (2P20GM103432) támogatása támogatja a Nemzeti Egészségügyi Intézet részéről. A tartalom kizárólag a szerzők felelőssége, és nem feltétlenül képviseli a Nemzeti Egészségügyi Intézet hivatalos nézeteit.
- A simaizomsejtekből származó 130 kDa sejtfelszíni LDL-kötő fehérje azonosítása részben
- HIV-fertőzés jelei, tünetei és szövődményei
- Hookworms és Hookworm fertőzés tünetei, kezelése, megelőzése
- A hízósejtfüggő természetes immunitás károsodása a komplement C3-hiányos egerekben Természet
- Keratin komplex kezelés Coppola N95 KN95 koronavírus maszk, légzőkészülék a vírusvédelem érdekében