A pitvarfibrillációs abláció okozta nyelőcső-sérülést szenvedő pitvarfibrillációs betegek jellemzői
Tárgyak
Absztrakt
A nyelőcső bal pitvari hátsó falához való közvetlen közelsége a nyelőcsövet termikus sérülésre hajlamosítja a pitvarfibrilláció (AF) katéter ablációja során. Ebben a retrospektív vizsgálatban az AF katéter ablációja által okozott nyelőcső sérülés (EI) kockázati tényezőinek vizsgálatát tűztük ki célul. Azokat a betegeket vonták be, akiknél 2013 júliusától 2018 júniusáig először végeztek AF-ablációt. A nyelőcsövet abláció során orális oldható kontraszt segítségével tették láthatóvá minden beteg esetében, és a betegek egy részét választották ki endoszkópos ultrahangvizsgálaton (EUS), hogy megbecsüljék az EI-t az abláció után. Az EI fokozatát Kansas City osztályba sorolták: 1. típus: erythema; 2. típus: fekélyek (2a: felszíni fekélyek; 2b: mély fekélyek); 3. típus: perforáció (3a: perforáció a pitvarokkal való kommunikáció nélkül; 3b: atrioesophagealis fistula [AEF]). 3852 beteg közül 236 beteg (61,5 ± 9,7 év; férfi, 69%) kapott EUS-t (EUS-csoport) és 3616-ot (63,2 ± 10,9 év; férfi, 61,1%) EUS-nélkül (No-EUS-csoport). Az EUS csoportban az EI 63 betegnél fordult elő (1-es típusú EI 35-ben és 2-es típusú EI 28-ban), és a nyomon követés során nem figyeltek meg 3-as típusú EI-t. A többváltozós logisztikai regressziós elemzés során az ablációs elváltozás és a nyelőcső közötti átfedés az EI független előrejelzője volt (esélyhányados, 21,2; 95% CI: 6,23–72,0; P
Bevezetés
Mód
Betegpopuláció
Intézményünkben 2013 júliusa és 2018 júniusa között első alkalommal katéteres abláción (rádiófrekvenciás vagy Cryo abláció) áteső, tüneti paroxizmális vagy perzisztáló AF-ben szenvedő betegeket átfogó adatbázisba vették fel, és összegyűjtötték és elemezték az eljárás indexét. A betegeket 2 csoportba soroltuk: endoszkópos ultrahangvizsgálattal (EUS csoport) és EUS nélkül (No-EUS csoport). Valamennyi módszert a vonatkozó irányelveknek és előírásoknak megfelelően hajtottuk végre. A vizsgálati protokollt a Sir Run Run Shaw Kórház intézményi felülvizsgálati testületei jóváhagyták, és minden betegetől írásos tájékoztatáson alapuló beleegyezést kaptak.
Pitvarfibrillációs ablációs eljárás
Transzesophagealis echokardiográfiát vagy bal pitvar (LA) komputertomográfiás (CT) vizsgálatot végeztek az ablációs eljárás előtt, hogy kizárják a bal pitvari trombusokat minden beteg esetében. 100 NE/kg intravénás heparint adtunk be sikeres transzszeptális szúrás után, amelyet 1000 NE/óra követett, függetlenül az orális antikoagulációs rendtől. Az eljárás során a betegek tudatos szedációt kaptak midazolám és folyamatos fentanil infúzió alkalmazásával, a szokásos protokollunknak megfelelően. A LET nem elérhető intézményünkben.
A PVI standard megközelítést jelentett minden betegnél. A rádiófrekvenciás (RF) ablációt 3 dimenziós elektroanatómiai térképészeti rendszer (CARTO; Biosense Webster, CA vagy NavX/Velocity; Abbott, St. Paul, MN) alkalmazásával hajtottuk végre. Kettős transzszeptális szúrás után az öntözött RF ablációs katétert és egy kör alakú leképező katétert helyeztek az LA-be. A rádiófrekvenciás energiát a PV ostiától 5–10 mm távolságra szállítottuk teljesítményszabályozási üzemmódban (35 W az elülső falnál és 25 W a hátsó falnál) az előzőekben leírtak szerint 10. Amikor a hátsó fal mentén átfedés volt az ablációs elváltozás és a nyelőcső között, módosított ablációt alkalmaztunk (teljesítmény ≤25 W és időtartam ≤15 másodperc) 11. Az operátorok belátása szerint további ablációs eljárásokat, például a perzisztens AF-hez tartozó Box-elváltozást hajtottak végre.
A krió ablációt 23/28 mm-es krioballonnal (Arctic Front Advance, Medtronic, Inc., Minneapolis, MN) 12 francia kormányozható hüvelyen (FlexCath, Medtronic, Inc.) keresztül körkörös belső lumen-leképező katéter/vezetőhuzal segítségével helyeztük el. (Achieve, Medtronic, Inc.). Egy-két 120-180 másodperces krioalkalmazást juttattunk el minden egyes PV-hez az idő vezérlésével a PVI-hez. Módosított ablációt alkalmaztunk (hőmérséklet ≥ −50 ° C és rövidebb időtartam [≤120 s, amikor a PVI-hez 60 percnél kevesebb idő volt]), amikor átfedés volt az ablációs elváltozás és a nyelőcső között A PVI-t folyamatosan értékeltük a kör alakú Achieve katéterrel a krioabláció során. Ha a PV két vagy több krio alkalmazás után is kapcsolatban maradt, akkor RF alkalmazást hajtottak végre a PVI elérése érdekében széles antrális kerületi ablációs technikával.
Átfedés az ablációs elváltozás és a nyelőcső lefolyása között
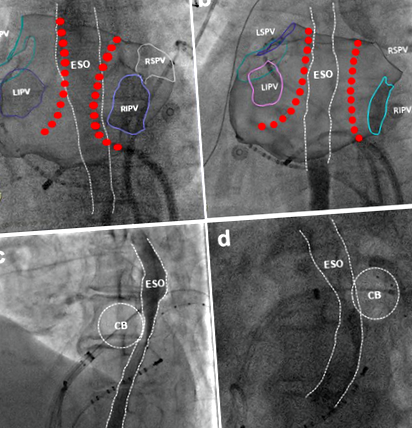
Az ablációs energia leadása előtt minden beteg orális oldható kontrasztot (5 ml) kapott a nyelőcső lefolyásának meghatározására fluoroszkópia alatt, és az ablációs elváltozást úgy tervezték, hogy minimalizálják az ablációs katéter és a nyelőcső közvetlen kapcsolatát A nyelőcső és a bal pitvari hátsó fal közötti térbeli kapcsolatot értékeltük a hátsó-elülső (PA) és a bal oldalsó (LL) vetületi nézetekben az RF abláció során, valamint két ortogonális vetületi nézetben a bal elülső ferde (LAO) és a jobb elülső ferde (RAO) krioabláció során. Amikor az ablációs elváltozás pontjai túl voltak a nyelőcső peremén (1A. Ábra), vagy a krioballon elülső fele a nyelőcső közelében volt a LAO alatt (1C. Ábra), meghatároztuk az ablációs elváltozások és a nyelőcső lefutásának átfedését (1. ábra).
Átfedés az ablációs elváltozás és a nyelőcső lefolyása között. A tervezett rádiófrekvenciás ablációs elváltozás (a, PA nézet) és anélkül (b, PA nézet) átfedésben vannak a nyelőcső lefolyásával. Cryo ablációs elváltozás (c, LAO nézet) és anélkül (d, LAO vies) átfedik a nyelőcső lefolyását. CB = krioballon; ESO = nyelőcső.
Nyelőcső endoszkópia és ultrahangvizsgálat
Az EUS elvégzéséről az operátorok döntése alapján döntöttek az EI 3,13,14,15,16,17 lehetséges kockázati tényezői, valamint az abláció utáni klinikai megnyilvánulások (például láz, mellkasi diszkomfort, emelkedett fehérvérszint) alapján. sejtszám és C-reakció fehérje szint).
Az EUS-t tapasztalt üzemeltetők végezték az EI nagyságának felmérése érdekében. Az EI-t úgy határoztuk meg, mint a nyelőcső és az LA közötti érintkezési területtel szomszédos bármilyen nyelőcsőelváltozást, és azt Kansas City besorolása szerint határoztuk meg: 1. típus: erythema; 2. típus: fekélyek (2a: felszíni fekélyek; 2b: mély fekélyek); 3. típus: perforáció (3a: perforáció a pitvarokkal való kommunikáció nélkül; 3b: perforáció atrioesophagealis fistulával) 18. Az összes gasztroszkópiát (GIFQ 260, GIFQ 165, GIFQ 145; Olympus, Japán) endoszkópos szakemberek végezték el egy endoszkópos laboratóriumban. A vizsgálathoz radiális echoendoszkópot (EU-ME2 PREMIER PLUS, Olympus, Japán) használtunk. A mediastinum és a nyelőcső falának alapos vizsgálatát végeztük el a nyálkahártya és a periesophagealis/mediastinalis elváltozások értékelésére. A betegeket az eljárás előtt legalább 8 órán keresztül éheztették. A vizsgálatokat a bal oldali decubitus helyzetben, és propofollal végzett tudatos szedáció mellett végeztük.
A nyelőcső sérülésének kezelése
Minden beteg rutinszerű lágy étrendet és protonpumpa inhibitorokat (PPI) kapott 6 hétig az AF abláció után. Az 1-es típusú EI-ben szenvedők félig szilárd étrendet kaptak, valamint PPI-t. A 2-es típusú EI-vel rendelkező betegek intravénás PPI-t kaptak, és éheztek addig, amíg az ismételt EUS nem mutatta az EI-t vagy javult az 1. típusú elváltozásban (2. ábra). Ha a várható gyógyulási idő meghaladta a 7 napot, a jejunal etetőcsövet helyeztük el.
A nyelőcső sérülése az endoszkópos ultrahangvizsgálattal kimutatott abláció után. Gasztroszkópiával kiderült a nyelőcső fekélyea1, fehér pont kör) 2 nappal a rádiófrekvenciás abláció után. Az ultrahangvizsgálat megmutatta a submucous rétegek architektúrájának megvastagodását és elvesztését (a2, fehér pont kör). A nyelőcső normál felépítéssel 10 nap múlva helyreállt (b1, b2, fehér pont kör).
Miután a 3. típusú EI gyanúja merült fel, kontraszt-fokozott CT-vizsgálatot végeztek. A 3. típusú EI-t akkor határoztuk meg, amikor a képalkotás a levegő vagy az orális kontrasztanyag extravazációját mutatta a nyelőcsőből a mediastinumba, a pericardiumba vagy az LA-ba. Amikor az AEF-t kizárták, az EUS-nek értékelnie kellett az EI nagyságát. Az esophagopericardialis fistulában (EPF) szenvedő betegeknél a széles spektrumú antibiotikumokkal és táplálkozási támogatással kiegészített kiegészítő kezelés mellett időben elvégezték a pericardiocentesis és a vízelvezetést. Az AEF diagnosztizálása után multidiszciplináris értékelésre került sor, és fontolóra vették a műtéti javítást.
Utánkövetés
Az AF-abláció utáni első 3 hónapban minden beteget 2 hetente, majd ezt követően 3 havonta követtek nyomon.
Statisztikai analízis
A folyamatos változókat átlag ± SD vagy mediánban fejezzük ki. ANOVA-t használtak a különböző csoportok összehasonlítására. A kategorikus változókat számlálásokként és százalékokként mutatjuk be, és összehasonlítottuk a csoportok között, adott esetben χ2 vagy Fisher pontos teszttel. A logisztikai regresszióhoz az eredményeket odds arányként, 95% konfidencia intervallumként és P értékek. P értékek
Eredmények
Betegpopuláció
Összesen 3852 betegnek esett át PVI az első AF-ablációra intézményünkben 2013 júliusa és 2018 júniusa között. Ezek közül 236 beteg (61,5 ± 9,7 év; férfi, 69,1%) szenvedett EUS-t az ablációt követő 3 napon belül (EUS-csoport) és 3616 beteg (63,2 ± 10,9 év; férfi, 61,1%) nem esett át EUS-n (No-EUS csoport, 3. ábra). Az EUS-csoportba tartozó betegek alacsonyabb BMI-vel és magasabb volt a magas vérnyomás és a cukorbetegség aránya, mint a nem EUS-csoportba tartozó betegeknél (1. táblázat).
A betegek kohorszának folyamatábrája elemezve és bevonva a vizsgálatba. EI = nyelőcső sérülés; EUS = endoszkópos ultrahangvizsgálat; Kansas City besorolás: 1. típus: bőrpír; 2. típus: fekélyek (2a: felszíni fekélyek; 2b: mély fekélyek); 3. típus: perforáció (3a: perforáció a pitvarokkal való kommunikáció nélkül; 3b: AEF).
Nyelőcső sérülés az EUS csoportban
Az EUS csoportban 236 betegnél végeztek AF ablációt 3 energiamóddal: 161 beteg (68,2%) RF-vel, 53 beteg (22,5%) Cryo-val és 22 beteg (9,3%) Cryo plus RF-vel. 236 beteg közül 150-nél (63,6%) volt átfedés az ablációs elváltozások és a nyelőcső lefolyása között, és 60 betegnél (40%) volt EI: 25 beteg 1-es típusú EI-vel és 35-es 2-es típusú EI-vel, míg 86 betegben nem volt átfedés az ablációs elváltozás között nyelőcső, 3 betegnél (3,5%) volt az 1. kategóriájú EI (P 2. táblázat Az endoszkópos ultrahangvizsgálaton átesett betegek jellemzői.
Nyelőcső sérülés a No-EUS csoportban
A No-EUS csoportban 3 616 beteg szenvedett AF ablációt 3 energiamóddal: 3227 beteg (89,2%) RF-vel, 331 beteg (9,2%) Cryo-val és 58 beteg (1,6%) RF-vel és Cryo-val. Összesen 2045 betegnél (56,6%) volt átfedés az ablációs elváltozások és a nyelőcső lefolyása között. Öt betegnél (0,14%) alakult ki a 3. kategória EI: 3 a 3a kategóriával (EPF) és 2 a 3b kategóriával (AEF, 3. táblázat). Mind az 5 beteg RF ablációt kapott, és átfedésben volt az ablációs elváltozás és a nyelőcső lefutása között. A három, EPF-ben szenvedő beteg közül 1 meghalt az AEF-re való progresszió következtében, miután titán klipszel lezárták az endoszkóppal (4. ábra), 2 pedig konzervatív kezelés után következmények nélkül gyógyult meg (5. ábra). AEF-ben szenvedő betegeknél 1 műtéten esett át, de szeptikus sokk miatt meghalt, 1 pedig 3 nappal a helyi kórházba való belépés után halt meg.
Haladás az oesophagopericardialis fistulától az atrioesophagealis fistuláig. A megnövekedett CT pneumopericardiumot mutatott ki (a1, nyíl) és a bárium-szulfát-szuszpenzió jelenléte a perikardiális zacskóban (a2, nyíl). A nyelőcső perforációjának endoszkópos lezárása titán kapcsokkal (b1,b2). A bal pitvarban lévő gáz (fehér pont kör), amelyet a CT dokumentált (c1) és az MRI által dokumentált többszörös agyi embólia (c2).
A nyelőcsőoperikardiális sipoly kialakulása az abláció után. A gasztroszkópia az esophagopericardialis fistula progresszióját mutatta ki 7 napig (a1) 14 nap (b1), 21 nap (c1) és 30 nap (d1) RF abláció után. Az ultrahangvizsgálat sűrű visszhangot mutatott ki a levegővel, ami helyi fistulaképződést jelzett (a2, fehér pont kör) és a nyelőcső szövetrétegének helyreállítása (b2,c2,d2).
Vita
A vizsgálat retrospektív megfigyelési vizsgálat volt, és a főbb megállapítások a következők: (1) Az ablációs elváltozás és a nyelőcső lefutása közötti átfedés az EI független előrejelzője; (2) Az EUS megakadályozhatja az EI progresszióját, és az EUS által irányított konzervatív kezelés alternatívát jelenthet az EPF kezelésében; (3) Továbbra is kihívást jelent a magas EI kockázatú betegek azonosítása.
A nyelőcső sérülésének előfordulása és előrejelzői
A legfrissebb tanulmány azt mutatta, hogy az AF-hez alkalmazott krioballon abláció, amelyet a PVI idő irányított, csökkentette a nyelőcső szövődményeit 19. Összhangban a krioballon ablációval kapcsolatos korábbi felméréssel, amelyben világszerte több mint 120 000 esetből összesen 11 AEF esetet jelentettek 20, adataink alátámasztották, hogy a krioballon ablációnál alacsonyabb az EI előfordulási gyakorisága, bár ez nem a fő célunk. Az abláció után számos jelet, például lázat, mellkasi kényelmetlenséget, megnövekedett WBC-számot és CRP-szintet okozhat hüvelyi idegkárosodás vagy gyulladásos reakció. Ezek a tényezők nem specifikusak voltak, és nem alkalmazhatók az EI magas kockázatának kitett betegek azonosítására.
Az AEF becsült előfordulási gyakorisága, 0,05% és 0,25% között 21, alulbecsülhető az aluljelentések vagy a téves diagnózis miatt. Halbfass tanulmánya kimutatta, hogy a nyelőcső perforációjához csak fekélyes EI társult 5. Annak ellenére, hogy a magas EI kockázattal járó betegeket EUS-re választották ki, 5 betegnél 3 típusú EI alakult ki az EUS nélküli csoportban, ami azt sugallja, hogy további vizsgálatokat indokol a 3-as típusú EI megbízható prediktorainak azonosítása érdekében.
A nyelőcső sérülésének kezelése
Habár az ablációtól származó EI pontos mechanizmusa nem teljesen ismert, úgy tűnik, hogy a nyelőcső fekély megelőzi az AEF 21,22 kialakulását. Halbfass vizsgálata azt mutatta, hogy a fekélyes EI körülbelül 10% -a a nyelőcső perforációjává vált 5. Tekintettel arra, hogy az abláció okozta sérülés „kívülről” befolyásolja a nyelőcsövet, és a nyálkahártya vizualizációja alul tudja képviselni az EI 18 tényleges nagyságát, vizsgálatunkban az EUS-t olyan betegeknél végeztük, akiknek nagy a kockázata az EI kialakulásának. Az EUS csoportban egyetlen fekélyes EI-ben szenvedő beteg sem lépett a 3. típusú EI-be az EUS által irányított agresszív kezelés következtében.
Korlátozások
Következtetések
A nyelőcső közelében végzett abláció növeli az EI kockázatát. Az EUS utáni abláció megakadályozhatja az EI progresszióját, és hasznos lehet a PEF konzervatív kezelésében. Továbbra is kihívást jelent az EI megbízható előrejelzőinek azonosítása.
- Egyidejűleg májgyulladással járó, kórosan elhízott, bariatrikus betegek klinikai jellemzői és eredménye
- A táplálkozási kihívások nyelőcső- és gyomor-nyelőcsőrákban szenvedő betegeknél - FullText -
- A lisztérzékenységben szenvedő betegek életminőségének különböző jellemzői - PubMed
- Olyan ételek, amelyek nem jók a thalassemiás betegek számára Dr
- Kiváló kezelés és gondozás Indiában a nyelőcső fekélye ellen