Anthelmintikus ellenállás az állatállományban
Írta: Morutse Mphahlele, Nthatisi Molefe, Ana Tsotetsi-Khambule és Thekisoe Oriel
Beküldve: 2019. március 11. Felülvizsgálat: 2019. május 29. Megjelenés: 2019. augusztus 26
Absztrakt
Kulcsszavak
- féreghajtó rezisztencia
- helminták
- állatállomány
- benzimidazolok
- imidazotiazolok
- makrociklusos laktonok
fejezet és a szerző információi
Szerzői
Morutse Mphahlele
- Környezettudományi és Gazdálkodási Osztály, Észak-Nyugati Egyetem, Dél-Afrika
Nthatisi Molefe
- Környezettudományi és Gazdálkodási Osztály, Észak-Nyugati Egyetem, Dél-Afrika
Ana Tsotetsi-Khambule
- Élet- és fogyasztótudományi tanszék, Mezőgazdasági és Környezettudományi Főiskola, Dél-afrikai Egyetem, Dél-Afrika
Thekisoe Oriel *
- Környezettudományi és Gazdálkodási Osztály, Észak-Nyugati Egyetem, Dél-Afrika
* Az összes levelezést címezze: [email protected]
A szerkesztett kötetből
Szerkesztette: Omolade Olayinka Okwa
1. Az állatokat megfertőző helminták
Az állatállomány a legelőkön különféle helmintákkal fertőződhet meg, a paraziták lárváinak a szennyezett füvön történő bevitele révén, amelyek közül a leggyakoribbak a gyomor-bélférgek és a foltok [1]. Magától értetődik, hogy a helminták állandóan problémásak voltak, és kétségtelenül régóta aggodalomra adnak okot, amely az állattenyésztési ágazatot fenyegeti [2], mivel ezek a paraziták negatív hatással vannak az állatok termelékenységére és jólétére, többek között befolyásolják a takarmányfelvételt, a növekedési ütemet és tejhozam [3]. A parazita férgek közé tartoznak a galandférgek, a gömbférgek, a tüdőférgek, a májfoltok, a gyűrűs férgek, a horogférgek és az ostorférgek. A GIT paraziták terjedése a legtöbb esetben meglehetősen közvetlen; a fertőző petesejteket vagy oocisztát az ürülékkel együtt adják át, amikor az állat ürül, a következő állat megfertőződik, ha a szennyezett területeken legelnek, és az emberek megfertőződhetnek a szennyezett étel és víz elfogyasztása és/vagy az emberek szoros interakciója révén a fertőzött állatok [4]. A parazita megbetegedésekkel járó éves költségeket Ausztráliában 1 milliárd dollárra [5], Brazíliában 7,11 milliárd dollárra [6] becsülik, és világszerte tízmilliárd dollárnak számítanak [5].
2. Kezelés és kontroll
2.1 Kemoterápia
A férgek elleni védekezés a legtöbb gazdaságban kizárólag anthelmintikus kezeléseken alapul, nem pedig az integrált stratégiákat felölelő kezelési gyakorlatokon. A jelenleg kapható féreghajtók különböző gyógyszerosztályokba tartoznak, azaz a makrociklusos laktonok (ML), a benzimidazolok (BZ), a tetrahidropirimidin-imidazotiazolok, az aminoacetonitril származékok (AAD) és a spiroindolok. Ezen gyógyszerosztályok vegyületei hatásosak a fonálférgek széles skálájával szemben, továbbá az ML-k számos ízeltlábú-parazita ellen hatásosak, míg a BZ-k néhány laposféregfajhoz képest is [7]. Az adatok azonban még a kezelés megfelelő beadása mellett is rámutatnak arra, hogy az anthelmintikumok alkalmazása még mindig drága módszer a parazita betegségek leküzdésére [5].
2.2 Különböző féreghajtó osztályok hatásmódjai
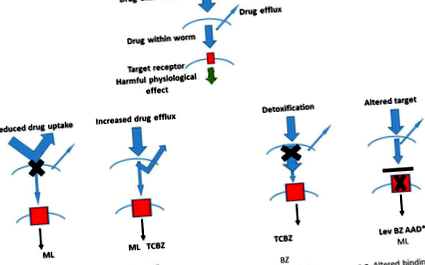
1.ábra.
Az alapvetően ismert féreghajtó rezisztencia útvonalak sematikus ábrázolása és azok relevanciája a jelenlegi anthelmintikus gyógyszerosztályok mindegyikében [8].
A széles spektrumú féreghajtók osztályai a benzimidazoloktól, az imidazotiazoloktól/tetrahidropirimidinektől és a makrociklusos laktonokig terjednek, de a szalicil-anilidek, fenol-helyettesítők és szerves foszfátok is népszerűek [13]. A széles spektrumú féreghajtókat gyakrabban használják a kérődzőknél, mert képesek nagyszámú parazita megszüntetésére, amellett, hogy könnyen beadhatók és biztonságosak a gazdák számára [14].
3. Anthelmintikus rezisztencia
Évtizedek óta féreghajtó szereket használtak a juh fonálféreg-parazitáinak elsődleges ellenőrző intézkedésként [15]. Az évek során azonban az állatokat megfertőző élősködő férgek folyamatosan és jelentősen fejlődtek ki AR-ban. Az anthelmintikus rezisztencia úgy határozható meg, mint a paraziták azon képessége, hogy túléljék a gyógyszerek olyan dózisait, amelyek általában megölik az azonos fajba és szakaszba tartozó parazitákat. Öröklődik, és azért választják ki, mert a kezelések túlélői géneket adnak át az ellenállóképesség utódaikra. Ezek a rezisztens gének kezdetben ritkák a populációban, vagy ritka mutációkként fordulnak elő, de a szelekció folytatásával a populációban való arányuk növekszik, ahogy a rezisztens paraziták aránya is [16].
A két újabb osztály, az aminoacetonitril-származékok és a paraherquamid-származékok ellenállása várhatóan következni fog [27]. Még mindig rendelkezésre állnak féreghajtók, de gyorsan kialakult számos gyógyszerrezisztens helmintörzs, és a termelőknek és az állategészségügyi szakembereknek most alternatív kezelési és megelőzési módszereket kell keresniük [28]. Az alábbiakban bemutatunk néhány, a világban jelentett anthelmintikus rezisztencia-esetet (1. táblázat).
| Dél-Afrika | Levamisole, morantel | Trich/Tel spp. | 1990 | [29] |
| Dél-Afrika | Benzimidazol, fenbendazol, rafoxinid, levamisol (BZ, SCL, IMID) | Haemonchus spp. | 1992–1996 | [30] |
| Dél-Afrika | Albendazol, closantel, ivermektin, levamisol (BZ, SCL, AVM, IMID) | Haemonchus spp., Trich/Tel spp. és az Oesophagostomum spp. | 2003 és 2013 | [31, 32] |
| Zimbabwe | Fenbendazol, albendazol, oxfendazol, levamisol (BZ, IMID) | Haemonchus spp., Cooperia spp. | 1997 és 2003 | [33, 34] |
| Zimbabwe | Fenbendazol, levamisol, rafoxanid (BZ, IMID, SCL) | Haemonchus spp. | 1997 | [35] |
| Zambia | Ivermektin, albendazol (AVM, BZ) | Haemonchus spp. | 2001 | [36] |
| Kenya | Ivermektin, fenbendazol (AVM, BZ) | Haemonchus spp., Trich/Tel spp. és az Oesophagostomum spp. | 1995 | [37] |
| Németország | Levamisol, ivermektin (IMID, AVM) | Trich/Tel spp. | 2012 | [38] |
| Norvégia | Albendazol (BZ) | Trich/Tel spp. | 2012 | [39] |
| Észak-Írország | Benzimidazol, moxidektin, avermektin, levamisol (BZ, MLB, AVM, IMID) | Trich/Tel spp., Cooperia spp. | 2013 | [40] |
| Svájc | Avermektin (AVM) | Haemonchus spp., Trich/Tel spp. | 2007 | [41] |
| Brazília | Ivermektin (AVM) | Haemonchus spp. | 2013 | [42] |
| India | Fenbendazol, benzimidazol, tiabendazol, tetramisol (BZ, IMID) | Haemonchus spp., Trich/Tel spp. | 2013, 2011 | [43], [44] |
Asztal 1.
Az anthelmintikus rezisztencia néhány esete.
BZ, benzimidazolok; ML, makrociklusos laktonok (AVM, avermektinek vagy MLB, milbemycin); nikotin-agonisták (IMID, imidazotiazolok vagy TETR, tetrahidropirimidinek); AAD, aminoacetonitril-származékok; SCL, szalicil-anilidek; Tel, Teladorsagia; Trich, Trichostrongylus
Sajnos az anthelmintikus rezisztenciát ma a status quo-nak tekintik a világ juhtermelő országaiban [45], és az Európában és Dél-Amerikában végzett ismételt keresztmetszeti vizsgálatok egyre rosszabb helyzetet mutattak, mind a multidrug, mind a fajok ellenállása egyre inkább gyakori [46, 47]. Bár nem elterjedt, két új hatóanyaggal, a monepantellel és a derquantellel szemben már kialakult a rezisztencia. Ez annak ellenére történt, hogy a spiroindolt - derquantelt - kombinált termékként forgalmazták az ellenállás kialakulásának lassítása érdekében [48]. Mindezek kiemelik az AR kialakulásával összefüggő kockázati tényezők azonosításának sürgős szükségességét, a jövőbeni ajánlások ismertetése érdekében a fenntartható paraziták elleni védekezésről [49].
4. Az AR kialakulásának kockázati tényezői
5. Anthelmintikus rezisztencia monitorozása
5.1 A széklet petesejt-csökkentési tesztje
Az állategészségügyi jelentőségű fonálférgek anthelmintikus rezisztenciájának kimutatásának fő módszere a széklet petesejt-csökkentési tesztje [55]. A FECRT-ben a juhok gyomor-bélférgességének populációi fogékonyak, ha a gyógyszer hatékonysága meghaladja a 95% -ot (a FECRT csökkenése). Ezzel szemben a rezisztencia akkor van jelen, ha a hatékonyság E = tojás + L 1 - L 1 tojás + L 1 × 100 E1
A második változatban a mikro-agar lárvafejlődési tesztet (MALDT) hajtjuk végre Coles és munkatársai által leírtak szerint. [57]. Ezt a tesztet 96 mikrotiteres üreges lemezeken is elvégzik. A tiabendazol/levamisol törzsoldatait úgy állítjuk elő, hogy a gyógyszereket előzetesen feloldjuk dimetil-szulfoxidban (DMSO), majd ezt követően desztillált vízben (1: 4) hígítjuk. A székletmintákból kinyert fonálféreg-tojásokat 7 napig inkubáljuk 27 ° C-on, 96 lyukú mikrotiterlemezeken a gyógyszeroldattal. A lemezeken normál esetben táptalaj lesz (élesztő kivonat Earle kiegyensúlyozott sóoldatával és fiziológiás sóoldatával), különféle tiabendazol/levamisol koncentrációjú vízi oldatban és a fonalférgesejtek meghatározott arányában. 7 nap elteltével az egyes üregekben a nem hámozott peték és az L1 – L3 lárvák számát fordított mikroszkóp alatt számoljuk meg. Ezután a diszkrimináló dózisban az L3 fejlődésének sebességét (0,02 és 0,5 μg/ml a tiabendazol és a levamisol esetében) a kontrollhoz viszonyítva használjuk, hogy meghatározzuk, hogy van-e rezisztencia; így az L1-től L3-ig fejlődő lárvák száma a 0,02 μg/ml tiabendazol és a 0,5 μg/ml levamisol megkülönböztető dózisában egyértelműen jelzi a rezisztenciát.
5.4 Molekuláris technikák alkalmazása AR monitorozáshoz
Napjainkban a hagyományos, főleg mikroszkópos parazitológiai diagnosztikai technikákat számos új, többnyire molekuláris jellegű technika és eszköz egészítette ki. A mai napig a hagyományos módszereket továbbra is rutinszerűen alkalmazzák annak ellenére, hogy munkaigényesek és időigényesek lehetnek [25]. Bebizonyosodott, hogy a PCR-alapú eljárások nagyobb érzékenységgel és specifikussággal rendelkeznek, mint a mikroszkópián és/vagy immundetektáláson alapuló „hagyományos” diagnosztikai megközelítések [65]. A ksenobiotikumokkal szembeni rezisztencia más modelljeivel végzett vizsgálatok kimutatták, hogy a migráció alapvető szerepet játszik például a rovarirtó rezisztens gének szúnyogokban való eloszlásában [66] és az antibiotikum-rezisztenciában egyes baktériumfajok között [67]. Vizsgálatok történtek a BZ-rezisztens allélok féregpopulációkban való eredetéről. Például az izotípusú 1-tubulin gén RFLP-vizsgálatait felhasználva megállapították, hogy a H. contortus különböző rezisztens populációiban különféle BZ-rezisztens allélok vannak [68]. Ugyanezt a megközelítést alkalmazva két BZ-rezisztens populáción azt is megállapították, hogy a BZ-rezisztens allélok valószínűleg már két H. contortus populációban jelen voltak, még mielőtt e gyógyszerosztály kifejlődött volna [69].
Mivel a kérődzőknél alkalmazott mind a három széles spektrumú féreghajtó osztály (benzimidazolok, levamisol és makrociklusos laktonok) ellen fonálféreg-rezisztencia van jelen [52], kulcsfontosságúak a hatékony parazita elleni védekezés fenntartására irányuló ellenőrzési stratégiák. A fonálférgek populációjának kiválasztatlan arányának megfelelő menekültek fenntartására kidolgozott módszertanok hozzájárulhatnak a rezisztencia felépülésének csökkentéséhez az érzékeny fonálférgek genotípusainak megőrzésével, ami elősegíti a rezisztencia allélok gyakoriságának hígítását és az anthelmintikus hatékonyság fenntartását [70].
Az egyik stratégia ennek elérésére a célzott szelektív kezelés (TST), amely magában foglalja a kiválasztott, kezelést igénylő egyének kezelését, szemben a teljes csoport kezelésével [71]. Az egyéneket általában a parazitizmus szintje alapján állapítják meg, hogy kezelésre szorulnak [3]. Habár a TST stratégiákat sikeresen kidolgozták és alkalmazták juhoknál, jóval kevesebb tanulmány készült szarvasmarhákról, a TST alkalmazásának első megismerése viszonylag nemrég történt meg [72]. Mivel a szarvasmarhák és juhok között jelentős különbségek vannak a gazda-parazita kölcsönhatásokban és a parazita epidemiológiában, várhatóan eltérések vannak a szarvasmarhák TST módszertanában és alkalmazásában. Bár a juhok TST-stratégiái hasznosnak bizonyultak az anthelmintikus rezisztencia szelekciójának csökkentésében [72], nehéz megtudni, hogy a különböző stratégiák közül melyik lenne a leghatékonyabb a különböző forgatókönyvek esetén. Jelenleg nincs közvetlen összehasonlítás a szarvasmarhák TST stratégiáiról, részben a változók összekeveréséből fakadó nehézségek miatt [72].
7. Holisztikus szabályozási stratégia az anthelmintikus rezisztencia szabályozására
2. ábra.
Egy holisztikus AR megelőzési stratégia, amely éves oktatási kampányokat tartalmaz minden gazdálkodó számára, és különböző diagnosztikai technikákat alkalmaz, amelyek ezután meghatározzák a szükséges féreghajtó kezelést.
Közvetlen féreghajtó szerű hatásokat mutattak ki in vitro vizsgálatokban, amelyek kimutatták, hogy a nyers kondenzált tannin kivonatokban történő inkubálás csökkentette a parazita lárvák fejlődését, életképességét, mozgékonyságát és migrációs képességét [73]. Míg a féreghajtó szerként használt szintetikus vegyületek folyamatos fejlesztése folyik, fokozott tudományos vizsgálatokra van szükség a gyógynövényekből kivont természetes vegyületek átalakításával és befogadásával kapcsolatban, mivel jelentős mennyiségükről beszámoltak arról, hogy féreghajtó hatást mutatnak [74]. ]. A jövőbeli kutatásnak a legelőnek a gyógynövényekből származó szerves vegyületekkel történő lehetséges kezelésére is összpontosítania kell, hogy megkísérelje a helminták lárva stádiumainak ellenőrzését.
8. Perspektíva (jövőbeli ellenőrzési és megelőzési módszerek, szükséges kutatások)
Köszönetnyilvánítás
Az első szerzőt az OMMT rendelkezésére bocsátotta a Dél-afrikai Nemzeti Kutatási Alapítvány (NRF) együttműködési posztgraduális képzési támogatásának ösztöndíja (GUN: 105271).
Összeférhetetlenség
A szerzők kijelentik, hogy nincsenek olyan pénzügyi vagy személyes kapcsolataik, amelyek esetleg nem megfelelően befolyásolták volna őket e könyvfejezet megírásakor.
Nyilatkozatok
A szerzők kijelentik, hogy a könyvfejezet megírásához felhasznált összes irodalmat és forrást megfelelően megemlítették a szövegben és a referencia részben.
- 3 Candida oka; Candida védekezési módszerek a fogyás ellenállásának megszüntetésére
- A fogyás ellenállásának 6 módja; Neomed
- Aerob vagy ellenálló edzés a legjobb a fogyáshoz
- 7 alattomos fogyásállóság bűnösök; Hogyan mozgassuk a mérleget
- Előny Roller Lash szempillaspirál és magas szűrési hatékonyság és alacsony légellenállás - Jackson