Az atipikus szorongásoldó gyógyszer, a tofisopam, szelektíven blokkolja a foszfodiészteráz izoenzimeket, és aktív a pszichózis negatív tüneteinek egérmodelljében
Chris Rundfeldt
1 Drug-Consult.Net, Toepfferspark 2a, 39108 Magdeburg, Németország
Katarzyna Socała
2 Állatfiziológiai tanszék, Biológiai Intézet, Maria Curie-Skłodowska Egyetem, Akademicka 19, 20-033 Lublin, Lengyelország
Piotr Wlaź
2 Állatfiziológiai tanszék, Biológiai Intézet, Maria Curie-Skłodowska Egyetem, Akademicka 19, 20-033 Lublin, Lengyelország
Absztrakt
Bevezetés
Míg néhány 2,3-BDZ és részben a tofisopam is kimutatták, hogy antipszichotikus hatásokat váltanak ki a pszichózis klasszikus állatmodelljeiben, amelyek a betegség pozitív tüneteihez kapcsolódnak, azaz az apomorfin-mászó tesztben a feltételes elkerülési reakció és kisebb mértékben - a katalepsziás tesztben a tofisopam farmakológiai profilja és mellékhatása az emberben eltér a klasszikus antipszichotikumoktól (Horváth et al. 2000). A jelentett enyhe stimuláló aktivitás (Szegő et al. 1993) miatt, amely ellentétben áll a klasszikus antipszichotikumok aktivitásával, arra voltunk kíváncsiak, hogy a tofisopam aktív lehet-e a pszichózis negatív tüneteinek modelljében, amely utánozza az avolition állapotát. A megfelelő modellt Noda és munkatársai írták le. (1995).
A tofisopam érdekes farmakológiai profilja miatt arra is kíváncsi voltunk, hogy többet megtudjunk a hatásmechanizmusról. A korai kötési vizsgálatok a 2,3-BDZ specifikus és kizárólagos kötődését azonosították a striatumban és a kapcsolódó struktúrákban (Horváth et al. 2000). A kötődési helyet girisopám-kötőhelynek nevezték el, mivel ennek a 2,3-BDZ-származéknak volt a legnagyobb affinitása. Ennek a javasolt kötési helynek az eloszlása nagyrészt átfedésben van a foszfodiészteráz 10 izoenzim (PDE-10) eloszlásával, amelyet erősen és szelektíven fejez ki a striatum (Seeger és mtsai 2003). Ezenkívül a PDE-10 inhibitorokat érdekes célpontnak tekintik az antipszichotikus szerek számára (Siuciak és mtsai 2006). Horváth et al. (2000) azt javasolta, hogy a tofisopam hatásmechanizmusa összefüggésbe hozható legyen a fehérje (k) foszforilációjának változásával. Míg a foszfodiészteráz gátlása közvetlenül nem eredményezi a fehérje foszforilációját, a foszfodiészterázok által hasított második hírvivők - ciklikus adenozin-monofoszfát (cAMP) vagy ciklikus guanozin-monofoszfát (cGMP) - aktiválhatják a protein-kinázokat, ami fokozott fehérje-foszforilációt eredményez. Ezen okokból különböző PDE izoenzimeket, köztük a PDE-10-et szkríneltünk a tofisopámmal való specifikus kölcsönhatásra.
Anyagok és metódusok
Foszfodiészteráz szűrő
Állatok
Az állatkísérleteket összesen 49 hím, 25–30 g súlyú albínói svájci egérrel végeztük, amelyet az engedéllyel rendelkező tenyésztőtől vásároltunk (Laboratóriumi Állattenyésztés, Górzkowska, Varsó, Lengyelország). Ebben a vizsgálatban legalább 1 hét akklimatizáció után alkalmazták őket. Az állatokat szigorúan ellenőrzött laboratóriumi körülmények között (környezeti hőmérséklet 22–23 ° C, relatív páratartalom körülbelül 45–55%, 12/12 világos/sötét ciklus, 6: 00-kor világít) 6–10-es csoportokban polikarbonát ketrecekben helyeztük el. h; chow pellet és csapvíz folyamatosan rendelkezésre áll). A kísérleti protokollt a Lublini Orvostudományi Egyetem Helyi Etikai Bizottsága jóváhagyta (18/2007. Számú engedély), és az összes eljárás szigorúan megfelelt az Európai Közösségek Tanácsának 1986. november 24-i irányelvének (86/609/EGK).
Kábítószerek
Tofizopam [1- (3,4-dimetoxi-fenil) -5-etil-7,8-dimetoxi-4-metil-5H-2,3-benzodiazepin, racém keverék, az EGIS Pharmaceuticals PLC (Budapest, Magyarország) szívesen nyújtja], frissen szuszpendáltuk metil-cellulóz 0,5% -os vizes oldatában (Sigma, St. Louis, MO, USA), és intraperitoneálisan (ip) adtuk 5 ml/kg térfogatban. Dizokilpin [(+) - 5-metil-10,11-dihidro-H-dibenzociklohepten-5,10-imin-hidrogén-maleát, MK-801; megvásároltuk a Sigmától] extempore-ot oldottunk fiziológiás sóoldatban és i.p. 5 ml/kg térfogattal. A kontroll állatok megfelelő mennyiségben kapták a megfelelő vivőanyagokat.
Kényszerű úszási teszt dizocilpinnel krónikusan kezelt egereken
A hatásos N-metil-d-aszpartát (NMDA) receptor antagonista fenciklidin akut beadása az embernél mind a pszichózis pozitív, mind negatív tüneteit kiválthatja, és skizofrén betegeknél súlyosbíthatja a pszichózist (Abdel-Naby és mtsai 2001). Állatokban a fenciklidin kóros magatartások széles skáláját indukálhatja, amelyek összefüggésben lehetnek a pszichotikus viselkedéssel. A fenciklidin ismételt beadása esetén egerekben avolíciós állapot indukálható, amely a fenciklidin-kezelés befejezése után több napig fennáll. Az avolition a skizofrénia egyik negatív tünete; kényszerúszási tesztben számszerűsítik, és az állatok elhúzódó mozdulatlanságot mutatnak az avolition indikátoraként (Abdel-Naby és mtsai 2001). Ezt a modellt a pszichózis negatív tüneteinek ideális modelljének javasolták (Noda et al. 1995), azonban csak a depressziós komponensre korlátozódik, és nem biztos, hogy hasznos más negatív tünetek, például tanulási és memóriahiány vagy társadalmi visszahúzódás modellezésére.
Mivel a fenciklidin egy szabályozott anyag, helyette az NMDA-receptor antagonista dizocilpin alkalmazásával hoztuk létre a modellt. A kényszerúszási tesztet és a gyógyszeres kezelési protokollt egereken hajtották végre, lényegében Noda és mtsai. (1995). A dizocilpin dózisát és a kezelési ütemtervet az előzetes kísérletek alapján választották meg (az adatokat nem közöljük). Az első napon (pénteken) mindegyik állatot külön-külön egy üveg hengerbe (20 cm magasság, 15 cm átmérő) helyeztük, amely 11 cm 23 ° C-on tartott vizet tartalmaz, és 3 percig kénytelen volt úszni, és a mozdulatlanságot rögzítették (az elmozdulás első mérése kiindulási mérésként). Az egeret mozgásképtelennek ítélték, amikor passzívan lebegett a vízben. Az avolition indukciója érdekében az egereket krónikusan 0,2 mg/kg dizocilpinnel kezeltük i.p. az első úszáspróba utáni negyedik napon (hétfőn) kezdődő hétvégék kivételével minden nap, a 19. napig (péntek). Kétnapos gyógyszermentes periódust követően, 22. napon (hétfőn) mindegyik egeret ismét vízbe helyeztük 3 percre, és rögzítettük a mozdulatlanságot, hogy teszteljük az immobilitás meghosszabbodását (a mozdulatlanság második mérése).
Statisztikai analízis
Minden adatot adott esetben átlagként ± az átlag standard hibájaként (SEM) mutatunk be. A tofisopam hatásának statisztikai elemzését a kezelés befejezése után a hosszan tartó mozgásképtelenségre az immobilitás két mérése közötti egyéni különbségek egyirányú varianciaanalízisével (ANOVA) végeztük, amelyet Tukey post hoc teszt követett. Az egyéni különbségek alkalmazása kiigazítást eredményez. A 0,05-nél kisebb vagy azzal egyenlő p-értéket statisztikailag szignifikánsnak tekintettük.
Az ugyanazon csoportban az immobilitás ismételt meghatározásának hatásainak teszteléséhez az egyes csoportokat páros t teszttel is összehasonlítottuk.
Eredmények
Foszfodiészteráz szűrő (1. táblázat)
Asztal 1
A foszfodiészteráz (PDE) izoenzimek gátlása a tofiszopám által
PDE izoenzim% gátlás 10 000 nMIC50 mellett (μM)| PDE-1A3 | 37.8 | nd. |
| PDE-2A3 | 83.4 | 2,11 ± 1,8 |
| PDE-3A | 81.7 | 1,98 ± 1,7 |
| PDE-4A1 | 92.1 | 0,42 ± 0,8 |
| PDE-5 (katalitikus domén) | 42.0 | nd. |
| PDE-6C | 5.3 | nd. |
| PDE-8A1 | 7.9 | nd. |
| PDE-9A1 | 2.8 | nd. |
| PDE-10A1 | 89.6 | 0,92 ± 1,2 |
| PDE-11A1 | 4.2 | nd. |
A tofizopám (10 000 nM) hatása a különböző PDE izoenzimek aktivitására, az IMAP technológia alkalmazásával meghatározva (Molecular Devices, Inc., Sunnyvale, CA, USA). A százalékos gátlási értékeket kettős meghatározásból határoztuk meg. Azoknál az izoenzimeknél, ahol a gátlás meghaladta az 50% -ot, az IC50 értékeket 8 pontos vizsgálattal határoztuk meg, minden egyes izoenzimhez 3 párhuzamos kísérletet alkalmazva. Az IC50 értékeket átlagként ± 3 mérés átlagának standard hibájaként adjuk meg
Megállapították, hogy a tofizopám számos PDE izoenzim alacsony affinitású blokkolójaként működik. Míg a PDE-6, PDE-8, PDE-9 és PDE-11 között nem találtak kölcsönhatást, a PDE-1 és a PDE-5 gyenge gátlását azonosították. 10 000 μM-nál mért 50% -nál kisebb gátlás miatt ezeknek az izoenzimeknek nem határoztak meg IC50-értéket. A magas nanomól és az alacsony mikromoláris tartomány közötti gátlást találtunk a PDE-2A3 (2,11 ± 1,8 μM), a PDE-3A (1,98 ± 1,7 μM), a PDE-4A1 (0,42 ± 0,8 μM) és a PDE-10A1 (0,92 ± 1,2) tartományban. μM).
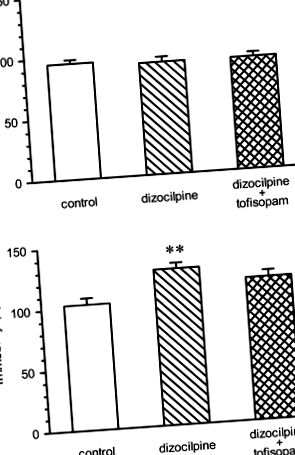
A tofisopam hatása a pszichózis negatív tüneteinek modelljében (1. ábra)
Az egerek mozdulatlansága az úszási tesztben a dizocilpin (0,2 mg/kg i.p. naponta egyszer, heti 5 nap) vagy a dizocilpine és tofisopam, 50 mg/kg i.p. naponta kétszer, heti 5 napon (panel a) és a 22. napon, 3 nappal a gyógyszeres kezelés abbahagyása után (panel b). Az 1. napon az immobilitás hasonló volt mindhárom csoportban [ANOVA: F (2, 46) = 0,2696, nem szignifikáns]. A 21. napon (panel b), a dizocilpinnel kezelt egerek mozdulatlansága szignifikánsan növekedett a kontroll csoporthoz képest; ANOVA az egyéni különbségekről: F (2, 46) = 6,005, p = 0,0048. A tofisopámmal kezelt csoport mozdulatlansága nem különbözött szignifikánsan a vivőanyag-csoporttól. ** p −1 azt jelzi, hogy a tofisopam koncentrációja nagyobb az extravaszkuláris szövetekben, mint az érrészben. A felezési idő 4 óra tartományban volt, ami azt jelzi, hogy 100 mg napi háromszori beadás esetén várható némi felhalmozódás (Tóth et al. 2006). Ezek az adatok azt mutatják, hogy az állandósult szöveti koncentráció várhatóan a PDE-4, PDE-10 és potenciálisan a PDE-2 IC50-tartományában vagy akár ennél is magasabb lehet, ami ezen enzimek részleges blokkolását eredményezi.
Az in vivo modellben a dizocilpin ismételt beadása a mozdulatlanság várható meghosszabbodásához vezetett a tesztelt egerekben. Meg kell jegyezni, hogy az egerek reaktivitása nem korrelálhat a dizocilpin akut gyógyszerhatásával, amelyről ismert, hogy hiperaktivitást vált ki, ha állatoknak adják be. Az utolsó adag utáni 3 napos kimosódási idő miatt, valamint a rágcsálóknál a dizocilpin felezési idejét tekintve 2 óra tartományban (Vezzani és mtsai 1989) az egerek viselkedési módosulása inkább összefüggésben lehet krónikus plaszticitás. Adataink azt mutatják, hogy az eredetileg fenciklidin alkalmazásával leírt modell előállítható dizocilpin alkalmazásával (Noda et al. 1995).
Az egereknek naponta kétszer beadott tofiszopám képes volt csökkenteni a modellünkben a megnövekedett mozdulatlanságot. A hatás 3 nappal a tofisopam utolsó adagja után nyilvánvaló volt, ami azt jelzi, hogy a hatás nem kapcsolható össze a tofisopam egér viselkedésére gyakorolt akut hatásával. Az NMDA antagonisták szubkrónikus alkalmazásával előidézett mozdulatlanság fokozódását a klozapin és a risperidon csillapítja, amelyekről ismert, hogy javítják a betegek negatív tüneteit, de nem a haloperidol, amely nem javítja őket (Noda et al. 1995, 2000). A tofiszopám tehát képes a pszichózis negatív tüneteinek, például az öngyilkosságnak enyhítésére; azonban nem sikerült teljes normalizálást elérni. Ez összefüggésben lehet a rágcsálóknál a tofisopam rövid felezési idejével, de további kísérletekre van szükség a tofisopam vagy más (erősebb) 2,3-BZD pszichózisban rejlő potenciáljának értékeléséhez. A pszichózis negatív tüneteinek más modelljeit is fel kell használni annak értékelésére, hogy az avolitionon túlmutató negatív tünetek is módosulnak-e.
Más 2,3-BZD-k szisztematikusan értékelhetők a PDE izoenzimekkel és a PDE-4 és PDE-10, valamint a PDE-2 iránt kombinált affinitással rendelkező vegyületekkel való kölcsönhatásuk szempontjából, de a megfelelő állatmodellekben is tesztelhetők, különös tekintettel a kettős vagy akár a hármas inhibitorok.
Köszönetnyilvánítás
A szerzők köszönetet szeretnének mondani az EGIS Pharmaceuticals PLC-nek (Budapest, Magyarország) a tofisopam nagylelkű ajándékáért.
Összeférhetetlenség A szerzők kijelentik, hogy nincsenek összeférhetetlenségük.
Nyílt hozzáférésű Ezt a cikket a Creative Commons Nevezd meg, nem kereskedelmi célú licenc feltételei szerint terjesztjük, amely bármilyen nem kereskedelmi célú felhasználást, terjesztést és sokszorosítást lehetővé tesz bármilyen adathordozón, feltéve, hogy az eredeti szerző (k) és a forrás jóváírásra kerülnek.
- A Simvastatin MedlinePlus gyógyszerinformáció
- Egyközpontú tanulmány a posakonazol terápiás gyógyszer monitorozásáról tüdőtranszplantált betegeknél
- ROSUVASTATIN - ORAL (Crestor) mellékhatások, orvosi felhasználások és gyógyszerkölcsönhatások
- Rolex; drog kórházba helyezi Dumfries emberét - BBC News
- NEOMYCINGRAMICIDINNYSTATINTRIAMCINOLONE - AKTUÁLIS KRÉM mellékhatások, orvosi felhasználások és gyógyszerek