Krómot csökkentő új Stenotrophomonas maltophilia OS4 törzsből biológiailag előállított extracelluláris ezüst nanorészecskék antibakteriális és citotoxikus hatékonysága
Mohammad Oves
1 Agrármikrobiológiai Tanszék, Agrártudományi Kar, Aligarh Muslim University, Aligarh, India,
Mohammad Saghir Khan
1 Agrármikrobiológiai Tanszék, Agrártudományi Kar, Aligarh Muslim University, Aligarh, India,
Almas Zaidi
1 Agrármikrobiológiai Tanszék, Agrártudományi Kar, Aligarh Muslim University, Aligarh, India,
Arham S. Ahmed
2 Anyagtudományi Kiválósági Központ (Nanoanyagok), Alkalmazott Fizikai Tanszék. Aligarh Muslim University, Aligarh, India,
Faheem Ahmed
3 Nano- és haladó anyagmérnöki iskola, Changwon Nemzeti Egyetem, Changwon, Koreai Köztársaság,
Ejaz Ahmad
4 Interdiszciplináris biotechnológiai egység, Aligarh Muslim University, Aligarh, India,
Asif Sherwani
4 Interdiszciplináris biotechnológiai egység, Aligarh Muslim University, Aligarh, India,
Mohammad Owais
4 Interdiszciplináris biotechnológiai egység, Aligarh Muslim University, Aligarh, India,
Ameer Azam
2 Anyagtudományi Kiválósági Központ (Nanoanyagok), Alkalmazott Fizikai Tanszék. Aligarh Muslim University, Aligarh, India,
5 Nanotechnológiai Központ, King Abdulaziz Egyetem, Jeddah, Szaúd-Arábia,
A kísérletek megtervezése és megtervezése: M. Oves MSK. Végezte a kísérleteket: M. Oves ASA FA AS. Elemezte az adatokat: M. Oves MSK AZ. Hozzájáruló reagensek/anyagok/elemzési eszközök: MSK AA EA M. Owais AA. Írta az írást: M. Oves MSK.
Absztrakt
Bevezetés
Figyelembe véve a biológiai alapon előállított nanoanyagok jelentőségét, a jelen vizsgálatot a nehézfémekkel szennyezett helyekből származó baktériumtörzs felkutatására és a törzs molekuláris és biokémiai megközelítéssel történő jellemzésére tervezték. A baktérium törzs króm- és nitrát-csökkentő képességét tovább teszteltük. A baktériumtörzset az AgNP-k szintetizálásához szobahőmérsékleten redukálószer hiányában is felhasználták. A kapott AgNP-ket ezután néhány standard analitikai módszerrel jellemeztük, mint például UV-látható, nanorészecske-méret-analizátor, SEM, XRD és FTIR spektroszkópia. A Gram-pozitív és Gram-negatív baktériumokra kifejtett antibakteriális aktivitás mellett a biofabricált AgNP-k citotoxicitását májfunkción, RBC-ken, splenocytákon és HeLa sejtvonalakon tesztelték.
Anyagok és metódusok
Izolálás és baktériumok jellemzése
A talajmintákat steril polietilén zacskókba (15–12 cm 2) gyűjtöttük az édes borsó (Pisum sativum) mezők rizoszférájából, Ghaziabad külterületén, Uttar Pradesh, India. Történelmileg a mezőgazdasági területet a Hindon folyó ipari szennyvize következetesen öntözte. A baktériumtörzs izolálása érdekében soros hígítási vizsgálatot hajtottunk végre normál sóoldatban, és 10 ul hígított szuszpenziót terítettünk tápanyag-agar (NA) táptalajra. A lemezeket három napig 28 ± 2 ° C-on inkubáltuk. Összesen 20 baktérium törzset választottunk ki és jellemeztünk. A biokémiai aktivitásokat citrát felhasználás, indoltermelés, metilvörös teszt, nitrát redukció, Voges Proskauer, kataláz teszt, oxidáz szénhidrátok (dextróz, mannit és szacharóz) felhasználásával, keményítő hidrolízissel és zselatin cseppfolyósítási teszttel tesztelték [32].
16S rDNS alapú azonosítás
A teljes 20 baktériumtörzs közül az OS4 törzset 16S rDNS génszekvencia analízissel azonosítottuk. Az OS4 törzs 16S rDNS-jének részleges szekvenálását a Sequencing Service, Macrogen Inc., Szöul, Dél-Korea végezte univerzális primerek, 518F (5'CCAGCAGCCGCGGTAATACG3 ') és 800R (5'TACCAGGGTATCTAATCC3') alkalmazásával. Később a nukleotidszekvencia adatait a Gen-Bank, NCBI szekvencia adatbázisban rakták le. Az nBLAST online NCBI programot alkalmaztuk a kapcsolódó szekvenciák ismert taxonómiai információkkal történő azonosítására az NCBI weboldalán (http://www.ncbi.nlm.nih.gov/BLAST), hogy pontosan azonosítsuk az OS4 baktérium törzset. A filogenetikai fát a MEGA 4.1 szoftver szomszédos csatlakozási módszerével [33] készítettük [34].
Növekedési és hat vegyértékű króm redukciós körülmények optimalizálása
Az életképes baktériumpopulációk és a pH hatértékű krómra (Cr (VI), redukcióra gyakorolt hatását 100 µg ml -1 Cr6 + -val módosított tápoldat (NB) alkalmazásával értékeltük. A sterilizált táptalaj pH-ját 1-12 mólos sósavoldattal vagy 1 mólos nátrium-hidroxid-oldattal 2-12 értékre állítjuk. Az S. maltophilia OS4 exponenciálisan növesztett tenyészetének 100 ul-ját oltottuk be NB táptalajba, amely legfeljebb 100 µgml -1 Cr (VI) -ot tartalmazott, és 35 ± 2 ° C-on inkubáltuk egy orbitális rázó inkubátorban 120 fordulat/perc sebességgel 48 órán át. A Cr 6+ redukciójához mindegyik lombikból 1 ml tenyészetet centrifugáltunk (6000 fordulat/perc) 10 percig 20 ° C-on, és a felülúszóban lévő Cr 6+ -ot 1,5-difenil-karbazid módszerrel határoztuk meg [35], [36 ].
A felülúszó előkészítésének közepes és növekedési körülményei
Az OS4 baktérium izolátumot steril NB táptalajba (pH 7,2) oltottuk be. A baktériumokat hagytuk szaporodni 35 ± 2 ° C-on 24 órán át egy 500 ml-es Erlenmeyer-lombikban, 300 ml munkatérfogattal, 120 fordulat/perc sebességgel történő keverés mellett, orbitális rázó inkubátoron (Remi CIS 24BL, India). A táptalajt ezután 5000 fordulat/perc sebességgel centrifugáltuk, hogy sejtmentes felülúszót kapjunk [37].
AgNP-k előkészítése és jellemzése
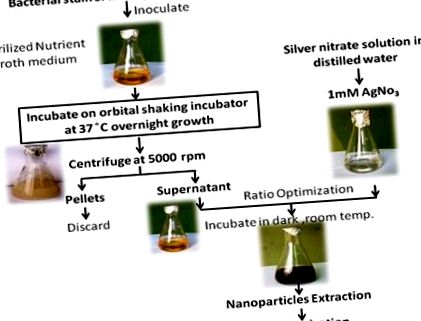
Az AgNP-k előállításához 2 ml exponenciálisan növesztett baktériumtenyészetből extrahált felülúszót adunk 98 ml 1 mM AgNO3-oldathoz [38]. A reakcióelegyet sötétben, szobahőmérsékleten inkubáltuk. Az összes lépést egymás után az 1. ábra mutatja .
További részletekért lásd: Anyagok és módszerek.
AgNP-k tisztítása
Az AgNP-k szintéziséhez bakteriális felülúszót használtunk. Az ezüst biológiai redukcióját az UV-vis abszorpciós spektrummal követtük a reakcióelegy időfüggvényében. A szintetizált részecskéket centrifugálással hatszor mossuk, és kétszer desztillált vízben újra diszpergáljuk a maradék átalakulatlan ezüstionok eltávolításához. 12 kDa-os határértékkel rendelkező dialízis tasakba helyeztük őket. Az AgNP-ket 1 ml HEPES-pufferben (20 mM, pH 7,4) szacharózzal kiegészítve szuszpendáltuk, hogy elérjük a 2,5 g/ml sűrűséget. Az oldatot egy centrifugacső (15 ml) aljára helyeztük. 12 ml lineáris gradiens szacharóz (0,25–1,0 M) sűrűséget rétegezünk a nanorészecske szuszpenzióra, és centrifugálásnak vetjük alá (10 000 fordulat/perc 4 ° C-on 4 órán át), és összegyűjtjük további jellemzés céljából. Az oldatban lévő nanorészecske koncentrációját ICP-AES (Liberty RL) határozta meg [39].
UV-látható és nanofox-spektrumelemzés
Az ezüstionok (Ag +) redukcióját gondosan monitoroztuk az éjszakán át inkubált reakcióközeg UV-látható spektrumának mérésével, miután kis mennyiségű előállított alikvotot hígítottunk kétszer desztillált vízben [40]. Mivel az AgNP-k vízben oldódnak, megfigyeltük a színváltozást. A szintézis fázisában sárgásbarna színképződés figyelhető meg. Az előállított AgNP-k koncentrációját 250–600 nm hullámhosszúságú UV-vis spektrométerrel (Thermo Spectronic 20D +) mértük, 10 mm-es optikai út hosszúságú kvarcküvettákat használva. A nanorészecskék eloszlásának és oldatbeli stabilitásának további elemzését a Nanophox részecskeméret-analizátorral figyelték meg [18].
FTIR spektrumelemzés
Az RXI FTIR spektrométert KBr sugárosztóval alkalmaztuk a biológiai részek részecskeszintézisben való részvételének megállapítására. Az esetleges szabad biomassza-maradék eltávolítása érdekében a maradék oldatot a reakció után 30 percig 8000 fordulat/perc sebességgel centrifugáljuk, és a kapott pelletet 20 ml steril dupla desztillált vízben keverjük, majd 10 percig örvénykeverőn keverjük. Ezt követően a centrifugálási és újraszórási eljárást háromszor megismételtük. Az AgNO3, a baktérium biomassza és az AgNP FTIR spektrumát KBr pelletként rögzítettük 4 cm -1 felbontással, 400–4000 cm -1 hullámszám-tartományban [41].
Röntgendiffrakciós és terepi emissziós pásztázó elektronmikroszkópos elemzés
A röntgendiffrakciós elemzést (XRD) Rigaku Miniflex röntgendiffraktométer alkalmazásával végeztük Cu-Kα sugárzással (λ = 0,15406 nm) 20 ° és 80 ° közötti tartományban. Ezenkívül az AgNP-k morfológiáját terepi emissziós pásztázó elektronmikroszkóppal (FESEM) vizsgáltuk Hitachi SU6600-on. A minták lapját szénnel bevont rézrácsra készítettük el, csekély mennyiségű minta leejtésével, és a mérések előtt hagytuk szobahőmérsékleten megszáradni [42].
Engedje el az AgNP-k kinetikáját
Az AgNP-ket dialízis zacskóba helyeztük, levágva 12 kDa-t. A tasakot HEPES pufferoldatban szuszpendáltuk (20 ml, pH 7,4). Az AgNP-k folyamatos felszabadulását 48 órán keresztül mértük. Kiszámítottuk a felszabadulás sebességét és a kinetika sorrendjét. A felszabadult ezüst koncentrációját atomabszorpciós spektrofotométerrel (GBC, Ausztrália) határoztuk meg. Röviden: az AgNP-k oldatát 100 ° C-on tömény salétromsavban, olajfürdőben 2 órán át feldolgoztuk a teljes szolvatáció érdekében, majd megmértük az ezüst-koncentrációt levegő/acetilén láng segítségével ezüst láng segítségével, az üzemanyag áramlási sebessége 0,9-1,2 l/perc és a hőmérséklet atomizálása 1100 ° C [43]. A felszabadult ezüst százalékát az alábbi egyenlet segítségével számoltuk ki:
ahol Wc a dialízis zsák összes ezüsttartalma és Wt a pufferoldat ezüsttartalma egyszerre.
Állatmodell a hatékonysági és toxicitási vizsgálatokhoz
Az akut toxicitási vizsgálatokhoz 18 ± 2 g tömegű és 8–10 hetes nőstény BALB/c egereket kaptak az Interdiszciplináris Biotechnológiai Egység, A.M.U., Aligarh állattartó létesítményéből. Az állatokat szokásos pellet-táplálékkal etették, és ad libitum vízhez juthattak. A vérzéshez és az injekciózáshoz alkalmazott technikákat szigorúan az indiai kormány állatetikai bizottsága által az állatokon végzett kísérletek ellenőrzésére és felügyeletére jóváhagyott megbízásoknak megfelelően követték.
Sejtkészítés
A lépsejteket egerekből izoláltuk, és RPMI 1640 táptalajon szétválasztottuk. Centrifugálás után az egysejtű szuszpenziót ACK-lizáló pufferrel (8,29 g/l NH4Cl, 1 g/l KHCO2, 37,2 mg/l EDTA/2Na) kezeltük a vörösvérsejtek lebontására. Centrifugálás után a sejteket RPMI 1640 tápközegben tartottuk, amelyet antibiotikus és antimikotikus oldattal (Sigma) és 10% hő-inaktivált borjúmagzati szérummal (FCS; sigma) egészítettünk ki. A sejteket 96 lyukú, síkfenekű lemezeken tenyésztettük 0,1 ml tenyésztő tápközegben a sejtproliferációs vizsgálat céljából, és AgNP-kkel (0–500 µgml -1) stimuláltuk. A splenocitákat 24 órán át 37 ° C-on tenyésztettük, nedvesített atmoszférában, amely 5% CO2-ot és 95% levegőt tartalmazott. Itt az alkalmazott splenocitákat 5 µg/ml ConA alkalmazásával 48 órán keresztül inkubáltuk.
Az AgNP felvétel meghatározása HeLa sejtekkel
A HeLa sejtvonalat 10% hő-inaktivált borjúmagzati szérummal kiegészített RPMI 1640 táptalajban tartottuk fenn. A sejteket 10 4 sejt sűrűséggel szélesztettük üveg fedőlemezekre, és 24 órán át 37 ° C-on tenyésztettük. A sejteket ezután AgNP-knek tették ki. A lemezeket 1 órán át inkubáltuk. A sejteket 2% paraformaldehiddel rögzítettük 2 órán át, majd HBSS-sel mostuk. A rögzített sejteket mikroszkóp alatt figyeltük meg.
MTT vizsgálat splenocitákon
Az AgNP-k citotoxicitását az egér lépsejtjein laboratóriumunkban standardizált, korábban közölt módszerrel határoztuk meg [18]. AgNP-kkel (0–500 µgml-1) 24 órán át, 37 ° C-on végzett stimulálás után a lépsejteket centrifugáljuk, kétszer mossuk friss RPMI 1640 táptalajjal, és 0,5 mg ml-1 MTT-ben tenyésztjük (PBS-ben oldva és 0,2 mm-es szűrőn átszűrjük). membrán) 37 ° C-on. 4 óra múlva az intracelluláris formazán kristályokat feloldottuk dimetil-szulfoxidban, és az abszorpciós értékeket 570 nm-en mértük. Az abszorpciós értékeket a sejtproliferációs sebességben (%) fejeztük ki, a kontrollcsoport szerint 100% -ban.
MTT-vizsgálat a HeLa sejtvonalakon
A HeLa sejtvonalat 10% hővel inaktivált borjúmagzati szérummal kiegészített RPMI 1640 táptalajban tartottuk fenn. A sejteket 5x104 sejt/üreg sűrűségben szélesztettük egy U-alsó 96 lyukú lemezre, és 24 órán át 37 ° C-on tenyésztettük. A sejteket ezután különböző koncentrációjú AgNP-knek tették ki (0–500 µgml -1). A lemezeket 48 órán át inkubáltuk, és a sejtproliferációt mérjük lyukanként 20 ul MTT (tiazolil-kék-tetrazolium-bromid) festék (5 mg/ml foszfáttal pufferolt sóoldatban) hozzáadásával. A lemezeket további 4 órán át 37 ° C-on, 5% CO2-ot tartalmazó nedvesített kamrában inkubáltuk. Az egyes üregekben az életképes sejtek által a festék redukciója következtében képződött formazan-kristályokat 150 ul dimetil-szulfoxidban oldjuk, és az abszorbanciát 570 nm-en mérjük. Az abszorpciós értékeket a sejtproliferációs sebességben (%) fejeztük ki, a kontrollcsoport szerint 100% -ban.
Akut toxicitási teszt az AgNP-k számára
A máj toxicitását 100 µg/ml egyszeri adagolási rend alkalmazásával figyeltük meg a szérum aszpartát-aminotranszferáz (AST) és az alanin-aminotranszferáz (ALT) biokémiai profiljának meghatározásához a megfelelő detektáló készletekkel (COGENT, Span Diagnostics Ltd., India). A vért retro orbitális szúrással vettük két csoport egereitől, amelyek (i) kezeletlenek és (ii) 24 óra múlva kezeltek. A vért szobahőmérsékleten hagytuk alvadni, és a szérumot elválasztottuk. Az aszpartát-aminotranszferázt és az alanin-aminotranszferázt a szérumban határoztuk meg, a gyártó megfelelő irányelveinek megfelelően.
RBC Lysis teszt AgNP-khez
In vitro vörösvértest-lízis tesztet hajtottak végre előzetes toxicitási tesztként, amelyet úgy értékelnek, hogy megmérjük a hemoglobin felszabadulását a membránszivárgás vagy a nanorészecskék kis dózisának való kitettség következtében fellépő zavar következtében. Röviden, egy egészséges nyúlból nyert friss vért véralvadásgátló oldatban (etilén-diamin-tetraecetsav) gyűjtöttünk össze, és 1000 x g-vel 10 percig 4 ° C-on centrifugáltuk. A Buffy-bevonatot és a plazmát is eldobtuk. A megmosott vörösvértesteket izotóniás pufferrel (20 mM PBS) hígítottuk 50% hematokrit előállítására. A hemolízis mértékét úgy vizsgáltuk, hogy a vörösvértest szuszpenziót inkubáltuk 100-300 µg/ml AgNP-k koncentrációival 37 ° C-on 1 órán át. Az inkubált oldatokat 1500xg sebességgel 1 óra múlva centrifugáltuk, a felülúszót összegyűjtöttük és ultraibolya látható spektroszkópiával (λmax = 576 nm) elemeztük a felszabaduló hemoglobinra. A hemolízis százalékát a következő egyenlettel határoztuk meg:
ahol Abst a felülúszó abszorbanciája a részecskékkel inkubált mintákból, Absc a felülúszó abszorbanciája a kontrollokból (normál sóoldat), és Abs100% az 1% Triton® X jelenlétében inkubált kontrollok felülúszójának abszorbanciája -100, ami a vörösvértestek teljes lízisét okozza (teljes lízis).
Antimikrobiális vizsgálat
A biofabricált AgNP baktériumölő aktivitását agar kút-diffúziós módszerrel teszteltük mind Gram-pozitív Staphylococcus aureus, mind Gram-negatív Escherichia coli és Serratia marcescens ellen. Az egyes baktériumok tiszta tenyészeteit NB-táptalajban szubkultúráztuk. Mindegyik baktérium törzset egységesen szétterítettük az egyes lemezeken, steril üvegrúd-szóróval. 8 mm átmérőjű üregeket lyukasztunk NA lemezekre gélszúrás alkalmazásával. Mikropipetta alkalmazásával mindegyik lyukba nanorészecske (12,5, 25 és 50 ug) szuszpenziókat öntöttünk minden lemezre. A lemezeket ezután inkubáltuk 35 ± 2 ° C-on 48 órán keresztül, és megmértük a baktériumok növekedésének gátlási zónájának szintjét [44].
Eredmények és vita
A baktériumtörzs jellemzése
- Antibiotikumok hatékonysága a pneumonitisben a parafin (kerozin) lenyelés után gyermekeknél - teljes szöveg
- Kettős-vak, véletlenszerűen kontrollált, 12 hetes utólagos vizsgálat a hatékonyság és a biztonság értékelésére
- A kolloid ezüst felhasználásának 5 módja
- Alaska Cruise Silver Explorer iExpedition
- Ayurvédikus gyógyszer a pajzsmirigy előnyeire és hatékonyságára