Azoximetán által kiváltott fulmináns májelégtelenség C57BL/6J egerekben: új állatmodell jellemzése
1 Orvostudományi Osztály, Illinoisi Egyetem, Chicago, és Chicago Veterans Affairs Medical Center, West Side Division, Chicago, Illinois, 60612
1 Orvostudományi Osztály, Illinoisi Egyetem, Chicago, és Chicago Veterans Affairs Medical Center, West Side Division, Chicago, Illinois, 60612
1 Orvostudományi Osztály, Illinoisi Egyetem, Chicago, és Chicago Veterans Affairs Medical Center, West Side Division, Chicago, Illinois, 60612
1 Orvostudományi Egyetem, Illinoisi Egyetem, Chicago, és a Chicago Veterans Affairs Medical Center, West Side Division, Chicago, Illinois, 60612
1 Orvostudományi Osztály, Illinoisi Egyetem, Chicago, és Chicago Veterans Affairs Medical Center, West Side Division, Chicago, Illinois, 60612
1 Orvostudományi Osztály, Illinoisi Egyetem, Chicago, és Chicago Veterans Affairs Medical Center, West Side Division, Chicago, Illinois, 60612
Absztrakt
májtranszplantáció hiányában a fulmináns májelégtelenség (FHF) 50–90% -os halálozási arányhoz kapcsolódik, és az Egyesült Államokban az összes májhoz kapcsolódó halálozás ~ 6% -át teszi ki (12, 16, 20). Ez a rossz prognózis - legalábbis részben - a megfelelő állatmodell hiányának tudható be, amely lehetővé tenné e szindróma patofiziológiájának jobb megértését. Az FHF állatmodelljének alapvető kritériumai a reprodukálhatóság, a májelégtelenség okozta halál és a hosszú terápiás időtartam (28). Mivel a hepatikus encephalopathia (HE) az emberi FHF-hez változatlanul társul (6, 24), a megváltozott mentális állapotot is fontos kritériumnak kell tekinteni ennek a szindrómának az állatmodelljeiben. Ennek ellenére egyetlen jelenleg alkalmazott állatmodell sem felel meg ezeknek a különböző kritériumoknak (1. táblázat). Ugyanilyen fontos, hogy az állatok FHF-vizsgálatában jelenleg használt összes toxinról nem számoltak be, hogy emberben károsodást okozna.
1. táblázat: A fulmináns májelégtelenség és a máj encephalopathia kiváltására általánosan használt toxinok összehasonlítása
Guam jelentése az 1960-as évek elején megállapította, hogy a cikádos pálma dió a gasztrointesztinális traktus számos rákos megbetegedését váltotta ki (15). A hatóanyagot, az azoxi-metánt (AOM) azóta felhasználják a vastagbélrák laboratóriumi állatokban történő vizsgálatára (37). Érdekes módon ez a jelentés anekdotikus módon leírta, hogy a kükádpálma-dió májkárosodást okozott az embereknél, patkányoknál és az ebből a dióból származó táplálékkal táplált állatoknál (15). Ezért arra voltunk kíváncsiak, hogy az AOM a vastagbélrákok kialakulásában betöltött szerepe mellett alkalmazható-e FHF-indukáló hepatotoxinként is.
Ebben a tanulmányban az AOM mint hepatotoxin hatásait vizsgáltuk C57BL/6J egerekben. Erre a fajra korlátoztuk ezt a vizsgálatot, mert teljes állatgenetikai manipulációkat (azaz transzgéneket, kiütéseket) csak egereknél lehet elvégezni, és ez a fajta törzs a legjobban jellemezhető (27). Bemutatjuk, hogy az AOM dózisfüggő FHF-et indukál egerekben, amely nagyon jól reprodukálható, a máj mitokondriális sérülése miatt dózisfüggő módon okoz májelégtelenséget, hosszú terápiás ablakkal rendelkezik, és ezzel összefüggő encephalopathiát generál az agyi tünetekkel ödéma végstádiumú betegségben. Az AOM tehát az első toxin, amely megfelel az összes kritériumnak, amelyet korábban elengedhetetlennek neveztek az FHF állatmodellje szempontjából (28), amely szintén összefügg a máj encephalopathia kialakulásával.
Egér gondozása és karbantartása.
A hím C57BL/6J egereket (25-30 g testtömeg) a Jackson Laboratory-ból (Bar Harbor, ME) szereztük be, és 20 hetes korukban használtuk fel. Az egereket Lab Diet Formulab 5008 rágcsáló chow-val (PMI Feeds, St. Louis, MO) ad libitum-mal etettük, és szabadon hozzáférhettünk a vízhez. Az egereket mikroizolátor ketrecekben helyeztük el GreenTru laboratóriumi ágyneművel (Green Products, Conrad, IO), és kontrollált 10:14 órás (világos: sötét) fényciklusnak tettük ki őket 25 ° C-on. A videofelvétel befogadására 48 órával az AOM (Sigma, St. Louis, MO) beadása előtt az egereket folyamatos fénynek tették ki. A legtöbb kísérlethez az állatok 100 μg/g AOM-ot kaptak 100 μl steril sóoldatban (Fujisawa USA, Deerfield, IL) feloldva intraperitoneális injekcióval. Az összes kísérlethez az állatokat sóoldattal injektált kontrollcsoporttal hasonlítottuk össze.
Klinikai és biokémiai értékelés.
Annak megállapítására, hogy a hipoglikémia okozhat-e változásokat a mentális állapotban, az I. és III. Stádiumú encephalopátiás állatokat glükózzal kezelték. Miután a farokból kapott vénás véren glükométerrel (Bayer, Elkhart, IN) meghatároztuk a szérum glükózszintjét, intraperitoneálisan 50% -os oldatban elegendő glükózt adtunk a szérumszint normális visszaállításához. Az állatokat ezután folyamatosan monitoroztuk, és a szérum glükóz értékét 15 percenként ellenőriztük.
Szövetgyűjtemény.
Minden szervet, beleértve a májat, az agyat, a szívet, a tüdőt, a hasnyálmirigyet, a lépet, a vesét, a gyomrot és a beleket, összegyűjtöttük és azonnal 10% -os formalinba helyeztük. A szöveteket feldolgoztuk és paraffinba ágyazottuk a Fegyveres Erők Patológiai Intézetének (AFIP) szabványos protokolljának megfelelően (1). Minden szövethez 5 μm-es metszeteket készítettünk Spencer 820-as mikrotóm (American Optical, Buffalo, NY) alkalmazásával, 70 ° C-on 20 percig fixáltuk, majd hematoxilinnel és eozinnal festettük a standard AFIP protokoll szerint. (1).
Immunhisztokémia.
Háromlépcsős indirekt immunoperoxidáz technikát alkalmaztunk az elsődleges antitest jelölésére. A hővel rögzített szövetszelvényeket minősített alkoholokban rehidratálták, majd folyóvízfürdőben öblítették. A metszeteket 5 percig szobahőmérsékleten inkubáltuk 3% -os hidrogén-peroxidban, fényáteresztő kamrában az endogén aktivitás csillapítására. Miután a metszeteket 1x PBS-sel öblítettük, a tárgylemezeket 20 percig inkubáltuk blokkoló oldatban (90% víz, 5% sovány tej és 5% H2O2). Az oldat feleslegét eltávolítottuk, és a metszeteket 1: 250 arányban hígított gliafibrilláris savas fehérje (GFAP) primer antitesttel (Sigma) inkubáltuk 1 órán át, páratartalom-kamrában. A metszeteket PBS pufferben mossuk, majd biotinilezett anti-nyúl IgG-vel (DAKO, Carpinteria, CA) inkubáljuk 15 percig. A tárgylemezeket PBS-sel öblítettük és streptavidin-konjugált torma-peroxidázzal (DAKO) inkubáltuk 15 percig. Miután a tárgylemezeket PBS-sel leöblítettük, a fehérje azonosítást a tárgylemezek Liquid DAB szubsztrát-kromogén rendszerrel (DAKO) végzett inkubálásával végeztük 2 percig. Utolsó mosás után PBS-ben, majd vízzel, a tárgylemezeket 1 percig ellenfestettük Gills hematoxilinnal, dehidratáltuk osztályozott alkoholokban, és a Permount segítségével fedőlemezzel szereltük fel.
Mikroszkópia.
A képeket egy MicroLumina digitális letapogató kamerával (Leaf, Westborough, MA) szereztük, amely egy Planikonpo-célokkal ellátott Nikon E600 mikroszkóphoz (Tokió, Japán) volt csatlakoztatva. Transzmissziós elektronmikroszkópiát végeztünk frissen reszektált májszöveten, amelyet egy éjszakán át közvetlenül 4% -os glutáraldehidbe helyeztünk 0,1 M-os kakodilátpufferben (CB), majd 2 órán át 2% -os vizes osmium-tetroxidban CB-ben utófixáltuk. A szövetet osztályozott alkoholokban dehidratáltuk, és a mintákat tiszta Epon gyantába ágyazottuk (EMS, Fort Washington, PA), és 60 ° C-on 12 órán át polimerizáltuk. Az ultravékony metszeteket uranil-acetáttal és Reynolds ólom-citrátjával festettük, és Phillips 410 transzmissziós elektronmikroszkóppal vizsgáltuk.
Klinikai eredmények.
A 100 μg/g AOM-mal kezelt állatokban a HE bizonyítéka fejlődött ki, amelyet egy új prodromális fázis előzött meg. A prodromális fázist a csökkent spontán aktivitás, valamint az alacsonyabb táplálék- és vízfogyasztás jellemezte (1. ábra). Ez az aktivitás és az etetés csökkenése az állatok szóródási reflexének elvesztése előtt következett be, amelyet korábban az I. HE stádium jellemzőjeként határoztak meg (38). Ez a csökkent aktivitás prodromális fázisa reprodukálhatóan 5-7 órával az AOM beadása után következett be és ~ 15 órán át tartott, ekkor az állatok elvesztették szóródási reflexüket. Így a prodromális periódusban élő letargikus állatok a szórási reflex jelenléte vagy hiánya alapján megkülönböztethetők az I. HE stádiumú állatoktól. 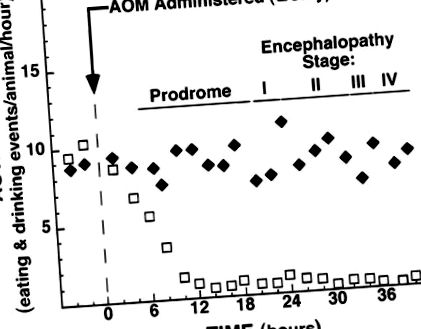
1. ábra.Az állati aktivitás megváltozása intraperitoneális sóoldattal (♦) vagy 100 μg/g azoximetánnal (AOM, □) történő injekció után a leölésig vagy a halálig. Az óránkénti vizsgálatok során a prodromális fázis inaktivitását különböztettük meg az I. stádiumú hepatikus encephalopathia (HE) letargiájától, figyelemmel kísérve az állatok reakcióját a kézi stimulációra. Az adatok azt jelentik. A hibasávok nem jelennek meg a grafikus egyértelműség megőrzése érdekében.
A második fázist a mindkettő korábban definiált stádiumban előrehaladott őszinte encephalopathia jellemezte, ideértve a szóródási ösztön elvesztését (I. stádium), az ataxiát (II. Stádium), a kiegyenlítő reflex elvesztését (III. Stádium) és a kómáig terjedést ( szakasz) (38). Az I. stádiumotn = 32) AOM injekció után. Ataxiát (HE stádium II) 24,3 ± 0,3 óra elteltével (n = 14), míg a kiegyenlítő reflex elvesztése (III. HE stádium) 33,2 ± 1,5 óra (n = 18) AOM expozíció után. A szaruhártya-reflexek és a kóma elvesztése (IV. HE stádium) 36,0 ± 0,8 óra (n = 25) injekció beadása után, ~ 3 órával később haláleset következett be (n = 20). Valójában minden 100 μg/g AOM-ot kapott állat 41 órán belül pusztult el.
Szövettani leletek.
Az AOM progresszív májkárosodást okozott, amely megelőzte a klinikai viselkedés megváltozását. A legkorábbi észlelt hisztopatológiai változás a mikrovezikuláris steatosis jelenléte volt 2 órával az AOM beadása után (2. ábraB; normál egérmáj látható A). Négy órával az AOM injekció után szinuszos dilatáció volt látható, főleg a központi véna körüli területen (2. ábraC). Mire az I. stádiumban HE 20 órával az AOM expozíció után kialakult, mély centrilobularis nekrózis nyilvánvaló volt (2. ábraD). A IV előtti korai HE állatban ez a nekrózis elsősorban vérzéses volt (2. ábraE). Tekintettel a mikrovezikuláris steatosis korai megfigyelésére, arra gondoltunk, hogy ez mitokondriális sérüléssel jár-e. A mitokondriális toxinként működő AOM-mal összhangban az átviteli elektronmikroszkópia mély károkat tárt fel a cristae-ban (2. ábraF).
2. ábra.Az AOM-kezelt C57BL/6J egerek májában megfigyelt hisztopatológiai változások. A: normál egérmáj. hematoxilyn és eozin (H&E) festés; nagyítás = × 400.B: 2 órán át AOM-nak kitett egér májrésze, amely mikrovezikuláris steatosis jelenlétét mutatja, amelyet az áttetsző kék gömbök mutatnak be. Toluolidin kék festés; nagyítás = × 1000. C: egér májszakasza 4 órával az AOM expozíció után, centrilobularis sinusoidalis dilatációval. H&E festés; nagyítás = × 400.D: az AOM beadása után 20 órával kapott metszet centrilobularis nekrózist mutat. A középzónás periférián némi vérzés figyelhető meg. H&E festés; nagyítás = × 400. E: májszakasz egy koraszülött IV. stádiumú encephalopathiás egérből. A központi vénákat 35 órával az AOM-nak való kitettség után súlyos vérzéses úton felszámolták, a fennmaradó életképes hepatociták csak a portális területeken voltak jelen. H&E festés; nagyítás = × 100.F: 8 órával az AOM beadása után kapott májszakasz transzmissziós elektronmikroszkópos vizsgálata. A sárga nyíl a mitokondriumot azonosítja. A mitokondriumok kettős falai láthatók, de a benne lévő kriszták falai nem észlelhetők. A fehér nyilak a zsírt jelzik. Ozmium-tetroxid, uranil-acetát és Reynolds ólom-citrát festése; nagyítás = × 18 000.
3. ábra.Az AOM-kezelt C57BL/6J egerek agyában megfigyelt hisztopatológiai változások. A: egészséges kontroll egér agyi szakasza. A nyilak a normálisan megjelenő asztrocitákat azonosítják. H&E festés; nagyítás = × 400.B: 35 órán át AOM-nak kitett egér agyi szakasza (IV HE stádium), amely az asztrocita ballonozását és ikerintézkedését (nyíl) mutatja, valamint a kromatin elmozdulását mutatja. H&E festés; nagyítás = × 400. C: immunhisztokémia glia fibrilláris savas fehérje (GFAP) számára egy agyi szakaszon egérből a IV HE stádiumban. Vegye figyelembe, hogy a szürkeállományban (nyíl) nincs asztrocita festés a GFAP esetében. Nagyítás = × 400. Inset:a GFAP immunhisztokémiája pozitív marad, ha III. stádiumú egéren végzik (nyíl).
Biokémiai változások.
Kiértékeltük a szérum ALT-t, az artériás ammóniát, a glükózt, az alkáli-foszfátot, a bilirubint és a kreatinint sóoldattal injektált kontrollállatokban és az AOM beadása után változó időpontokban. Az egyes enkefalopátiás stádiumok mellett 4 és 8 órával az állatokat a gyógyszer beadása után értékeltük, mivel az előbbiekben májkárosodásra utaló bizonyítékok vannak, de enkefalopátia nincs, míg utóbbiban a mentális státuszban finom változások észlelhetők.
Ahogy az várható volt, a szérum ALT növekedését figyeltük meg, amely megfelelt a májkárosodás szövettani fokának. Az ALT hasonló volt a kontroll állatokban (64 ± 14 U/l) és az állatokban 4 órával az AOM injekció után (56 ± 5 U/l) (2. táblázat), ekkor csak a szinuszos dilatációt lehetett értékelni (2. ábra)C). Az I. stádiumig azonban HE és centrilobularis hepatocyta nekrózis következett be (2. ábraD), Az ALT 5 196 ± 126 U/l-re emelkedett, és végül 12 231 ± 2 068 U/l értéket ért el a koraszülött állatban (2. táblázat). Ezzel szemben a bilirubinban (2. táblázat), az alkalikus foszfátban vagy a kreatininben nem volt szignifikáns változás (az adatokat nem mutatjuk be). A szérum bilirubin jelentős növekedésének kimutatásának elmulasztása hasonló a májkárosodásnál leírtakhoz, amelyet a kutyában az acetaminofen okoz (10), de ellentétben áll a patkány tioacetamiddal (38) vagy a nyúl (3). A hepatotoxin-asszociált hiperbilirubinémia változékonysága arra utal, hogy az ilyen változások jól tükrözhetik egy adott gyógyszer különbözõ hatásait a különbözõ fajokban, vagy hogy ezek a toxinok finom, mégis eltérõ hatással lehetnek a májfunkció megváltozására.
2. táblázat: Az azoximetán által kiváltott májelégtelenség miatt máj encephalopathiában szenvedő C57BL/6J egerek vérkémiája
Az értékek átlagosan ± SE értékek legalább 3 külön kísérlet esetében. A kontrollértékek az ebben a vizsgálatban használt állatokra és a CD-1 kinyílt albínó egerekre (Charles River, Wilmington, MA) vonatkoznak, amint arról korábban beszámoltunk (13). AOM, azoximetán; ALT, alanin-aminotranszferáz; HE, máj encephalopathia; RR, kiegyenlítő reflex; NR, nem jelentett; ÉN, nem kész.
3. táblázat: Az azoximetán okozta májkárosodás és a halálig eltelt idő dózisfüggő
A jelentett eredmények többségét 100 μg/g AOM alkalmazásával kaptuk.
F3-150 Ebbe a számba csak azok az állatok tartoznak bele, akik elpusztulnak. NA, nem alkalmazható, mert az állatok ebben a dózisban nem haltak meg AOM-ban.
Mivel más hepatotoxinok, például galaktozamin (3, 26, 33) alkalmazásakor gyakran figyelhető meg a tételenkénti változékonyság (3, 26, 33), azt is megvizsgáltuk, hogy ez korlátozhatja-e az AOM hasznosságát. Ezért 30 külön tétel AOM-ot kaptunk a forgalmazótól (Sigma). Ebből a 30 tételből véletlenszerűen kiválasztottunk 10-et, és tételenként négy állatot értékeltünk. 100 μg/g AOM-ot adtunk ezeknek az állatoknak, egyet-egyet leöltünk az I. HE és a III HE stádiumban, és hagytuk a maradékot halálra haladni. Minden esetben a HE ideje, a májkárosodás progressziója és a halálig eltelt idő azonos volt.
Ebben a tanulmányban bebizonyítottuk, hogy az AOM az első toxin, amely teljesíti az állatmodell minden alapvető kritériumát, amennyiben reprodukálható, májelégtelenség okozta halált okoz, hosszú terápiás időtartama van, és megfelelő kezelés esetén minimális veszélyt jelent a személyzet számára. Ezenkívül az AOM által kiváltott májkárosodás a HE mind a négy korábban jellemzett stádiumát generálja (38), ami különösen fontos, mivel az encephalopathia változatlanul társul az FHF-hez emberben (6, 12, 16,20). Az FHF rágcsáló AOM-modelljének egyik legfontosabb jellemzője a HE első stádiumától elkülönült és elkülönülő prodromális fázis azonosítása (1. ábra). Az encephalopathiás fázis ~ 19 óra hosszú, és a scatter reflex elvesztésével detektálható, ha a májkárosodás már kiterjedt (2. ábraD). Ezzel szemben a prodromális fázis hasonló ideig tart (1. ábra), de akkor fordul elő, ha a májkárosodás viszonylag szerény (2. ábra),B ésC). Ennek a prodromális fázisnak a tudatossága kritikus lehet a jövőbeni vizsgálatok során, amelyek megpróbálják azonosítani a HE-t okozó tényezőket.
Végül az AOM által kiváltott FHF egyik fő előnye az a látszólagos képesség, hogy májkárosodást és elégtelenséget okozhat több fajnál, beleértve az embereket is. Az AOM a ciklazin (36) aktív metabolitja, amely csak Guam szigetén található meg a cikádos pálmákban. Az 1960-as években a sziget egyetlen anekdotikus jelentésében (15) a centrilobularis régióban piknotikus magokat és fokális nekrózist azonosítottak embereknél, állatállománynál és patkányoknál már 48 órával a mosatlan cikláddió elfogyasztása után. Utólag úgy tűnik, hogy az emberek, a rágcsálók és az állatállomány guamániai FHF-je mind az AOM hepatotoxicitásának köszönhető.
Összefoglalva, az AOM dózisfüggő máj centrilobularis nekrózist okoz, valószínűleg mitokondriális toxinként hatva, amely májelégtelenséggé és halálsá válik. Ez a szer neurológiai prodromát, valamint őszinte HE-t is okoz. Ez az első olyan kórokozó, amely emberi korrelátummal alkalmazható, és amely fajok között alkalmazható, amely potenciálisan reverzibilis, reprodukálható és májelégtelenség miatt halált okoz.
Hálával tartozunk Dr. Michael D. Norenbergnek (Miami Egyetem, Miami, FL) a cikk kritikai áttekintéséért. Nagyra értékeljük a májkárosodás szövettani progressziójának betekintését Dr. Mark J. Czaja (Albert Einstein Orvostudományi Főiskola, New York, NY), valamint a központi idegrendszeri sérülés természetét Dr. Betty Ann Brody (Pathology of Pathology, Univ Illinois-ból (Chicago, Chicago, IL). Ezenkívül hálásak vagyunk Dr. Robert G. Mrteknek (Statisztikai Tanszék, Illinois Egyetem, Chicago), hogy segítséget nyújtott biokémiai eredményeink statisztikai értékeléséhez. Végül köszönjük Dwayne Harris-nek (West Side Veterans Affairs Medical Center, Chicago, IL) a szakértői technikai segítséget.
LÁBJEGYZETEK
A cikk megjelenésének költségeit részben az oldaldíjak megfizetése fedezte. A cikket ezért ezennel fel kell tüntetni:hirdetés”Szerint a 18 U.S.C. 1734. § kizárólag ennek a ténynek a feltüntetésére.
HIVATKOZÁSOK
SZERZŐ MEGJEGYZÉSEK
Az újranyomtatási kérelmek és egyéb levelezések címe: R. V. Benya, Orvostudományi Osztály, Univ. Illinois, Chicago, 840 South Wood St. (M/C 787), Chicago, IL 60612 (e-mail: [e-mail védett] edu).
- Minden szolgáltatás; Sharp Animal Hospital
- Legyél bulizó és fogyj túl
- A kacsamag takarmányként és bioüzemanyagként történő termesztésének előnyei és rendszerei
- Állatdarabok univerzális táplálkozással - a legalacsonyabb áron az állati vágásokon!
- Animal Cuts Review (2020) - Ha megvennéd