Éheztetik a glutamin ráksejtjeit: Megszakítják a varázslatot vagy készítenek egy éhes szörnyeteget?
Jie Jiang
1 Herman B Wells Gyermekgyógyászati Kutatóközpont, Indiana University School of Medicine, Indianapolis, IN 46202, USA; ude.ui@51jj (J.J.); ude.ui@virsas (S.S.)
Sankalp Srivastava
1 Herman B Wells Gyermekgyógyászati Kutatóközpont, Indiana University School of Medicine, Indianapolis, IN 46202, USA; ude.ui@51jj (J.J.); ude.ui@virsas (S.S.)
2 Biokémiai és Molekuláris Biológiai Tanszék, Indiana University School of Medicine, Indianapolis, IN 46202, USA
Ji Zhang
1 Herman B Wells Gyermekgyógyászati Kutatóközpont, Indiana University School of Medicine, Indianapolis, IN 46202, USA; ude.ui@51jj (J.J.); ude.ui@virsas (S.S.)
2 Biokémiai és Molekuláris Biológiai Tanszék, Indiana University School of Medicine, Indianapolis, IN 46202, USA
Absztrakt
1. Bemutatkozás
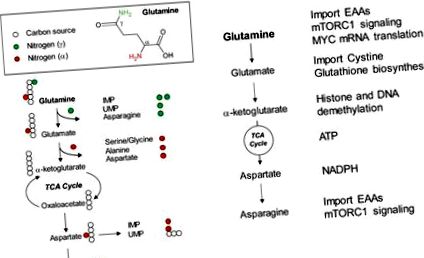
Több mint fél évszázaddal ezelőtt Harry Eagle észrevette, hogy a glutamin millimoláris szinten történő kiegészítése a szövetkultúrás közegben erőteljesen fokozhatja a sejtek növekedését és szaporodását [1]. Azóta a glutamin nélkülözhetetlen tápanyag lett a legtöbb modern szövet-tenyésztő táptalajban. Az exogén glutamin használatának oka, amely általában 5-20-szor magasabb, mint bármely más aminosav szövettenyésztő táptalajban, csak nemrégiben került a figyelem középpontjába, a rákos sejtek anyagcseréjének terén elért hatalmas fejlődésnek köszönhető [ 2,3,4]. Ma már felismert tény, hogy a glutamin egy sokoldalú bioszintetikus szubsztrát, amely szén- és nitrogénatomokat szolgáltat a makromolekulák bioszintézisének fontos prekurzorainak előállításához [5]. Ezek a fontos prekurzorok magukban foglalják a nukleotidokat, a nem esszenciális aminosavakat (NEAA) és a zsírsavakat, amelyek nélkülözhetetlen építőkövei a nukleinsavaknak, a fehérjéknek és a lipideknek. Ezenkívül a glutamin vagy glutamin eredetű metabolitok szabályozni tudják az energiatermelést, a redox szabályozást, a génátírást és az intracelluláris jelátvitelt [6,7]. Így a glutamin-anyagcsere megcélzása terápiás potenciált mutatott a preklinikai körülmények között ezen növekedést elősegítő folyamatok megzavarása révén [2].
2. Glutamin, sokoldalú bioszintetikus szubsztrát
A glutamin egy NEAA, amelyet de novo útján szintetizálni lehet glükózból származó szén és szabad ammónium felhasználásával emlősökben. Így a glutamin étrend útján történő megszerzése nem szükséges. Még mindig a glutamin az egyik legelterjedtebb aminosav az emberi plazmában (0,5
Másodszor, a glutamin képes vezérelni a TCA ciklust és az ATP termelést. Az egyik ok, amiért a rákos sejtek az exogén glutamin magas szintjére támaszkodnak, az az, hogy a glutamin felhasználható a TCA-ciklus táplálására az α-ketoglutaráton keresztül annak további oxidációjának lehetővé tétele érdekében [13]. Kimutatták, hogy a glutamin kimerülése csökkenti a NADH/NAD + arányt, ami gátolja az oxigénfogyasztást és az ATP termelést [14]. Így a bioszintézishez szükséges TCA-ciklus közbenső termékeinek feltöltése mellett a glutamin eredetű α-ketoglutarát folyamatos oxidációja a TCA-cikluson keresztül energiaforrást is jelent (1. B ábra).
3. A glutamin nem bioszintetikus szerepe
4. Glutamin éhezés: kísérleti állapot vagy kórélettani stressz?
A glutamin éhezés témáira először táplálkozási szakemberek hívták fel a figyelmet, akik észrevették, hogy a plazma glutaminszintje jelentősen csökken súlyos sérülések során [36]. A későbbiekben hasonló jelenségeket figyeltek meg sok más kóros állapot mellett, amelyek gyakran a megnövekedett katabolikus aktivitásokkal társultak a keringő glutamin veszteségének ellensúlyozására. Például izomfehérje katabolizmust alkalmaznak a plazma glutamin koncentrációjának alacsonyabb szinten tartására hosszú távú éhgyomorra [37]. Daganatos betegeknél a plazma glutamin koncentrációja is csökken [38]. Úgy gondolták, hogy a daganattal társult szövődmények, például a cachexia, a keringésben lévő aminosavak csökkent koncentrációjának következményei lehetnek. Ennek eredményeként kiderült, hogy a glutamin étrendben történő kiegészítése csökkenti az izmok lebomlását és fokozza az immunfunkciókat bizonyos kemoterápiában részesülő rákos betegeknél [39].
Figyelembe véve azt a tényt, hogy a rákos sejtek növelik a glutamin fogyasztását a bioszintézis támogatása érdekében, a rákos betegek véráramában megfigyelt glutamin koncentráció csökkenése felveti azt a hitet, hogy a glutamin korlátozása előfordulhat a tumor progressziója során. Valójában a tumorszövetekben vagy a tumorszövetek körüli testnedvek glutaminszintjét alacsonyabbnak találták, mint a normál szövetek vagy plazma [8,9,10,40]. Ezenkívül a legutóbbi munka arra utal, hogy a glutamint még ugyanabban a daganatszövetben is tovább kimerítették a xenograft tumorok magjában, összehasonlítva a daganatok perifériájával [23]. Ez az eredmény összhangban áll azzal a felfogással, hogy a nem megfelelő vaszkuláris tápanyagellátás továbbra is gátja a daganat belső tömegének felhalmozódásának [41]. Így a közelmúltban kiterjedt erőfeszítéseket tettek annak megértésére, hogy a tumorsejtek hogyan alkalmazkodnak a glutamin korlátozásához további progressziójuk érdekében. Ezek a mechanizmusok magukban foglalják a jelátvitel által közvetített sejtek sorsdöntését, a proteolitikus eltávolítást, a glutamin fokozott de novo bioszintézisét és más tápanyagok felhasználásának újbóli bekötését [5].
5. Egyéb aminosavak hatása a glutamin éhezésre
Érdekesség, hogy az elmúlt öt év tanulmányai azt sugallják, hogy más tápanyagok, különösen a NEAA-khoz való hozzáférés mélyen befolyásolhatja a tumorsejtek reakcióját a glutamin éhezésre [42,43,44,45,46,47]. Az aszparagin, az aszpartát és az arginin képesek megvédeni a tumorsejteket a glutamin éhezéstől vagy a glutamin katabolizmus blokkjától; míg a cisztinfelvétel növeli a sejtek érzékenységét ezekre a zavarokra. A következő néhány szakaszban megvizsgáljuk ezen eredmények mindegyikének hatását a glutamin anyagcseréjének megértésére, valamint lehetséges terápiás alkalmazásukra a rákban.
5.1. Asparagine
Ez a két munka azt jelzi, hogy a legtöbb glutamin-függő bioszintetikus aktivitás továbbra is folytatódhat, az aszparagintermelés kivételével, amikor az exogén glutamin hiányzik. Valóban, az érrendszert képző endothelsejtekben és a Kaposi szarkómával társult herpeszvírus (KSHV) transzformált fibroblaszt sejtekben végzett munka az aszparagin hasonló hatását mutatta a sejtek túlélésének és szaporodásának támogatására a glutamin kimerülése után [48,49]. Fontos, hogy az aszparagin fiziológiai tartományon belüli koncentrációban képes megmenteni a glutamin-fogyás okozta növekedési rendellenességet az emlődaganatos sejtekben (25
100 μM) [44]. Ebben a koncentrációtartományban a többi NEAA egyik sem képes megmenteni a proliferációt. Ezenkívül egy katalitikusan aktív aszparagináz, az aszparagin lebontására szolgáló enzim bevezetése az alsó gerinces állatokból az emlős sejtekbe megakadályozza az aszparagin képességét a glutamin éhezés fiziológiai koncentrációban történő megmentésére. Mivel a feltételezett humán aszparagináz minimális aszparagináz aktivitást mutat [44], a szerzők evolúciós nyomást feltételeznek aktivitásuk szelektív elvesztésének előidézésére emlőssejtekben, mint az intracelluláris aszparagin megőrzésének eszközét, hogy közvetítsék a sejtek alkalmazkodását a környezeti glutaminszint patofiziológiai változásaihoz. [44].
Továbbá, a glutaminhoz hasonlóan, az intracelluláris aszparagin is képes volt ellenionként működni az extracelluláris EAA-k cseréjére az mTORC1 aktivitás fenntartása érdekében [29,50]. Az aszparagin kiegészítése DMEM tápközegben, amely rutinszerűen nem tartalmaz aszparagint, fenntarthatja az mTORC1 aktivitását, amelyet egyébként a glutamin nélkülözés nyomán elnyomnak [44]. Azt, hogy az mTORC1 aktivitás aszparagin kiegészítéssel történő helyreállítása szerepet játszik-e a tumorsejtek növekedésében/túlélésében a glutamin éhezés során, még meg kell határozni.
5.2. Aszpartát és arginin
A közelmúltban kiderült, hogy az arginin képes támogatni a tumorsejtek alkalmazkodását a glutamin éhezéshez [46]. Kimutatták, hogy a glutamin-depriváció p53-függő módon indukálja az SLC7A3 arginin transzporter expresszióját a sejtfelületen az arginin felvételének megkönnyítése érdekében. Következésképpen az arginin intracelluláris akkumulációja fenntartja az mTORC1 aktiválódását és a sejtek növekedését/proliferációját. Érdekes, hogy az arginin nem járul hozzá a TCA ciklusához az ornitin, a glutamát konverzió vagy a karbamid ciklus alatt történő fumarát felszabadulás útján [46]. Szükség van-e további vizsgálatokra arra, hogy a glutamin éhezés során képes-e támogatni más makromolekulák bioszintézisét.
5.3. Cisztin
Az aszparaginnal, az aszpartáttal és az arginintől eltérően a cisztinről kiderült, hogy növeli a tumorsejtek érzékenységét a glutamináz gátlásra, ha a szöveti tenyésztő tápközeg fiziológiai szintje fölé egészíti ki [47]. Mivel az xCT transzporteren keresztüli cisztinfelvétel a glutamátot ellenionként cserébe használja, felvetésre került, hogy a cisztin/glutamátcsere függőséget teremtsen a glutamináztól a glutamin dezaminálásának és a glutamát termelésének fenntartása érdekében [47]. Érdekesség, hogy a cisztinimportról beszámoltak, mint a glutamin/glutamát-függő antioxidáns védekezés központi eleméről [15]. Ezek együttesen arra utalhatnak, hogy a glutamin felhasználásának pontos ellenőrzésére van szükség az optimális daganatnövekedéshez, különösen akkor, ha az exogén glutaminellátás veszélybe kerül. A daganatos sejtek glutamin eredetű glutamátra támaszkodnak a cisztin cseréjében, amely az intracelluláris cisztein fő forrása, a fehérjeszintézis és a glutation termeléséhez szükséges NEAA; másrészt a túlzott cisztinfelvétel glutamát kimerülést okozhat, ezáltal megakadályozva annak további felhasználását a TCA-ciklus vagy a transzaminálás során.
6. Mi a kritikusan korlátozó metabolit a glutamin éhezés során?
A fent említett összes eredmény arra utal, hogy létezik egy átfogó program a tumorsejtek glutamin korlátozáshoz való alkalmazkodásának közvetítésére. Az a tény azonban, hogy egynél több aminosav megváltoztathatja a daganatos sejtek reakcióit a glutamin éhezésre vagy annak katabolikus gátlására, kihívást jelent a glutamin anyagcseréjének rákos megbetegedéseinek hatékonyságában. Nyilvánvaló kérdés lehet, hogy a daganatsejtek miért választanak különböző aminosavakat az exogén glutamintól való függőségük modulálására. A legegyszerűbb válasz az, hogy a tumorsejtek belső tulajdonsága eltér. Ezt a specifitást a daganat eredete, az onkogén/tumor szuppresszor státus és a tumor mikrokörnyezete szabhatja meg. Például megjósolhatja, hogy a p53 funkcióvesztésével járó daganatok nem képesek alkalmazkodni a glutamin éhezéshez aszpartát vagy arginin felvétele révén. További vizsgálatok szükségesek olyan kiegészítő stratégiák kidolgozásához, amelyeket kombinálni kell, amikor a glutamin metabolizmusát célozzák rákban.
Felmerülhet azonban az a kérdés, hogy a daganatsejtek miért nem tudják egyszerűen felhasználni a glutamin eredetű szenet és nitrogént az aszparagin szintetizálásához az aszparagin szintetázon (ASNS) keresztül, amely a szilárd tumorsejtekben erősen expresszálódó enzim [51], ha maga a glutamin nem korlátozó. Egy nemrégiben készült jelentés talál egy nyomot, amely azt mutatja, hogy az aszparagin relatív bioszintetikus energiaköltsége a legmagasabb a kilenc NEAA (Asn, Asp, Gln, Ser, Arg, Pro, Glu, Ala, Gly) között, amelyeket szintetizálnak glikolízisből és A TCA ciklusból származó szénforrás emberben [52]. Ez valószínűleg annak köszönhető, hogy magas az energiaköltség a glükóz szén-fluxusának fenntartásához, hogy a TCA-cikluson keresztül glutamát, glutamin és aszpartát keletkezzen, amikor exogén glutamin nincs. Spekulálhatunk, hogy bár a tumorsejtek magas szintű ASNS-t expresszálnak, nem képesek megengedni maguknak az aszparagintermeléshez szükséges további energiát. Nevezetesen, maga a glutamin szükséges a fehérjeszintézishez. Ebben a tekintetben az aszparagin de novo megkönnyíti a glutamin szintézisét a glutamin szintetáz (GLUL) poszttranszkripciós indukcióján keresztül a glutamin éhezés során [44].
7. A kritikusan korlátozó metabolit meghatározását befolyásoló legfontosabb változatok
A kritikus korlátozó metabolit meghatározása minden kontextusban nem csak a glutamin metabolizmus biokémiája és biológiai funkciói közötti alapvető összefüggést fogja tisztázni, hanem új metabolikus célokat is biztosít, amelyek gátolhatók a glutamin metabolizmus rákos megbetegedéseinek hatékonyságának fokozása érdekében. A kritikus korlátozó metabolit meghatározásához azonban számos tényezőt kell szigorúan figyelembe venni.
Először is, a szövettenyésztő táptalajban lévő aminosav-összetétel határozza meg az éhezés típusait. A Dulbecco által módosított Eagle táptalaj (DMEM), amely nem tartalmaz exogén aszparagint és aszpartátot, a glutamin-nélkülözés várhatóan legalább ezen három aminosav intracelluláris kimerülését okozza [42,44,46]. Ezzel szemben a Medium 199 az összes NEAA-t tartalmazza, az aszparagin kivételével, és így a glutamin-nélkülözés a glutamin és az aszparagin kimerülését okozhatja, az aszpartátot azonban nem [48]. Hasonlóképpen, az összes NEAA-val kiegészített DMEM-ben a glutamin-nélkülözés csak magát a glutamint képes kimeríteni, kivéve, ha az aszpartátfelvétel blokkolva van [45]. Ebben az esetben a túlzott aszpartát sejtfelszíni transzporterén keresztül történő felvétele nemcsak megmentheti az aszpartát-függő nukleotid- és fehérjeszintézist, hanem támogathatja a TCA-ciklus közbenső termékeinek feltöltését is a glutamin de novo bioszintézisének elősegítésére (2. ábra C).
Másodszor, a glutamin-nélkülözés és a glutamináz-gátlás meghatározhatja a kritikusan korlátozó metabolitok különböző típusait. Kísérleti körülmények között, amikor az exogén glutamin kimerül vagy alacsony szintre csökken, megjósolható, hogy az összes glutamin-függő sejtes folyamat sérül. A glutamináz-gátlás azonban várhatóan blokkolja a glutamin-glutamát-átalakulást és további felhasználását a TCA-ciklusban, a NEAA-termelésben és a nukleotid-bioszintézisben. Ebben a környezetben nem várható, hogy maga az intracelluláris glutamin és a glutamin-függő növekedés/túlélés szignalizációja korlátozná. Az a tény, hogy az exogén aszpartát megmenti a glutamináz gátlását nukleotid szintézissel, de a TCA-ciklus és más NEAA-k nem, azt sugallja, hogy ezek az anyagcsere-aktivitások folytatódhatnak, valószínűleg más szénforrások felhasználásával a szövet-tenyésztő közegben [43] (2. ábra D). Figyelembe kell venni, hogy a glutamin szintén nélkülözhetetlen nitrogénforrás a nukleotidok bioszintézisében az aszpartáttól függetlenül (1. A. ábra). Az a tény, hogy a glutamináz gátlását követően maga a glutamin korlátlan, megmagyarázhatja, hogy ezek a sejtek miért nem igényelnek exogén aszpartátot a TCA-ciklus támogatásához, ami a glutamin de novo bioszintézisének szükséges folyamata.
Harmadszor, a sejtproliferációért és a túlélésért felelős kritikus korlátozó metabolit glutamin korlátozás alatt eltérő lehet. Mivel a sejtproliferációhoz biomassza felhalmozódásra van szükség, akkor számíthatunk arra, hogy amikor egyetlen aminosav képes megmenteni a sejtproliferációt a glutamin-nélkülözés vagy a glutamináz-gátlás során, az összes makromolekula bioszintézisének folytatódnia kell (2. ábra B – D). Ebben a helyzetben a tumorsejteknek meg kell őrizniük a megfelelő mennyiségű aminosav megszerzésének képességét, beleértve az aszparagint, az aszpartátot, a glutamátot és magát a glutamint is a fehérjeszintézishez. Ezen túlmenően ezen aminosavak egy részét olyan szinten kell megszerezni, hogy támogassa más makromolekulák prekurzorainak bioszintézisét. Például az aszpartát és a glutamin a nukleotid-bioszintézis nélkülözhetetlen előfutára. Azonban abban a helyzetben, ahol egyetlen aminosav csak a túlélési hibát képes megmenteni, mint például az arginin, a makromolekulák bioszintézise nem szükséges (2. E ábra). Valójában továbbra is megfoghatatlan, hogy melyek a legfontosabb kritikus korlátozó metabolitok a sejtek túlélésére a különböző típusú metabolikus stressz alatt. Úgy gondolják azonban, hogy a jelátviteli utakban bekövetkező változások magukban foglalják a tápanyagok érzékelését, a stresszreakciót és az apoptózist [42,46,53].
8. A glutamin éhezés komplexitása tumorokban in vivo
9. Terápiás következmények
10. Következtetések
Köszönetnyilvánítás
Köszönjük Melissa Evans-nak, hogy elolvasta a kéziratot.
- Az éhező rák a kedvenc ételeinek, a glükóznak és a glutaminnak az amerikai tanácsának levágásával
- A kutatások szerint a növényi tápanyagok kombinációja megöli az emlőrák sejtjeit - írja a ScienceDaily
- A glükóz és a glutamin éhező rákja
- Pavel Durov éhes, hogy a Telegram felhasználóit boldoggá tegye a Techgaming számára
- A professzionális férfi modellek elmondják nekünk, hogyan lehet betörni az ipar divatbabjaiba