Elsődleges és másodlagos hiperoxaluria: A rejtély megértése
Levelezés: Dr. Mohamed G Atta, MD, MPH, Nefrológiai Osztály, Johns Hopkins Egyetem, 1830 E. Monument Street, Suite 416, Baltimore, MD 21287, Egyesült Államok. ude.imhj@1attam
Telefon: + 1-410-9555268 Fax: + 1-410-9550485
Absztrakt
Alap tipp: A hiperoxaluria olyan rendellenesség, amelyet a vizelet oxalátjának fokozott kiválasztása jellemez. Az elsődleges hiperoxaluria az oxalát-anyagcsere örökletes hibája, míg a másodlagos hiperoxaluria az oxalát, annak prekurzorai vagy a megváltozott bélflóra fokozott lenyelésében jelentkezik. Ezek a rendellenességek visszatérő vesekövekhez, nephrocalcinosishoz és végül a végstádiumú vesebetegségekhez vezethetnek. E közös jellemzők ellenére a hiperoxaluria altípusai patogenezisükben, a klinikai megjelenés súlyosságában és a kezelési tervben különböznek. Ezeknek a rendellenességeknek azonnali klinikai felismerése és megkülönböztetése elengedhetetlen nemcsak az időben történő beavatkozáshoz, hanem befolyásolja a hiperoxaluriában szenvedő betegek prognózisát is.
BEVEZETÉS
Az oxalát az oxálsav ionos formája, és számos állati és növényi forrásból származik. Az oxalát főleg a vesén keresztül ürül. A hiperoxaluria a rendezetlen anyagcsere állapota, amelyet az oxalát fokozott vizelettel történő kiválasztása jellemez. Az oxalát normál napi kiválasztása egészséges egyénekben 10-40 mg/24 óra. A 40-45 mg/24 óra koncentrációt meghaladó koncentráció klinikai hiperoxaluriának számít [1-3]. Ennek oka lehet az oxalát fokozott endogén termelése primer hiperoxaluriában (PH), vagy fokozott bélfelszívódás, vagy fokozott oxalát prekurzorok bevitele másodlagos hiperoxaluriában (SH).
A hiperoxaluria potenciálisan pusztító következményeket okozhat, amelyek már csecsemőkorban vagy az élet hatodik évtizedében jelentkezhetnek, és ha nem kezelik megfelelően, jelentős morbiditást és halandóságot okozhat, beleértve a végstádiumú vesebetegségeket (ESRD) [4]. A megemelkedett plazma oxalátszint oxalát lerakódáshoz vezet a különféle szervrendszerekben. Meg kell akadályozni a szisztémás oxalózist, de a diagnózis a betegek több mint 40% -ánál késik. Hoppe és mtsai [5] felmérésében a betegek 30% -át csak akkor diagnosztizálták, amikor már elérték az ESRD-t. Bizonyos esetekben a diagnózis először akkor állapítható meg, amikor a betegség vesetranszplantációt követően kiújul [6]. A hiperoxaluria továbbra is kihívást jelentő betegség, és a megfelelő kezelés magas gyanakvási indexet és időben történő diagnózist igényel.
Ez az áttekintés kiemeli az elsődleges és a másodlagos hiperoxaluria hátterében álló mechanizmusokat, a klinikai megnyilvánulásokat, a szűrés és a diagnózis fontos elemeit, valamint a kezelés módozataival kapcsolatos jelenlegi ismereteinket.
OXALÁT FORRÁSOK
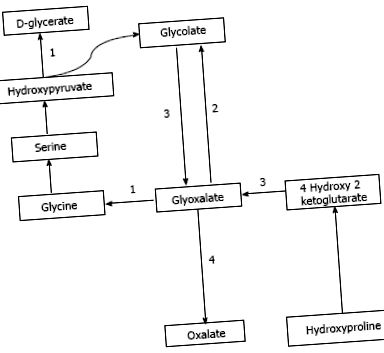
Az oxalátot exogén forrásokból, valamint endogén szintézisből nyerik. Az oxalát bőségesen megtalálható növényi és állati forrásokban. Az oxalátban leggazdagabb étrendi források közé tartozik a dió, a szilva, a csokoládé, a cékla, az eper, a rebarbara, a tofu és a spenót [1,7]. A gyümölcscentrifugálás egy közelmúltban népszerű tendencia, amikor főleg gyümölcs- és zöldségleveken alapuló étrendet fogyasztanak, és nagyon magas mennyiségű napi oxalátot nyújthat [8,9]. Tanulmányok kimutatták, hogy az oxalát étrendi bevitelének növekedésével nő az oxalát vizeletben történő koncentrációja is [10]. Az oxalát endogén szintézise a májban történik [11] egy olyan útvonalon keresztül, amely köztes molekulaként generálja a glioxalátot [12]. A glioxalát szintetizálódik a glikolát oxidációjából a glikolát-oxidáz enzimatikus hatásán keresztül, vagy a hidroxi-prolin metabolizmusából, amely a kollagénben vagy az étrendi forrásokban található meg. A megnövekedett glioxalát enzimaktivitás hiányában a laktát-dehidrogenáz hatására oxaláttá alakul át, amint az a PH különböző típusaiban látható [12,13]. Ezt az utat az 1. ábra mutatja .
Az oxalátszintézis és az enzimatikus hibák útja a PH-ban. A: PH1, alanin-glioxalát-aminotranszferáz; B: PH2, glikolát-reduktáz-hidroxi-piruvát-reduktáz; C: PH3, 4-hidroxi-2-ketoglutarát-aldoláz; D: Laktát-dehidrogenáz.
AZ OXALÁT RENÁLIS KEZELÉSE
A vese-oxalát kezelése magában foglalja a glomeruláris szűrést, a tubuláris szekréciót és a tubuláris reabszorpciót [14,15]. A glomeruláris szűrés a plazma oxalát szintjétől függ, míg a tubuláris transzportot az SLC26 transzportfehérjék családja közvetíti. Az SLC26A1 közvetíti az oxalát felvételét a bazolaterális membránon át a sejtbe szulfátért cserébe [16,17]. A tubuláris sejtek apikális oldalán az SLC26A6 a domináns klorid-oxalátcserélő, amely elősegíti a klorid visszaszívódását az oxalát szekréciója fejében, és szerepet játszik a vesekövek kialakulásában. Ez a hőcserélő az oxalát bél szekrécióját is közvetíti, és kimutatták, hogy ennek a hőcserélőnek a csökkenése elősegíti az oxalát fokozott bélfelszívódását a vékonybélben [18,19]. Patkány vese során tubuláris reabszorpciót mutattak ki a proximális tubulus S1 és S2 szegmensében [14], ami segíthet csökkenteni a kalcium-oxalát túltelítettségre való hajlamot a nephron korábbi részeiben [3].
Összességében elmondható, hogy a tubuláris szekréció hozzájárulása a glomeruláris szűrés mellett kritikus a plazma oxalát szintjének szabályozásában, mivel erős összefüggést bizonyítottak a magas plazma oxalát szint és az oxalát szekréció között [20]. Azt is megjegyezték, hogy a tubuláris oxalát-szekréció fokozódik a PH-betegeknél, valószínűleg a szisztémás oxalózis életveszélyes következményeinek enyhítésére tett kísérlet [21]. Fokozott tubuláris szekréciót figyeltek meg a bél bypass utáni hyperoxaluriában szenvedő betegeknél is [22].
A BETEGSÉG GENETIKAI ÉS BIOKÉMIAI ALAPJA
Elsődleges hiperoxaluria
Az 1. típusú elsődleges hiperoxaluria (PH1) a PH leggyakoribb és legsúlyosabb formája. A PH esetek körülbelül 80% -át teszi ki, és a B6-vitamintól függő máj peroxiszomális enzim, az alanin-glioxalát-amino-transzferáz (AGT) hibája okozza. Ez az enzim katalizálja az L-alanin és a glioxalát transzaminációját piruváttá és glicinné. Az enzimhibát a 2. kromoszómán található AGXT gén mutációjának tulajdonítják [23,24].
A 2-es típusú primer hiperoxaluria (PH2) a PH-ban szenvedő betegek körülbelül 10% -át képviseli. A glioxalát/hidroxi-piruvát-reduktáz (GRHPR) enzim diszfunkciója a 10. kromoszómán elhelyezkedő GRHPR gén mutációjának másodlagos következménye. Következésképpen fokozódik az L-glicerinsav és az oxalát vizelettel történő kiválasztása.
A 3. típusú primer hiperoxaluria (PH 3) egy nemrégiben leírt entitás, és 10% -ban fordul elő PH esetekben. A PH3 genetikai hibáját a 9. kromoszómán található HOGA1 génen lokalizálták, amely a mitokondriális 4-hidroxi-2-oxoglutarát-aldolázt kódolja [28]. Ez az enzim a 4-hidroxi-2-oxoglutarátot piruváttá és glioxaláttá bontja, ami viszont oxaláttá alakul.
MÁSODLAGOS HYPEROXALURIA
Az SH okai az étrend és a bél felszívódásának növekedése (enterális hiperoxaluria), az oxalát prekurzorok túlzott bevitele és a bél mikroflóra megváltozása.
Fokozott étrendi oxalátfogyasztás
Az oxalátban gazdag táplálékforrások között szerepel a rebarbara és a spenót, és a napi bevitel meghaladhatja az 1000 mg/nap mennyiséget [29]. Fokozott étrendi felszívódás fordulhat elő a „gyümölcsleveknél”, amelyeket egészségügyi divatként szaporítanak a méreganyagok eltávolítására a testből és a fogyásra is. Korábban úgy gondolták, hogy az étrendi oxalát csak minimálisan (10% -20%) járul hozzá a vizelettel kiválasztott oxalát mennyiségéhez, de tanulmányok kimutatták, hogy ez nem helyes. Holmes és mtsai [10] tanulmányában a táplálékbevitel hozzájárult az oxalát-szekréció körülbelül 50% -ához, ami azt bizonyítja, hogy az étrendi lenyelés fontos meghatározó tényező az oxalát teljes kiválasztásában. Az ételtől származó oxalát biológiai hozzáférhetőségét és így a vizelet oxalátját az ételben lévő oxalát formái, az élelmiszer-feldolgozás és a főzés technikája, valamint az étkezés egyéb alkotórészei is befolyásolják [30]. Az oxalát étrendi bevitele csökken az oxaláttal komplex és oldhatatlan sókat képző kalcium vagy magnézium egyidejű bevitelével [10,31].
A zsír felszívódási zavarával összefüggő hyperoxaluria
A zsír felszívódási képessége fokozza az oxalát bélben történő felszívódását a bél fokozott oxalátáteresztő képessége, valamint a kalcium- és zsírsav-komplexek képződése miatt, ami megnövekedett mennyiségű oldható oxalátot eredményez. Ehhez a mechanizmushoz intakt vastagbél szükséges az oxalát fokozott felszívódásához [32]. A hyperoxaluria ezen formája részleges gastrectomiában, bariatrikus műtétben, jejunoilealis bypassban és gyulladásos bélbetegségben látható [7,33].
Az oxalobacter formigének szerepe
Az oxalobacter formigének (O. formigenes) egy aerob gram-negatív baktérium, amely oxalátot használ energiaforrásként, és csökkenti az oxalát bélben történő felszívódását, és ezáltal csökkenti a vizelettel történő oxalát kiválasztást [34,35]. Ezt mind emberi, mind állatkísérletekben jól dokumentálták [36,37]. Ennek a baktériumnak az elvesztése az antibiotikumok alkalmazása után következik be [38], és helyreállításának szerepe lehet a hiperoxaluria kezelésében.
Az oxalát-prekurzorok túlzott bevitele
Az aszkorbinsav (C-vitamin) az oxalát előfutára, és túlzott mennyiségű C-vitamin bevitele kalcium-oxalát kicsapódását eredményezheti [39,40]. Az oxalát az etilén-glikol terméke, amely kalcium-oxalát lerakódást és veseelégtelenséget okoz [41,42]. Hyperoxaluriáról beszámoltak a vesetranszplantációt követően is az oxalát mobilizációja és a vesealografton belüli lerakódás következtében [43]. Az oxalát fokozott bélfelszívódásáról és a tubuláris szekrécióról beszámoltak olyan betegeknél is, akiknél cisztás fibrózis hyperoxaluriához vezetett [3,44,45].
A „gyümölcslevek” külön említést érdemelnek, mivel nagy mennyiségben tartalmaz napi oxalátot. A megnövekedett folyadékfogyasztás a lében növeli az oxalát paracelluláris felszívódását a belekben. Ez elsöprheti a vese azon képességét, hogy kiválassza a megnövekedett étrendi terhelést, különösen krónikus vesebetegségben szenvedő betegeknél. Az oxalátot a gyümölcslé, például a kivi, a spenót és a cékla elkészítéséhez használt gyümölcsök és zöldségek fogyasztják. Az alacsony kalciumbevitel és a C-vitamin feleslegének bevitele szintén megállapítható, ami az oxalát bevitelével együtt növeli az akut vesekárosodás kockázatát [8,9].
KLINIKAI ELŐADÁS
A PH1 prevalenciája körülbelül 1-3 eset/millió lakos [46,47]. Az európai és japán vizsgálatokban a gyermekpopulációban észlelt ESRD legalább 1% -a tulajdonítható a PH1-nek [48,49]. Gyakrabban Kuvaitban és Tunéziában élnek, ahol társasági házasságokat kötnek [50,51]. A PH1 a legsúlyosabb PH-típus, bár klinikai megjelenése jelentősen változó. A betegek csecsemőkorban az élet korai szakaszában életveszélyes oxalózissal, boldogulási kudarccal vagy felnőttkorban fordulhatnak elő, miután alkalmi kő elhaladt. Összességében a betegséget visszatérő nephrolithiasis és progresszív nephrocalcinosis jellemzi, ami vesekárosodáshoz vezet, és ennek eredményeként a betegek többsége az élet 3. – 5. Évtizede alatt éri el az ESRD-t [52,53].
A PH2 a PH kevésbé agresszív formája, jobban megőrzi a vesefunkciót, és alacsonyabb a végstádiumú vesebetegségek és kevésbé súlyos nephrocalcinosis előfordulási gyakorisága a PH1-hez képest. A különbségeket a magasabb oxalátkiválasztás okozza a PH1-ben és a megváltozott vizeletösszetétel, csökkentett vizelet-citrát- és magnéziumszint a PH1-ben, összehasonlítva a PH2-vel [54].
A PH3 általában visszatérő vesekőbetegséggel jár az élet első évtizedeiben. Jellemzi továbbá a vizelet kalciumszintjének növekedése, és a HOGA1 gén genetikai hibáit idiopátiás kalcium-oxalát urolithiasis eseteiben is felmerültek [55]. A betegség lefolyása jóindulatúbb a többi formához képest, és bár korlátozott klinikai adatok állnak rendelkezésre, a PH3 esetében eddig nem jelentettek ESRD eseteket [56,57].
A másodlagos hiperoxaluriában szenvedő betegek hajlamosak a visszatérő kalcium-oxalát kövek kialakulására az alapbetegség miatt. Ez a vesekárosodás súlyosbodásához és az ESRD-hez való progresszióhoz vezet. A szisztémás oxalózis ritkábban fordul elő másodlagos hyperoxaluria esetén, de a Crohn-kór néhány súlyos eseteiről számoltak be [58].
RENDSZERES OXALOSIS
A kalcium-oxalát sók rosszul oldódnak a testnedvekben. A kalcium-oxalát nefrocalcinosisként lerakódik a veseszövetben, és veseköveket is képez (nephrolithiasis). Ez progresszív vesekárosodáshoz és gyulladáshoz, valamint tubuláris obstrukcióhoz vezet, amely interstitialis fibrózishoz, a vesefunkció csökkenéséhez és végül ESRD-hez vezet [52,59].
Amikor a glomeruláris szűrési sebesség (GFR) 30-40 ml/perc/1,73 m 2 alá csökken, a kalcium-oxalát kiürítésének veseképessége jelentősen romlik. Ebben a szakaszban a kalcium-oxalát az extra vese szövetekben kezd lerakódni az úgynevezett szisztémás oxalózis folyamatban. Kalcium-oxalát lerakódásokról számoltak be a szívizomban, a szívvezetési rendszerben, a vesékben, a csontokban és a csontvelőben. Ez kardiomiopátiához, szívblokkhoz és egyéb szívvezetési hibákhoz, érrendszeri megbetegedésekhez, retinopathiához, synovitishez, oxalát osteopathiához és vérszegénységhez vezet, amelyekről megállapítható, hogy ellenállnak a kezelésnek [52,60,61].
HYPEROXALURIA SZŰRÉSE
A hyperoxaluria szűrését minden olyan gyermeknél el kell végezni, akinek az első vesekő-epizódja van, és minden olyan felnőttnél, akinek visszatérő kalcium-oxalát köve van. A szűrést a nephrocalcinosis vagy a kőbetegség családi kórelőzményének első bemutatásakor is el kell végezni bármely életkorban. Továbbá szűrést kell ajánlani egy indexes eset rokonainak. A PH1-t szigorúan figyelembe kell venni minden ismeretlen etiológiájú veseelégtelenségben szenvedő beteg különbségében, különösen akkor, ha csökkent vesefunkciójú nephrocalcinosis van, vagy gyakran fordul elő vesekő. A monohidrát-kalcium-oxalát kristályok jelenléte a biológiai folyadékokban vagy szövetekben szintén erős mutató a primer hiperoxaluria felé, és további vizsgálatokkal kell kísérni [62].
DIAGNÓZIS
A hiperoxaluria diagnózisát klinikai, radiológiai, biokémiai, hisztopatológiai és genetikai vizsgálatok kombinációjával állapítják meg primer hiperoxaluriában. A pontos diagnózis kiemelten fontos a prognosztikai és kezelési vonatkozások szempontjából, valamint a prenatális szűrés szempontjából is megfelelő esetekben, ha PH gyanúja merül fel.
A hyperoxaluria klinikai gyanúja esetén a diagnosztikai munkát ultrahanggal vagy más radiológiai képalkotással kell kezdeni a vesék és a húgyutak többi részében, hogy megerősítsék a nephrocalcinosis és az urolithiasis jelenlétét [2,53]. Kőelemzést kell végezni, és ez eredményezheti a PH kezdeti diagnosztikai nyomát. A PH-ban lévő kövek monohidrát-kalcium-oxalátból (whewellite) állnak, amelyek súlyzó alakú formát öltenek [63].
A kezdeti biokémiai vizsgálatok magukban foglalják a vizelet oxalátkiválasztását, előnyösen 24 órás vizeletgyűjtéssel mérve, és ajánlott az oxalátkiválasztás beállítása a testfelület 1,73 m 2 -énként [2]. A vizelet oxalátja: a vizelet kreatinin aránya használható, de ismerni kell az életkorra jellemző normális értékeket. Ezeket az értékeket azonban körültekintően kell értelmezni, mivel az arány csökken a korai életkorban, és a táplálékfelvétel alapján változó is. Az oxaluriát két vizeletmintával kell igazolni. A PH-t a vizelet oxalátkiválasztása jellemzi> 1,0 mmol/1,73 m 2/24 óra többségében, és egyes esetekben meghaladhatja a 2,0 mmol/1,73 m 2/24 órát, ellentétben a normális vizeletürítéssel, amely általában 24 óránként 2. 24 órán át> 0,8 mmol/1,73 m 2> hiperoxaluriában szenvedő betegeknél meg kell mérni a vizelet glikolát- és glicerátszintjét. A PH1-es betegek körülbelül kétharmadának megemelkedik a vizelet glikolátszintje, de fontos megjegyezni, hogy a normál glikolátszint nem zárja ki a diagnózist. A vizelet glicerátszintje magasnak mondható a PH2 betegeknél [2,53].
A GFR csökkenésével az oxalát vizelettel történő kiválasztása csökken, és a vizelet oxalátbecslése már nem biztos, hogy pontos. Ilyen körülmények között meg kell mérni a plazma-oxalátot. ESRD-ben szenvedő PH-betegeknél a plazma oxalát szintje tipikusan magasabb, mint 80 μmol/L, míg nem PH hiperoxalurikus betegeknél a plazma oxalát szintje 30-80 μmol/L között mozoghat [64-66]. Ez ellentétes normál alanyok 1-5 μmol/l plazma-oxalát-szintjével [1].
A nem invazív, végleges PH diagnózist az AGXT, GRHPR és HOGA1 gének tesztelése biztosítja. 150 ismert mutáció van az AGXT-re [67], 16 a GRHP-re [26] és 15 a HOGA1-re [28,55-57,68]. Williams és mtsai [69] kimutatták, hogy az AGXT három leggyakoribb mutációjának célzott elemzése (c.33_34insC, c.508G> A és c.731T> C) 34,5% PH1-ben diagnosztizálja a diagnózist, míg az exon 1 exonszekvenálása, 4 és 7 növeli a hozamot és lehetővé teszi a diagnózist a PH1 betegek 50% -ában. A prenatális diagnózis elvégezhető a chorionus villusok tesztelésével. Azoknál a betegeknél, akiknek egy vagy nem ismert mutációja van, a diagnózis érdekében intragén és extragén kötési elemzés ajánlott [70,71]. Ha a DNS-szűrés nem diagnosztikus, de a klinikai gyanú magas, a máj diagnosztizálásához májbiopsziát kell végezni. Ez azonban invazív módszer, és magas a szövődmények, például a vérzés kockázata [53].
Az SH-ben a kövek általában kevertek (whewellite és weddellite), ellentétben a PH-val. A vizelet oxalátjának kiválasztása megnövekszik SH-ben, és 24 órán át> 0,7 mmol/1,73 m 2 lehet, de egyes esetekben meghaladhatja az 1,0 mmol/1,73 m 2/24 óra értéket [2,72,73]. Egyéb rendelkezésre álló diagnosztikai tesztek közé tartozik a PCR alkalmazása a székletmintákban az oxalobacter formigének azonosítására [74,75]. Emellett a megnövekedett bél oxalát felszívódás (13 C2) oxalát felhasználásával végzett abszorpciós teszt segítségével is értékelhető [76]. Ez a teszt segíthet azonosítani a hiperabszorbereket, akiknek előnyösek lennének az étrendi beavatkozások, amelyek az oxalát csökkentésére és a kalcium növelésére koncentrálnak az étrendben. Ez a diagnosztikai teszt segít megkülönböztetni a hyperoxaluria elsődleges és másodlagos formáit [33].
A radiológiai képalkotás segíthet a multisystem érintettség diagnosztizálásában. A vesebetegség az urolithiasison kívül két különböző mintázatot mutathat: a medulláris nephrocalcinosis, amelyet ultrahanggal jól értékelnek, míg a CT-vizsgálat jobb módja a kortikális nephrocalcinosis diagnosztizálásának. A CT szintén hasznos lehet a kalcium-oxalát lerakódásának kimutatásában különböző más szervrendszerekben, például a bélfalban, az izmokban és az artériákban. A szívre gyakorolt hatások elektrokardiográfiával és echokardiográfiával értékelhetők. Bőrbiopsziára lehet szükség a kalcium-oxalát lerakódása után másodlagos bőrelváltozások esetén, amelyek hasonlíthatnak a kalcifilaxis elváltozásaira [62]. A kórszövettani vizsgálat során a kalcium-oxalát kristályok jellemző kettős törést mutatnak polarizált fény alatt vizsgálva. Ábrák A 2. és a 3. ábra a kalcium-oxalát lerakódását mutatja a veseszövetben.
Kalcium-oxalát lerakódás a vesetubulusokban (fekete nyilak).
- Elsődleges hiperoxaluria Esettanulmány és áttekintés az Literature Journal of Comprehensive
- Elsődleges hiperoxaluria típusok, kezelés és így tovább
- Peritoneális rák elsődleges, másodlagos, tünetek, stádiumok és egyebek
- Az akut hasnyálmirigy-gyulladás másodlagos vékonybélelzáródása
- Kis bélrák a jelek megértése; A daganatok tünetei a kis belekben -