Kapszulázott metionin γ-lyáz: Alkalmazás a Pseudomonas aeruginosa fertőzés enzimprodukciós terápiájában
Elena Morozova
† az Orosz Tudományos Akadémia Engelhardt Molekuláris Biológiai Intézete, Vavilov str. 32, Moszkva 119991, Oroszország
Vitalia Kulikova
† az Orosz Tudományos Akadémia Engelhardt Molekuláris Biológiai Intézete, Vavilov str. 32, Moszkva 119991, Oroszország
Vaszilij Koval
† az Orosz Tudományos Akadémia Engelhardt Molekuláris Biológiai Intézete, Vavilov str. 32, Moszkva 119991, Oroszország
Natalya Anufrieva
† az Orosz Tudományos Akadémia Engelhardt Molekuláris Biológiai Intézete, Vavilov str. 32, Moszkva 119991, Oroszország
Marina Csernukha
‡ Nemzeti Járványügyi és Mikrobiológiai Kutatóközpont, N. F. Gamaleya tiszteletbeli akadémikusról elnevezve, Oroszország Egészségügyi Minisztériuma, Gamalei st. 18, Moszkva 123098, Oroszország
Lusine Avetisyan
‡ Nemzeti Járványügyi és Mikrobiológiai Kutatóközpont, N. F. Gamaleya tiszteletbeli akadémikusról elnevezve, Oroszország Egészségügyi Minisztériuma, Gamalei st. 18, Moszkva 123098, Oroszország
Lada Lebedeva
† az Orosz Tudományos Akadémia Engelhardt Molekuláris Biológiai Intézete, Vavilov str. 32, Moszkva 119991, Oroszország
Medgaeva Olga
‡ Nemzeti Járványügyi és Mikrobiológiai Kutatóközpont, N. F. Gamaleya tiszteletbeli akadémikusról elnevezve, Oroszország Egészségügyi Minisztériuma, Gamalei st. 18, Moszkva 123098, Oroszország
Egor Burmistrov
‡ Nemzeti Járványügyi és Mikrobiológiai Kutatóközpont, N. F. Gamaleya tiszteletbeli akadémikusról elnevezve, Oroszország Egészségügyi Minisztériuma, Gamalei st. 18, Moszkva 123098, Oroszország
Igor Shaginyan
‡ Nemzeti Járványügyi és Mikrobiológiai Kutatóközpont, N. F. Gamaleya tiszteletbeli akadémikusról elnevezve, Oroszország Egészségügyi Minisztériuma, Gamalei st. 18, Moszkva 123098, Oroszország
Svetlana Revtovich
† az Orosz Tudományos Akadémia Engelhardt Molekuláris Biológiai Intézete, Vavilov str. 32, Moszkva 119991, Oroszország
Tatyana Demidkina
† az Orosz Tudományos Akadémia Engelhardt Molekuláris Biológiai Intézete, Vavilov str. 32, Moszkva 119991, Oroszország
Absztrakt
A Pseudomonas aeruginosa által okozott tüdőbetegség a fő oka a cisztás fibrózisos betegek halálának. A farmakológiai párok, a Citrobacter freundii metionin γ-liáz meztelen/kapszulázott mutáns formájának és a tioszulfinátokat előállító S-szubsztituált 1-cisztein szuboxidjainak terápiás hatékonyságát a multirezisztens okozta kísérleti szepszis egérmodelljén értékelték. rezisztens P. aeruginosa 203-2 törzs. A meztelen enzimet és szubsztrátumokat tartalmazó pároknak nem volt antibakteriális aktivitása. Az egereknek pár kapszulázott enzimmel és S-metil-1-cisztein-szulfoxiddal történő kezelése, amely dimetil-tioszulfinátot generál, a modell állatainak teljes felépüléséhez vezetett, az LD50 fertőzési dózissal egyenlő mennyiségben. A diallil-tioszulfinátot (allicint) generáló pár kevésbé hatékonynak bizonyult. Tehát a tioszulfinát-részhez kapcsolódó szubsztituensek befolyásolják a tioszulfinátok P. aeruginosa elleni antibakteriális aktivitását.
Bevezetés
A cisztás fibrózisban szenvedő emberek halálozásának fő oka a tüdőbetegség. A Pseudomonas aeruginosa, a Staphylococcus aureus és más kórokozók által okozott tartós bronchopulmonális fertőzések krónikus légúti és szisztémás gyulladáshoz, szöveti roncsolódáshoz és légzési elégtelenséghez vezetnek. 1 A kereskedelmi antibiotikumokkal szemben többszörösen rezisztens baktériumok gyakoriságának növelése komoly kihívást jelent az emberiség számára. Új fertőzésgátló szerek tanulmányozását igényli új hatásmechanizmusokkal.
Az allicin helyhez kötött előállítása konjugált monoklonális antitestek alliináz és alliin bináris rendszerével vezette be az alliináz/alliin rendszert az prodrug enzim terápiájában. Az alliináz/alliin rendszer antibakteriális és gombaellenes hatásait in vitro bizonyították. 19 Korábbi jelentéseinkben azt tapasztaltuk, hogy a piridoxal 5′-foszfátfüggő Citrobacter freundii metionin γ-liáz (MGL, EC 4.4.1.11) katalizálja a (±) S-alk (en) nonfiziológiai, nem sztereoszelektív β-eliminációs reakcióját il-1-cisztein-szulfoxidok allicin és más tioszulfinátok előállítására (1. reakcióvázlat). 20–22 Azonban az enzimet inaktiválták az alliin β-eliminációs reakciója során, mivel az allicin az MGL három SH-csoportját oxidálta. 21 A tioszulfinátok okozta MGL-gátlás elkerülése érdekében az MGL C115H mutáns formáját kaptuk. 22 A bináris rendszer („farmakológiai pár”) C115H MGL/S-alk (en) il-l-cisztein-szulfoxidok antimikrobiális hatását számos baktériummal, köztük cisztás fibrózisos betegekből izolált multirezisztens törzsekkel szemben in vitro bizonyították. 22,23 Ebben a jelentésben a csupasz/kapszulázott C115H MGL/szubsztrát bináris rendszerek hatékonyságát teszteltük a cisztás fibrózisos betegekből izolált P. aeruginosa 203-2 törzs okozta kísérleti szepszis egér modelljén.
Eredmények és vita
Meghatároztuk a P. aeruginosa 203-2 törzs rezisztenciáját a különféle csoportok antibiotikumaival (β-laktámok, makrolidok, aminoglikozidok, fluorokinolonok stb.). Megállapították, hogy a P. aeruginosa 203-2 törzs rezisztens az imipenem, azlocillin, cefotaxim, cefepime, ceftriaxon, gentamicin, tobramicin és levomycetin ellen (az adatokat nem mutatjuk be). Az eredmények lehetővé tették a törzs multirezisztensnek minősítését. A P. aeruginosa 203-2 törzs virulenciáját LD50 és LD100 értékek meghatározásával értékeltük. Az LD50 és az LD100 értéke 5x108 sejt/egér és 5x109 sejt/egér volt.
A proteolízis elkerülése érdekében a bináris rendszer enzimkomponensének magas immunogenitása és rövid ideig tartó biológiai aktivitása a C115H MGL-t PIC-gömbökbe kapszulázta PEG-poli (α, β-aszparaginsav) 70 és poli (l-lizin) 70 keverésével. az enzimmel, a korábban leírtak szerint. 24 Az enzimmel töltött PIC gömbök képződését DLS technikával igazoltuk. Kétféle részecske létezett - az uralkodó, körülbelül 52 ± 0,33 nm méretű és kis számú, körülbelül 500 nm méretű részecske. A polidiszperzitás index 0,329 volt. A zéta potenciál 3,45 ± 0,36 mV volt. A nanoreaktorok kapszulázott enzimekkel történő felhasználása az enzim prodrug terápiában nagyon vonzó, mert elkerüli az enzimek alkalmazásával kapcsolatos problémákat. Kevés olyan tanulmány ismerteti az in vivo gyógyszereket előállító polimer nanoreaktorok alkalmazását. 25,26 A triblock-kopolimer vezikulákba töltött Escherichia coli penicillin-aciláz in vitro alkalmazásának lehetőségét bizonyították a 7-amino-dezacetoxi-cefalosporánsav és a fenilglicin-metil-észter cefalexinné történő átalakítására. 27.
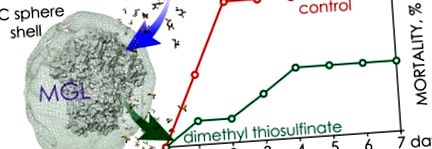
A P. aeruginosa 203-2 törzzsel fertőzött és meztelen/kapszulázott C115H MGL/S-alk (en) il-1-cisztein-szulfoxidokkal kezelt egerek túlélési görbéi. A kórokozó fertőző dózisa megegyezett az LD50-vel. □ szaggatott vonal - meztelen C115H/metiin (P> 0,99); ■ szaggatott vonal - C115H-val töltött PIC gömbök/metiin (P ≤ 0,05); ▲, folytonos vonal - C115H-val töltött PIC gömbök/alliin (P = 0,5); △, folytonos vonal - meztelen C115H/alliin (P> 0,5); ● —vezérlés. Hibasávok: SE.
Ezenkívül a C115H-val töltött PIC-gömbök/metiin farmakológiai pár hatékonyságát vizsgálták egérmodellen, a baktériumtörzs fertőző dózisával egyenlő volt LD100 (2. ábra: 2. ábra). Három különböző protokollt alkalmaztunk a farmakológiai párkomponensek beadására és három különböző protokollt a farmakológiai párkomponensek beadására. Az állatok túlélésében nem volt különbség, ha egyszeri vagy négyszeres metin-beadást alkalmaztak (P ≤ 0,0095 mindkét esetben). A túlélési arány 50% volt. A súlycsökkenés a csoportokban kevesebb mint 10% volt. Az enzimkomponens dózisának háromszoros csökkentése (25 U/ml) négyszeres metin-adagolással 67% -ig (P = 0,36) növekedett az állatok mortalitásában. A farmakológiai pár optimális beadási módja az intravénás különálló injekciók kapszulázott enzimmel és szulfoxiddal. A C115H-val töltött PIC gömbök és a metiin terápiás dózisa 75 E/kg és 100 mg/kg állat volt.
A P. aeruginosa 203-2 törzzsel fertőzött és különböző dózisú C115H-tal töltött PIC-gömbök/metiinnel kezelt egerek túlélési görbéi. A kórokozó fertőző dózisa megegyezett az LD100 értékkel. ▼, folytonos vonal - ugyanaz a farmakológiai párkomponensek beadásának két protokollja esetén C115H-val töltött PIC-gömbök [75 U/kg]/metiin × 4 és C115H-tartalmú PIC-gömbök [75 U/kg]/metiin × 1 (P ≤ 0,0095 mindkét esetben); ▽ ∇, folytonos vonal - C115H-val töltött PIC-gömbök [25 U/kg]/metiin × 4 (P = 0,36); ● —vezérlés. Hibasávok: SE.
Következtetések
Jelen tanulmány bebizonyította, hogy a C115H-val töltött PIC gömbök/metiin farmakológiai pár ígéretes a P. aeruginosa elleni új hatásmechanizmusú antibakteriális gyógyszerek kifejlesztése szempontjából. Az allicin E. coli sejteken kifejtett hatásának átfogó vizsgálata kimutatta, hogy a sejtnövekedés gátlásának fő okai a ciszteinmaradványok oxidációja számos fehérjében és enzimben, valamint a csökkent glutationszint csökkenése. Ugyanez a mechanizmus lehet felelős a többi tioszulfinát antibakteriális hatásáért. A legvalószínűbb, hogy ezek a vegyületek nem okoznak ellenállást. Az Alliums-ból származó egyéb S-szubsztituált l-cisztein-szulfoxidok vizsgálata és új szulfoxidok megtervezése ígéretes az antibakteriális gyógyszerek kifejlesztése szempontjából.
Anyagok és metódusok
Anyagok
A nikotinamid-adenin-dinukleotid (NADH), a nyúl izomából származó laktát-dehidrogenáz (LDH) és a (±) -L-alliin redukált formáját a Sigma-Aldrich cégtől vásároltuk; a piridoxal-5′-foszfát (PLP) és a d, l-ditiotreitol (DTT) a Serva-tól származik; a kanamicin hazai termék (OAO Biokhimik); A DEAE-sepharose Amersham-ből származott. 2-nitro-5-tiobenzoátot (NTB) állítottunk elő a (31) hivatkozás szerint. Az S-metil-1-cisztein-szulfoxidot (metiin) Morozova és mtsai. 22 PEG – poli (α, β-aszparaginsav) 70 (PEG – P (Asp) 70) és poli (l-lizin) 70 (PLL70) szintézisét Koide és mtsai. 32 Luria – Bertani húsleves (LB), Mueller – Hinton húsleves, Mueller – Hinton agar és antibiotikummal impregnált korongok: amikacin, amoxycillin/klavulánsav, ampicillin, azitromicin, aztreonam, cefepime, ceftazidime, cefepime, ceftriaxone, cephot ciprofloxacin, kolisztin, doxiciklin, eritromicin, gentamicin, imipenem, levofloxacin, linkomicin, norfloxacin, ofloxacin, oxacillin, rifampicin, spiramicin, tobramicin és vankomicin a HiMedia Laboratories Pvt. Limited (India).
A C115H MGL tisztítása
A C. freundii-ból származó MGL C115H mutáns formáját kaptuk és megtisztítottuk, Morozova és mtsai. Az endotoxin eliminálása érdekében az enzimet összekevertük az Endotoxin Extractorral (Sileks, Oroszország), és 30 percig inkubáltuk 0 ° C-on; ezután 15 percig inkubáltuk 50 ° C-on, és 5 percig centrifugáltuk 5000 fordulat/perc sebességgel. Összegyűjtöttük az átlátszó vizes fázist, amely endotoxinmentes enzimet tartalmaz. Az endotoxin szintjét a Limulus Amebocyte Lysate (LAL) kromogén endotoxin kvantitációs készletével mértük (Thermo Fisher Scientific, USA). A mintákban az endotoxin szint 0,07 EU/mg volt.
C115H-val töltött PIC gömbök előkészítése és jellemzése
A PEG-P (Asp) 70-et és a PLL70-et 50 mM kálium-foszfát pufferben (pH = 7,4) oldottuk 1 mg/ml koncentrációban, és 0,22 μm membránszűrőn átszűrtük a port. A két polimer oldatát egyenlő arányban –COO - és –NH3 + egységben keverjük össze örvénykeveréssel 2 percig. Az enzimet (6 mg/ml 10 mM kálium-foszfát pufferben, pH = 7,4) adtuk hozzá, és az elegyet 2 percig kevertük. A nem kapszulázott enzim eltávolítása céljából az elegyet 12 000 fordulat/perc sebességgel 5 percig centrifugáljuk, és a felülúszót négyszer cseréljük 10 mM kálium-foszfát pufferral. Az enzim hiányát a felülúszóban a jellegzetes holoenzim-sáv eltűnésével ellenőriztük 420 nm-en a felülúszó spektrumban. A C115H-val töltött PIC-gömbök átlagos részecskeméretét és zéta-potenciálját fázisanalízis fényszórással határoztuk meg ZetaPALS-szal 25 ° C-on (Brookhaven Instruments Corporation, USA).
Állatok és etikai jóváhagyás
Összesen 84, 14-16 g tömegű, tenyésztett hím egeret nyertünk az orosz Andreevka FSBI SCBT FMBA-tól. Az akklimatizáció érdekében az egereket szellőztetett ketrecekben helyezték el 12/12 világos-sötét ciklusban, és 14 napig szabadon hozzáférhettek az élelemhez és a vízhez a kísérletek megkezdése előtt. Valamennyi kísérletet a „Kísérleti állatok felhasználásával kapcsolatos munka szabályai” szerint hajtották végre (Függelék a Szovjetunió Egészségügyi Minisztériumának 1977. augusztus 12-i végzéséhez, 755. sz.).
A P. aeruginosa 203-2 törzs antibiotikum-rezisztenciájának meghatározása
A cisztás fibrózisos betegekből izolált P. aeruginosa 203-2 törzs a N. F. Gamaleya tiszteletbeli akadémikusról elnevezett Országos Epidemiológiai és Mikrobiológiai Kutatóközpont kórházi fertőzések molekuláris epidemiológiai laboratóriumának gyűjteményéből származik. A P. aeruginosa 203-2 rezisztenciáját a cisztás fibrózis kezelésére felírt standard antibiotikumokkal szemben soros hígítási módszerrel határoztuk meg, az egyes antibiotikumok MIC-küszöbértékeire vonatkozó klinikai ajánlásoknak megfelelően [A mikroorganizmusok antimikrobiális gyógyszerekkel szembeni érzékenységének meghatározása (változat) 2015-02). Módszertani útmutató 4.2.1890-04].
A kísérleti szepszis egérmodelljei
A P. aeruginosa 203-2 törzset alkalmaztuk kísérleti szepszis kiváltására állatokban. 5% -os véragaron tenyésztett tiszta 18–24 órás baktérium tenyészet egyetlen kolóniáját egy éjszakán át növesztettük LB-ben, 37 ° C-on. A baktériumokat 3000 fordulat/perc sebességgel 10 percig végzett centrifugálással gyűjtöttük össze, és az üledéket 0,9% -os NaCl-ban szuszpendáltuk. A bakteriális szuszpenzió koncentrációját a szuszpenzió és a 0,5 MF zavarossági standard vizuális összehasonlításával határoztuk meg. Az életképes sejtek tartalmának tisztázása érdekében a fertőző szuszpenziókban számos hígításból sűrű tápközegbe vetettük, majd 24 órán át inkubáltuk a telepeket.
A fertőzés szimulálására 5 állatcsoportot (egyenként hat egeret) alakítottunk ki, amelyekből négy különböző adagú P. aeruginosa 203-2-et adtunk be, amelyet az inokulumok kezdeti koncentrációjának (5 × 106, 5 × 10 7, 5 × 10 8, 5 × 109 9 KFU/egér). Az állatok kontroll csoportjának steril sóoldatot adtunk. A szepszist 0,5 ml törzs inokulátumának egyetlen intraperitoneális injekciójával modelleztük. A megfigyelés időtartama 7 nap volt, ezt követően a túlélő állatokat dietil-éter adagolásával, éterrel impregnált pamut felhasználásával eutanizálták. A virulencia értékeléseként meghatároztuk az LD50 és az LD100 értékeket.
Farmakológiai párok antibakteriális aktivitása a P. aeruginosa 203-2 által okozott kísérleti fertőzés modelljén
A két gyógyszerkombináció, a C115H-val töltött PIC-gömbök/alliin és a C115H-tartalmú PIC-gömbök/metiin antibakteriális aktivitását rágcsáló modellen vizsgálták, a bakteriális törzs fertőző dózisának egyszeri beadásával, LD50-rel egyenlő térfogatban. 0,5 ml. Ezenkívül a C115H-val töltött PIC gömbök/metiin farmakológiai pár hatékonyságát vizsgálták egér modellen, a baktérium törzs fertőző dózisával egyenlő volt LD100. Az intravénás injekció különböző protokolljait is vizsgálták erre a párra.
Azon modell esetében, ahol a P. aeruginosa 203-2 fertőző dózisa megegyezik az LD50 értékkel, az egereket 5 csoportba soroltuk (egyenként hat egér): C115H-val töltött PIC-gömbök/metiin és C115H-terhelt PIC-gömbök/alliin-csoportok külön injekcióval kapszulázott enzimet tartalmaz önmagában 75 U/kg dózisban 1 órával a fertőzés után, és négyszeres metin/alliin injekcióval 100 mg/kg dózisban a fertőzés után 1, 24, 48 és 72 órával; meztelen C115H/metin és meztelen C115H/alliin csoportok külön négyszeri injekciókkal, amelyek meztelen enzimet tartalmaznak 300 U/kg dózisban, és alliin/metin 100 mg/kg dózisban 1, 24, 48 és 72 órával azután a fertőzés; kontrollcsoport 0,2 ml puffer injekciójával a fertőzés után 1, 24, 48 és 72 órával.
A P. aeruginosa 203-2 LD100 fertőző dózisú modelljéhez az egereket 4 csoportba soroltuk (egyenként hat egér): C115H-val töltött PIC-gömbök/1. metin-csoport, egyedül a kapszulázott enzim injekcióival, 75 U/kg és metin egyszeri 100 mg/kg dózisban 1 órával a fertőzés után; C115H-tartalmú PIC-gömbök/2. metin-csoport külön injekcióval, amely magában foglalja a kapszulázott enzimet egyedül 75 U/kg dózisban 1 órával a fertőzés után, és négyszeres metin-injekciót 100 mg/kg dózisban 1, 24, 48 dózisban és 72 órával a fertőzés után; C115H-tartalmú PIC-gömbök/3. metin-csoport külön injekciókkal, amelyek önmagában a kapszulázott enzimet tartalmazzák, 25 U/kg dózisban 1 h a fertőzés után, és négyszeres metin-injekció 100 mg/kg dózisban 1, 24, 48, és 72 órával a fertőzés után; a kontrollcsoport 0,2 ml puffer injekciójával a fertőzés után 1, 24, 48 és 72 órával.
A meztelen/kapszulázott enzim és szulfoxidok készítményeit intravénásán 0,1 ml térfogatban 0,1 mM kálium-foszfát pufferben (pH 7,5) 0,1 mM PLP-vel injektáltuk. Ugyanezt a puffert használtuk kontrollként.
Naponta figyelték meg a testtömeget és a kényelmetlenséget, például a csökkent mozgásszervi aktivitást. Azokat az állatokat, akik 7 napos megfigyelés után maradtak életben, megsemmisítették.
- Zsír; Fogyás; Vörös fényterápia Amit tudnia kell Greenspan Wellness Center
- Az ademetionin Heptor klinikai hatékonysága az alkoholfüggő májbetegség kezelésében Olvassa el
- Clomid For Men a tesztoszteronpótló terápián (TRT) innovatív férfiak; s Egészségügyi Klinikák
- A kaparó terápia segíthet az edzésből való felépülésben
- Diétaterápia - áttekintés a ScienceDirect témákról