Liraglutid a súlykezeléshez: a bizonyítékok kritikus áttekintése
Belgyógyászati Klinika, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX, USA
Kutatási Orvosi Központ, Kansas City, MO, USA
Kardiológiai osztály, Texasi Egyetem Délnyugati Orvosi Központ, Dallas, TX, USA
Levelezési cím: Ian J. Neeland, MD, Texasi Egyetem Délnyugati Orvosi Központ 5323 Harry Hines Blvd, Dallas 75390-8830, TX, USA. E-mail: [email protected] További cikkek keresése a szerzőtől
Belgyógyászati Klinika, Texas Egyetem Délnyugati Orvosi Központ, Dallas, TX, USA
Kutatási Orvosi Központ, Kansas City, MO, USA
Kardiológiai osztály, Texasi Egyetem Délnyugati Orvosi Központ, Dallas, TX, USA
Levelezési cím: Ian J. Neeland, MD, Texasi Egyetem Délnyugati Orvosi Központ 5323 Harry Hines Blvd, Dallas 75390-8830, TX, USA. E-mail: [email protected] További cikkek keresése a szerzőtől
Összegzés
Célkitűzés
A liraglutid súlyosság-szabályozásának hatékonyságának, biztonságosságának és klinikai alkalmazhatóságának áttekintése a III. Fázisú klinikai vizsgálatokból.
Mód
Az angol nyelvű szakirodalomban keresést végeztek a PubMed keresési kifejezések használatával: „liraglutid”, „glukagon-szerű peptid-1 receptor agonista” és „randomizált klinikai vizsgálat”. Felülvizsgálták a témához kapcsolódó cikkeket és bibliográfiákat, és további, a szerzők által ismert referenciákat tartalmaztak.
Eredmények
Öt randomizált, placebo-kontrollos, liraglutidos vizsgálatot azonosítottak a testsúly szabályozására. Az ajánlott étrend és a fizikai aktivitás mellett a liraglutid következetesen 4–6 kg súlycsökkenést eredményezett, a betegek nagyobb hányada érte el a legalább 5 és 10% -os fogyást a placebóhoz képest. A leggyakoribb káros hatások a gyomor-bélrendszerre vonatkoztak, és elsősorban a kezelés elején jelentkeztek. Összehasonlító adatok arra utalnak, hogy a liraglutiddal történő súlycsökkenés nagyobb, mint az orlisztát vagy a lorcaserin esetében, de valamivel kevesebb, mint a fentermin/topiramát esetében. Az 1,8 mg liraglutid nemrégiben kimutatta, hogy kardiovaszkuláris előnyökkel jár egy nagy kimenetelű vizsgálatban; Jelenleg nem ismert ezeknek az eredményeknek a 3,0 mg-os készítmények alkalmazhatósága változatosabb, nagy kardiovaszkuláris kockázattal járó súlycsökkentő populációban. A valós klinikai alkalmazás első vonalbeli szerként történő alkalmazásának akadályai a gyomor-bélrendszeri mellékhatások, a magas költségek és az injekció szükségessége.
Következtetések
A liraglutid elősegíti és elhúzza a fogyást elhízott betegeknél. Hatékonysága összehasonlítható más elérhető szerekkel, de egyedülálló előnye a javított glikémiás kontroll. További vizsgálatokra van szükség annak hosszú távú hatékonysági és biztonsági profiljának meghatározásához.
Bevezetés
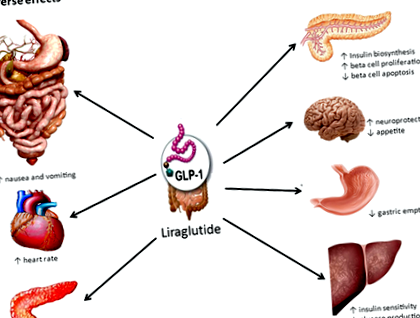
A liraglutid egy glükagonszerű peptid-1 (GLP-1) receptor agonista, Saxenda® és Victoza® néven forgalmazzák. A Victoza® egy 1,8 mg-os napi szubkután liraglutid injekció, amelyet az FDA eredetileg 2010-ben hagyott jóvá az étrend és a testmozgás kiegészítő terápiájaként a 2-es típusú cukorbetegség kezelésében 1. A klinikai vizsgálatok eredményei ismételten bizonyították a GLP ‐ 1 analógok képességét a súlycsökkenés kiváltására 2. Ennek eredményeként a liraglutidot súlycsökkentő szerként is kifejlesztették, és napi 3,0 mg-os adagja biztató eredményeket mutatott a III. Fázisú többszörös klinikai vizsgálatokban (lásd alább) 3-8. A Saxenda® (liraglutid 3,0 mg naponta szubkután injekció) az FDA által jóváhagyott legújabb gyógyszer krónikus testsúly-szabályozásra elhízott vagy túlsúlyos betegeknél, akiknek BMI-értéke ≥27 kg/m 2, és súlyával összefüggő társbetegség 9 .
A liraglutid hatékonysága és biztonságossága a III. Fázisú klinikai vizsgálatokban
Öt nagyszabású randomizált, multicentrikus III. Fázisú vizsgálatot végeztek a liraglutid 3-8 súlycsökkentő szer hatékonyságának értékelésére. Ezek közül négy része a jóllakottság és a klinikai adipozitás - Liraglutide bizonyítékok nem cukorbeteg és cukorbetegeknél (SCALE) program része. Az öt vizsgálat lényeges vizsgálati jellemzőit, beavatkozásait, valamint hatékonysági és biztonsági eredményeit az 1. táblázat tartalmazza.
Astrup és mtsai 3, 2009
Időtartam: 20 hét
1,2 mg liraglutid (N = 95)
1,8 mg liraglutid (N = 90)
2,4 mg liraglutid (N = 93)
3,0 mg liraglutid (N = 93)
Testtömeg: -4,4 kg (95% CI: -6,0 és -2,9 kg, 4. o. 2012
(Az eredmények cenzúrázása az 1. év után)
1,2 mg liraglutid (N = 95)
1,8 mg liraglutid (N = 90)
2,4 mg liraglutid (N = 93)
3,0 mg liraglutid (N = 93)
Testtömeg: -5,8 kg (95% CI: -8,0-3,3 kg, p ≤ 0,001)
≥5% testsúlycsökkenés: 73% vs. placebo 28% (p ≤ 0,001)
≥10% testsúlycsökkenés: 37% vs. placebo 10% (p ≤ 0,001)
Felső hasi fájdalom (5,4%)
Időtartam: 56 hét
3,0 mg liraglutid (N = 212)
Testtömeg: –5,9 kg (95% CI: ‐7,3–4,4 kg, 6. o
Időtartam: 56 hét
3,0 mg liraglutid (N = 2487)
Placebo (N = 1244)
Testtömeg: -5,6 kg (95% CI: -6,0 és -5,1 kg, 7. o
Időtartam: 56 hét
3,0 mg liraglutid (N = 423)
1,8 mg liraglutid (N = 211)
Testtömeg: -4,2 kg
Testtömeg: –4,0% (95% CI: ‐5,1–2,9%, 8. o
Időtartam: 32 hét
3,0 mg liraglutid (N = 180)
Testtömeg: -4,9 kg (95% CI: -6,2-3,3 kg, p
NN8022-1807 - Az első III. Fázisú klinikai vizsgálat
Az első nagy, III. Fázisú vizsgálatot a liraglutid tanulmányozására olyan betegeknél végezték, akiknek testtömeg-indexe (BMI) 30 kg/m 2 és 40 kg/m 2 között volt, nyolc európai országban3. A vizsgálat négy különböző dózisú liraglutid (1,2 mg, 1,8 mg, 2,4 mg és 3,0 mg, naponta egyszer szubkután injekció formájában) hatásait hasonlította össze placebóval (napi egyszeri szubkután injekció) és egy nyílt aktív összehasonlító anyaggal, az orlisztattal (120 mg). naponta háromszor szóban) 3. Azokat a személyeket, akik 1-es vagy 2-es típusú cukorbetegségben, súlyos orvosi problémákban, gyógyszerek okozta elhízásban szenvednek, más súlycsökkentő gyógyszeres terápiát alkalmazókat, az elmúlt 3 hónapban klinikai súlykontroll-vizsgálatba beiratkozott személyeket és a bariatrikus műtéteket részesítettek kizárva 3. A vizsgálat egy átvilágítási látogatásból, egy 2 hetes egyszeres vak placebo bejáratási periódusból, egy 4 hetes dózistitrálási periódusból, majd egy 16 hetes állandó dózis periódusból állt 3. Minden résztvevőnek életmódbeli beavatkozást írtak elő a kezelési időszak alatt (beleértve a 2 hetes befutási fázist), amely napi 500 kcal energiahiányos étrendet tartalmaz (a becsült 24 órás energiafelhasználás alapján), valamint tanácsot ad a fokozott fizikai aktivitásról lépésszámlálók segítségével. Az elsődleges végpont a testtömeg változása volt a kezelésre szánt szándékú (ITT) populáció körében a 20. hét végén 3 .
A becsült átlagos súlyvesztés az ITT populációban szignifikánsan nagyobb volt a liraglutid összes dózisával, mint a placebóval (4,8 kg, 5,5 kg, 6,3 kg és 7,2 kg liraglutid 1,2 mg, 1,8 mg, 2,8 mg és 3,0 mg). vs. 2,8 kg placebo esetén; p 3 A 2,4 mg és 3,0 mg liraglutidot kapó résztvevők lényegesen nagyobb súlyt vesztettek, mint az orlisztátot kapók (6,3 kg és 7,2 kg vs. 4,1 kg, p 4. A vizsgálatba bevont 564 beteg közül 398 ( A vizsgálókat és a résztvevőket 1 év múlva nem tudták kezelni, és a résztvevõket 2,4 mg liraglutidra, majd ezt követõen a 70 mg és a 96. hét között 3,0 mg-os dózisra váltották. - a forward (LOCF) imputáció, a placebóval korrigált átlagos súlycsökkenés a 3,0 mg liraglutid esetében 5,8 kg volt az első év végén. A prediabetes és a metabolikus szindróma prevalenciája szintén szignifikánsan csökkent a placebóval összehasonlítva a 3,0 mg liraglutiddal (p
A SCALE Program - SCALE karbantartási próba
A befutó 551 résztvevő közül 422 (77%) elveszítette a szűrés testtömegének több mint 5% -át, és randomizálták 3,0 mg liraglutiddal vagy placebóval. A liraglutid csoport testtömegének csökkenése szignifikánsan nagyobb volt, mint a placebóban (6,2% szemben 0,2%, p
MÉRLEG elhízás és prediabétesz vizsgálat
A SCALE Obesity and Prediabetes vizsgálat egy nagy, randomizált, kettős-vak, placebo-kontrollos vizsgálat volt, amelyet három éven keresztül végeztek (56 hetes kezdeti vizsgálati időszak, majd 2 éves meghosszabbítás kezdeti prediabéteszes betegeknél), amelynek célja a teszt az a hipotézis, miszerint a liraglutid jelentős súlycsökkenést érhet el az egész világon élő nagy és változatos betegpopulációban 6. Azokat a személyeket, akiknek BMI értéke ≥30 kg/m 2 vagy ≥27 kg/m 2, kezelt vagy kezeletlen diszlipidémiában vagy magas vérnyomásban szenvedtek, 2: 1 arányban randomizálták, hogy naponta egyszer 3,0 mg szubkután liraglutid injekciót vagy placebót kapjanak. Az adagolási rend hasonló volt a korábbi vizsgálatokhoz, és mindkét csoport tanácsot kapott az életmód módosításával kapcsolatban. Kizártuk azokat a betegeket, akik megfelelnek a SCALE fenntartási vizsgálat kizárási kritériumainak, és azokat, akiknek személyes vagy családi kórtörténetében multiplex endokrin neoplazia 2 (MEN 2) vagy családi medulláris pajzsmirigyrák (MTC) szerepel. Az 56. héten az elsődleges végpontok a testtömeg változása voltak a kiindulási értékhez viszonyítva, a résztvevők aránya legalább 5% testsúlyt vesztett, és a résztvevők aránya a véletlenszerű vizsgálatból legalább 10% -ot vesztett.
Az alábbiakban közölt adatok a vizsgálat kezdeti 56 hetes periódusának eredményeire vonatkoznak. A liraglutidra randomizált betegeknél az átlagos testtömeg szignifikánsan nagyobb mértékben csökkent (8,0%, szemben 2,6%, p 21. A 160. héten a 3,0 mg liraglutiddal kezelt betegek 1,8% -ánál 2-es típusú cukorbetegség alakult ki, szemben a placebo csoport 6,2% -ával. A 2-es típusú cukorbetegség kialakulásának kockázata 79% -kal csökkent a liraglutiddal (0,21-es kockázati arány, p 21. A vizsgálat eredményei megerősítették a liraglutid alkalmazhatóságát olyan súlycsökkentő szerként, amely javítja a különféle kardio-metabolikus paramétereket és késlelteti a típus megjelenését 2 cukorbetegség.
MÉRLEG Diabéteszpróba
A SCALE Diabetes vizsgálat egy randomizált, kettős-vak, placebo-kontrollos, párhuzamos csoportos vizsgálat volt, amelynek célja a liraglutid hatékonyságának értékelése 2-es típusú cukorbetegségben 7. 56 héten keresztül, 12 héten át tartó gyógyszerkövetési idővel 7 folytatták le. Azokat a személyeket, akiknek a BMI-értéke legalább 27 kg/m 2, és a 2-es típusú cukorbetegséget (HbA1c 7,0–10,0%) vizsgálták randomizálás céljából. Az alkalmasságra átvilágított 1361 résztvevő közül 846-ot randomizáltak 2: 1: 1 arányban a 3,0 mg liraglutidhoz, 1,8 mg liraglutidhoz és a placebo csoporthoz. Az adagolási rend a szokásos protokollt követte, és minden résztvevőt arra bíztattak, hogy kövesse az életmódbeli beavatkozásokat a vizsgálat ideje alatt. A kizárási kritériumok hasonlóak voltak a SCALE elhízás és prediabétesz vizsgálatához. A primer végpontok a testtömeg relatív változása és a randomizált testtömeg legalább 5% -át és 10% -át vesztett résztvevők aránya voltak.
A 3,0 mg liraglutid, 1,8 mg liraglutid és a placebo csoportban az átlagos testsúlycsökkenés 6,0% (6,4 kg), 4,7% (5,0 kg) és 2,0% (2,2 kg) volt az 56 hét végén. A súlycsökkenés mindkét liraglutid dózis mellett szignifikánsan nagyobb volt, mint a placebo (p 22, a 3,0 mg liraglutid csoportban gyakoribb volt, mint a placebo (44,5% vs. 27,4%). Az átlagos pulzusszám növekedés mindkét liraglutid dózisnál szignifikánsan magasabb volt, mint a placebo (o
MÉRLEG Alvási apnoe-vizsgálat
A SCALE alvási apnoe vizsgálat egy 32 hetes randomizált, kettős-vak, placebo-kontrollos vizsgálat volt, amelyet az Egyesült Államokban és Kanadában folytattak 8. Azokat a személyeket, akiknél polysomnogrammal diagnosztizáltak közepes vagy súlyos obstruktív alvási apnoét, akik nem voltak hajlandók vagy nem voltak képesek folyamatos pozitív légúti nyomás (CPAP) kezelést alkalmazni, és a BMI ≥ 30 kg/m 2 volt, 1: 1 arányban randomizálták, hogy naponta egyszer kapják meg. szubkután liraglutid 3,0 mg injekció vagy placebo. Az adagolás a szokásos protokoll szerint zajlott, és mindkét csoport tanácsot kapott az életmód módosításával kapcsolatban. A cukorbetegségben szenvedő személyeket kizárták. Alvási vizsgálatot végeztek a szűréskor, 12. héten, a vizsgálat végén pedig 32. héten. Az elsődleges végpont az apnoe-hypopnea index (AHI) változása volt. A másodlagos eredmények között szerepelt a testtömeg és a glikémiás kontroll változása. A 3,0 mg liraglutid csoportba randomizált betegeknél az átlagos testtömeg szignifikánsan nagyobb mértékben csökkent (5,7% versus 1,6%), nagyobb arányban voltak olyan betegek, akik legalább 5% -ot (46,3% versus 18,5%) és 10% -ot (23,4%) vesztettek a kezdeti testtömeg 1,7% -ával szemben a placebóhoz képest (p
Biztonsági eredmények
Liraglutid és kardiovaszkuláris eredmények - LEADER-vizsgálat
Az elmúlt évtizedben az amerikai FDA megbízta a gyógyszergyárakat, hogy bizonyítsák be, hogy a cukorbetegség kezelésére szolgáló új gyógyszerek nem növelik a kardiovaszkuláris események kockázatát. Az elsődleges végpont általában nem alacsonyabbrendűség-összehasonlítás a placebóval, gyakran előre meghatározott figyelmeztetéssel, amelyet a nem-alacsonyabbrendűség teljesítése esetén teljesítenének, ezt követően a felsőbbrendűség tesztjét kell elvégezni. Az FDA 2008-ban kiadott útmutatója 25 megköveteli a kétoldalas 95% -os konfidencia-intervallum előzetes jóváhagyásának felső határát olyan súlyos kardiovaszkuláris események esetén, amelyek kisebbek, mint 1,80, és a jóváhagyás utáni felső határértéket kevesebb, mint 1,30. Ebben az összefüggésben a 2-es típusú cukorbetegségben szenvedő betegek szokásos terápiájához hozzáadott liraglutid kardiovaszkuláris hatásait nemrégiben jelentették 26 .
Egy nagy, multicentrikus, kettős vak vizsgálatban 9340, 2-es típusú cukorbetegségben szenvedő és magas kardiovaszkuláris kockázattal rendelkező beteget randomizáltak napi 1,8 mg liraglutidot vagy placebót kapni, és 3,8 évig követték őket. Az elsődleges összetett eredmény a kardiovaszkuláris okokból bekövetkezett halál, a nem fatális szívizominfarktus vagy a nem halálos stroke volt. Az elsődleges eredmény lényegesen kevesebb betegnél fordult elő a liraglutid csoportban (13,0%), mint a placebo csoportban (14,9%), HR 0,87, 95% CI 0,78–0,97); o
A liraglutid összehasonlítása más súlycsökkentő szerekkel
Az American Heart Association/American College of Cardiology/The Obesity Society irányelvei többtényezős megközelítés alkalmazását javasolják az elhízás kezelésére 28. Ez magában foglalja az átfogó életmódbeli beavatkozási programok és a farmakoterápia megkezdését olyan betegeknél, akiknek BMI-értéke ≥ 30 kg/m 2 vagy ≥ 27 kg/m 2, és társbetegségek, például 2-es típusú cukorbetegség, magas vérnyomás, diszlipidémia vagy obstruktív alvási apnoe, ha az életmód módosítása önmagában nem hatékony 29. A liraglutid különösen hatékony választás lehet a 2-es típusú cukorbetegségben szenvedő elhízott betegek körében, és megfontolható azok számára, akiknek nagy a szív- és érrendszeri betegségének kockázata, és jóindulatú jelet adnak a szív- és érrendszeri kimenetelben, amelyet a cukorbetegségben szenvedő betegek 1,8 mg-os készítménye lát; azonban a 3,0 mg-os készítmény kardiovaszkuláris morbiditásra és mortalitásra gyakorolt hatását nem igazolták. Fontos megjegyezni, hogy a liraglutid és más súlycsökkentő szerek együttes alkalmazásának biztonságosságát és hatékonyságát nem vizsgálták, és nem ismert, hogy a hatások szinergikusak lehetnek-e, vagy ha a mellékhatások korlátoznák az egyidejű alkalmazást. A farmakológiai kombinációs terápiák további vizsgálata indokolt lehet.
Következtetés
Finanszírozás
Dr. Neeland-t az Országos Cukorbetegség és Emésztőrendszeri és Vesebetegségek Intézete/Országos Egészségügyi Intézet K23DK106520 támogatása és az UT Southwestern Dedman családi ösztöndíja támogatja a klinikai ellátásban.
Összeférhetetlenség
Dr. Mehta és Dr. Neeland nem nyilatkoznak összeférhetetlenségről. Dr. Marso kutatási támogatásokat és/vagy tanácsadási díjakat kapott az Amylin és a Novo Nordisk részéről.
- Joghurtot fogyaszt a testsúly-szabályozási eredményekhez kapcsolódóan Szisztematikus felülvizsgálat eredményei -
- Keto Quick Slim Medi fogyókúrás vélemények 2017 Shop - HazMat Management
- Henry Ford Wyandotte Súlykezelés Fogyás Henry Ford Egészségügyi Rendszer - Detroit, MI
- LEFAY INTENZÍV SÚLYKEZELÉS Lefay Resort; SPA Lago Di Garda (Olaszország) gyógyító ünnepek
- Gyógynövényes fogyókúrás tabletták Vital Max Keto zsírvesztési faktor áttekintés (2019) segíthet a fogyásban