Az aminosav-anyagcsere zavarai
Húsz aminosav, köztük kilenc, amelyek az emberben nem szintetizálhatók, és amelyeket táplálékkal kell előállítani, részt vesznek az anyagcserében. Az aminosavak a fehérjék építőkövei; némelyik a test fontos molekuláiként is szintetizálódik, vagy például szintetizálódik a szervezetben, például neurotranszmitterek, hormonok, pigmentek és oxigént szállító molekulák. Minden aminosavat tovább bontanak ammóniára, szén-dioxidra és vízre. Az aminosavak anyagcseréjét befolyásoló rendellenességek közé tartozik a fenilketonuria, a tirozinémia, a homocisztinuria, a nem ketotikus hiperglikinémia és a juharszirup vizeletbetegség. Ezek a rendellenességek autoszomális recesszívek, és mindegyik diagnosztizálható a testnedvek aminosav-koncentrációinak elemzésével. (A juharszirup vizeletbetegség szerves savak termelését is magában foglalja, és a Szerves savkómiák részben tárgyaljuk.)
A fenilketonúriát (PKU) a fenilalanin-hidroxiláz (PAH) - egy enzim - csökkentett aktivitása okozza, amely a fenilalanin aminosavat tirozinná alakítja, amely számos fontos hormon, valamint bőr-, haj- és szempigment prekurzora. A PAH aktivitás csökkenése a fenilalanin felhalmozódását, valamint a tirozin és más metabolitok mennyiségének csökkenését eredményezi. A vérben a fenilalanin tartósan magas szintje progresszív fejlődési késést, kicsi fejkerületet, viselkedési zavarokat és rohamokat eredményez. A melanin pigment csökkent mennyisége miatt a PKU-ban szenvedő személyek hajlamosabbak könnyebb tulajdonságokkal bírni, mint például a szőke haj és a kék szem, mint azok a családtagok, akik nem szenvednek ebben a betegségben. Speciális formulákkal, valamint alacsony fenilalanin- és fehérjetartalmú ételekkel történő kezelés csökkentheti a fenilalaninszintet a normális szintre, és fenntarthatja a normális intelligenciát. Azonban a PKU ritka esetei, amelyek a fenilalanin-hidroxiláz reakció elengedhetetlen kofaktora, a biopterin károsodott metabolizmusából származnak, nem biztos, hogy következetesen reagálnak a kezelésre.
A klasszikus (hepatorenalis vagy I. típusú) tirozinémiát a fumarilacetoacetát-hidroláz (FAH) hiánya okozza, amely a tirozin katabolizmusában az utolsó enzim. A klasszikus tirozinémia jellemzői közé tartozik a súlyos májbetegség, a nem kielégítő súlygyarapodás, a perifériás idegbetegség és a veseelégtelenség. A rendellenességben szenvedők megközelítőleg 40 százalékánál 5 éves korig májrák alakul ki, ha nem kezelik őket. 2- (2-nitro-4-trifluor-metil-benzoil) -1,3-ciklohexán-dionnal (NTBC) történő kezelés, amely a tirozin katabolikus útjának hatékony inhibitora, megakadályozza a toxikus metabolitok képződését. Bár ez a máj, a vese és a neurológiai tünetek javulásához vezet, a májrák előfordulását nem lehet megakadályozni. Májtranszplantációra lehet szükség súlyos májbetegség esetén, vagy ha rák alakul ki. A tirozinémia jóindulatú, átmeneti újszülöttkori formája, amely reagál a fehérje korlátozására és a C-vitamin terápiára.
A homocisztinuriát a cisztationin béta-szintáz (vagy β-szintáz) hibája okozza, amely enzim részt vesz a metionin metabolizmusában, ami homocisztein felhalmozódásához vezet. A tünetek közé tartozik az arcon kifejezett kipirulás, a magas, vékony keret, a lencse elmozdulása, érrendszeri megbetegedések és a csontok elvékonyodása (csontritkulás). Értelmi fogyatékosság és pszichiátriai rendellenességek is jelen lehetnek. A homocisztinuriában szenvedők körülbelül 50 százaléka reagál a B6-vitaminnal (piridoxinnal) történő kezelésre, és ezeknek az egyéneknek jobb az intellektuális prognózisa. A folsavval, betainnal (olyan gyógyszer, amely eltávolítja a szervezetből az extra homociszteint), az aszpirinnal, valamint a fehérje és a metionin étrendi korlátozásával történő kezelés is előnyös lehet.
A nem ketotikus hiperglikémiát görcsrohamok, alacsony izomtónus, csuklás, lélegzetvisszafogás és súlyos fejlődéskárosodás jellemzi. Ennek oka a glicin neurotranszmitter megemelkedett szintje a központi idegrendszerben, amelyet viszont a glicin aminosav hasításáért felelős enzimrendszer hibája okoz. A glicin hatását gátló gyógyszerek (pl. Dextrometorfán), az alacsony fehérjetartalmú étrend és a glicint eltávolító gyógyszerek (pl. Nátrium-benzoát) megkönnyíthetik a tüneteket, de erre a súlyos állapotra nincs gyógymód.
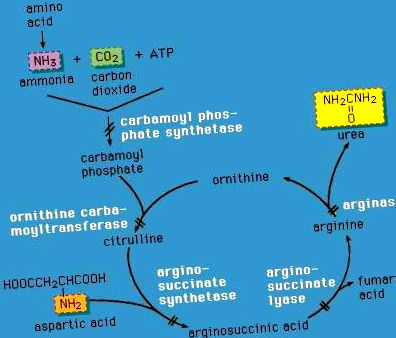
Karbamid ciklushibák
A májsejtek kritikus szerepet játszanak a nitrogénes hulladék ártalmatlanításában azáltal, hogy a karbamid (az elsődleges szilárd vizeletkomponens) karbamidot a karbamid cikluson keresztül képezik. Ha egy aminosav lebomlik, a molekula egyik végén lévő ammónia-nitrogén szétválik, beépül a karbamidba és kiválasztódik a vizelettel. A karbamidciklus bármelyik enzimjének hibája ammónia mérgező felhalmozódásához vezet a vérben. Ez viszont rossz táplálkozást, hányást, letargiát és esetleg kómát okoz az élet első két vagy három napjában (kivéve az arginázhiány esetét, amely később gyermekkorban jelentkezik).
A karbamidciklus hibái autoszomális recesszívek, vagyis csak akkor adódnak tovább az utódoknak, ha mindkét szülő viseli a hibát. Az egyik kivétel az ornitin-transzkarbamiláz (OTC) hiánya, amely X-hez kapcsolódik (és ezért súlyos betegségeket okoz a mutáns X-kromoszómát öröklő férfiaknál). Az OTC hiány azonban a „heterozigótákat megnyilvánuló” nőstényeket is érintheti (lásd: Öröklés), súlyos betegségekkel járó betegség csecsemőkorban vagy később az anyagcsere-stressz idején - például vírusos megbetegedések vagy szülés idején. A karbamidciklus-rendellenességek sürgősségi kezelése magában foglalja az intravénás ammónia-eltávolító gyógyszereket és a hemodialízist a vér ammóniaszintjének csökkentése érdekében. A hosszú távú terápia alacsony fehérjetartalmú étrendből, az e rendellenességekben hiányos tápanyagok biztosításából, valamint fenil-butirátból vagy benzoátból (olyan gyógyszerekből áll, amelyek megszabadítják a testet a felesleges ammóniától). A karbamidciklus-rendellenességekben szenvedő személyek fennállnak az ismétlődő krízisek kockázatának megemelkedett ammóniaszint mellett, különösen a fertőzés idején; a magas ammóniaszint kezeletlen vagy ismételt epizódjai értelmi fogyatékosságot és fejlődéskárosodást okozhatnak. A májtranszplantáció gyógyíthatja ezeket a rendellenességeket.
Aminosav transzport rendellenességek
Energiára van szükség ahhoz, hogy sok aminosav a bélrendszerből a vérbe kerüljön, vagy a vese speciális sejtjeivel visszanyerje őket a vizeletből. Az aminosavak ezen transzportja nem vesz részt enzimekben a metabolikus útvonalakban, hanem a sejtekbe vagy intracelluláris organelle membránokba ágyazott fehérjéket szállítja. A csökkent transzportaktivitású mutáns fehérjék megakadályozhatják az étrendi aminosavak felszívódását vagy a vizeletben való veszteségüket okozhatják. Például cystinuriában fokozódik a cisztin, ornitin, arginin és lizin kiválasztása a vizelettel, ami veseköveket eredményez. A cisztinosist a cisztin hibás kijutása jellemzi a lizoszómának nevezett sejtes organellumokból a transzporter cisztinosin hibája miatt; ebben a rendellenességben szenvedőknél szaruhártya-lerakódások és vesebetegségek alakulnak ki, és vesetranszplantációra lehet szükség. A lizin, az arginin és az ornitin hibás membrántranszportja a belekben lizinur fehérje intoleranciát (LPI) okoz, amely rendellenességet fehérje-intolerancia, hasmenés, nem kielégítő súlygyarapodás, csontritkulás és kiütések jellemzik; az LPI késői szövődményei közé tartozik a vese- és tüdőbetegség. A Hartnup-betegség az aminosavak transzportjának rendellenessége a belekben és a vesékben; ataxia, fényérzékeny kiütés és mentális rendellenességek a fő tünetek.
Szerves acidémiák
A szerves savak szénalapú vegyületek, amelyek abnormálisan magas szinten jelennek meg, ha a specifikus enzimeket érintő metabolikus utak blokkolódnak. A szerves acidémia olyan állapot, amelyet a szerves savak felhalmozódása jellemez a test szöveteiben és folyadékaiban, különösen a vizeletben. A leggyakoribb ilyen rendellenesség az autoszomális recesszív állapot, amely magában foglalja az elágazó láncú aminosavak, a leucin, az izoleucin és a valin metabolizmusát. A szerves acidémiák számos jellemzővel rendelkeznek, többek között a vér savtartalmának növekedése (acidémia), alacsony vércukorszint (hipoglikémia), alacsony fehérvérsejtszám (neutropenia), gyenge növekedés és különböző mértékű mentális károsodás. Ezek a rendellenességek csecsemőkorban vagy később gyermekkorban jelentkezhetnek.
A propionsavas acidémiát a propionil-CoA karboxiláz enzim hiánya okozza, amely propionsav felhalmozódását eredményezi. Az ebben a rendellenességben szenvedő személyek már csecsemőkorban korán életveszélyes betegségben jelentkeznek. Acidémia, dehidráció, alacsony fehérvérsejtszám, alacsony izomtónus és kómába torkolló letargia tipikus jellemzők. Az ammónia szintje a vérben szintén magas lehet, mivel a kóros metabolitok gátolják a karbamid ciklus megfelelő működését. A propionsavas acidémia fő terápiái az elágazó láncú aminosavak étrendi korlátozása, karnitinpótlás és az anyagcsere-krízisek intenzív kezelése intravénás folyadékokkal, glükózzal és bikarbonáttal.
Azoknál a személyeknél, akiknél a metilmalon-acidémia (MMA) klasszikus formája a metilmalonil-CoA mutáz enzim hibája által okozott, hasonló tünetek jelentkeznek, mint a propionsavas acidémiában szenvedőknél, de a veseelégtelenség hosszú távú szövődményei is kialakulhatnak. A kombinált máj-vese transzplantáció előnyös lehet néhány súlyos vesebetegségben szenvedő betegnél. A klasszikus MMA egyik formája reagál a B12-vitaminnal történő kezelésre. A ritkább formákat a B12-vitamin feldolgozásának hibái okozzák, és gyakran gyermekkorban, progresszív neurológiai károsodással jelentkeznek.
A juharszirup vizeletbetegség (MSUD) az elágazó láncú aminosav-anyagcsere rendellenessége, amely leucin, izoleucin, valin és ezeknek megfelelő oxosavak felhalmozódásához vezet a testfolyadékokban - ennek egyik eredménye a juharszirup jellegzetes szaga egyes betegek vizeletében . A rendellenesség a pennsylvani menonitokban gyakori. Az MSUD klasszikus formája csecsemőkorban letargiával és progresszív neurológiai romlással jár, amelyet rohamok és kóma jellemez. A legtöbb szerves acidémiával ellentétben a kiemelkedő acidemia ritka. A kezelés magában foglalja a fehérjék korlátozását és az elágazó láncú aminosavakban hiányos tápszerekkel történő táplálást. Az MSUD-ban szenvedőknek értelmi fogyatékosságuk lehet a terápia ellenére, de a korai és gondos kezelés normális értelmi fejlődést eredményezhet. Az MSUD enyhébb formáit egyszerű fehérjeszűkítéssel vagy tiamin (B1-vitamin) beadásával lehet kezelni.
- Anyagcsere betegség - A lipid anyagcsere zavarai Britannica
- A lipid anyagcsere áttekintése - endokrin és anyagcsere rendellenességek - Merck Manuals Professional
- Az SMA szülője, Bodzo Mária az aminosav-diéta mellett szól, hogy a betegség stabil maradjon
- Metabolikus szindróma és a kapcsolódó rendellenességek Mary Ann Liebert, Inc., kiadók
- Anyagcsere teszt, fogyás, anyagcsere, diéta