Nagy hatékonyságú optogenetikus némítás szómával megcélzott aniont vezető csatornarodopszinekkel
Tárgyak
Absztrakt
Az optogenetikus némítás lehetővé teszi a meghatározott idegsejt populációk időben megoldott funkcionális lekérdezését. A gátló optogenetikai eszközök korlátai azonban szigorú korlátozásokat szabnak a kísérleti paradigmákra. A fényvezérelt ionszivattyúk nagy fényigénye és azok intracelluláris ion homeosztázisra gyakorolt hatása egyedülálló kihívásokat jelentenek, különösen olyan kísérletek során, amelyek in vivo széles körű idegsejt-populáció gátlását igénylik. Guillardia theta az aniont vezető csatornarodopszinek (GtACR) ígéretesek ebben a tekintetben, magas egycsatornás vezetőképességük és kedvező fotonion-sztöchiometriájuk miatt. Azonban a GtACR-ek gyenge membránmegcélzást mutatnak az emlős sejtekben, és az ilyen csatornák aktivitása átmeneti gerjesztést okozhat az axonban az ebben a rekeszben lévő gerjesztő klorid megfordítási potenciál miatt. Itt ezeket a problémákat úgy kezeljük, hogy fokozzuk a membrán célzását és a GtACR-ek szubcelluláris kompartmentalizációját. Az eredményül kapott soma-célzott GtACR-ek javított fényáramot, csökkent axon gerjesztést és nagy fényérzékenységet mutatnak, lehetővé téve az emlős agyban a neuronaktivitás rendkívül hatékony gátlását.
Bevezetés
Eredmények
A GtACR2 felülmúlja az eACR értékeket, de antromikus tüskéket indukál
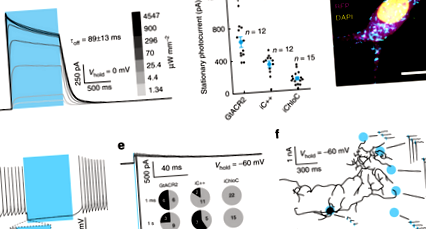
A nACR-ek és az eACR-ek neuronok elnémításához való hasznosságának összehasonlításához először három korábban leírt kék fény által aktivált ACR-t, a GtACR2 16, iC ++ 17 és az iChloC 15-et fejeztünk ki tenyésztett patkány hippokampusos neuronokban adeno-asszociált vírus (AAV) segítségével - közvetített géntranszfer. A GtACR2-expresszáló idegsejtekből származó teljes sejt-patch-clamp felvételek megbízható kifelé irányuló áramokat mutattak (1a. Ábra) a 470 nm-es teljes mező fényimpulzusokra adott válaszként. A –35 mV-ra szorított GtACR2-expresszáló idegsejtek 1 másodperc folyamatos megvilágítása (állófényes áram) után a fényáram lényegesen nagyobb volt, mint a tervezett ACR-ek (eACR-ek) iC ++ és iChloC (628,5 ± 61,8 pA, 330,2 ± 37,9 pA és 136,3) ± 21,4 pA; 1b. Ábra). Tekintettel a gyenge membráncélzásra és a GtACR2 intracelluláris felhalmozódására (1c. Ábra), a GtACR2 16 magas egycsatornás vezetőképessége valószínűleg az oka az egész sejt felvételeken megfigyelt magas fotovezetéseknek.
A KCC2 csökkenti a GtACR2 által közvetített antidromikus tüskéket
A GtACR2 soma-célzása csökkenti az axonális gerjesztést
A javított membráncélzás önmagában erőteljesen megnövelte az antidromikus tüskeképződés valószínűségét (eGtACR2; 4a. Ábra), míg a szóma-célzás nemcsak megnövelte a fényáramokat (3g. Ábra), hanem csökkentette az antromikus tüskék kiváltásának valószínűségét a tenyésztett hippokampusos neuronokban (4a. Ábra) . Az stGtACR2 destabilizálása a PEST szekvencia alkalmazásával az antidromikus tüske képződésének kevésbé kifejezett csökkenéséhez vezetett az stGtACR2-hez képest (4a. Ábra). Annak igazolására, hogy az antromikus tüske képződésének csökkent valószínűsége nem a tenyésztett idegsejtek különböző konstrukcióinak csúcsfényes áramában mutatkozó különbségek miatt következik be, számszerűsítettük az ugyanazon idegsejtekben található fotovezetéseket (4b. Ábra). Ellentétben az akut agyszelet-kísérletek stacionárius fotovezetéseivel (3g. Ábra), a tenyésztett idegsejtekben a fotovezetési csúcsok nem különböztek szignifikánsan a konstrukciók között, jelezve a tenyésztett neuronok alacsonyabb membrán-célzási hatékonyságát vagy a rövidebb vírusinkubációs idő hatását. Mindazonáltal ebből az következik, hogy az stGtACR2 esetében az antidromikus tüske drámai csökkenése nem az alacsonyabb áramáramok miatt következik be.
A szóma-célzás fokozza a GtACR2 által közvetített némítást in vivo
A GtACR2 szómára történő célzása csökkenti az antidromikus tüskéket in vivo
A GtACR által közvetített csendesítés térbeli kiterjedése
Az stGtACR2 alkalmazásával végzett BLA-gátlás rontja a félelem kihalását
Vita
Annak megállapítására, hogy az axonban megemelkedett klorid-koncentráció valóban vezethet-e GtACR2-közvetített axonális gerjesztéshez, együtt expresszáltuk a KCC2 transzportert a GtACR2-vel tenyésztett idegsejtekben. Az érett idegsejtekben expresszálódó endogén KCC2 transzporter, amelyről tudható, hogy felelős a klorid extrudálásáért az 51 szomatodendrit rekeszből, hiányzik a 27,28,29 axonból, ami magasabb klorid koncentrációt tesz lehetővé ebben a rekeszben. Megállapításunk, miszerint a KCC2 túlexpressziója a fény által kiváltott antromikus spikerek jelentős csökkenését eredményezte, azt jelzi, hogy az ACR által közvetített antromikus spiking valóban a kisebb klorid gradiens eredménye lehet az axonban, még felnőtt neuronokban is. Noha ez az antromikus spiking fenotípus valószínűleg nem zavarja a hosszú távú gátlási kísérleteket (másodpercenként és felfelé), zavaró tényező lehet, ha milliszekundumos skála gátlásra van szükség. A jövőbeni munkák kombinálhatják a GtACR2 aktiválást a vörös elmozdulású klorid indikátorokkal, hogy közvetlenül megvizsgálják a kloridszint változását az axon rekeszben az ACR által közvetített klorid vezetőképesség alatt.
A neuronális elnémítás pontos paraméterei a kísérleti paradigmától függenek, ideértve a megcélzott idegsejt típusát, az expresszió szintjét és a fénykibocsátás módját. Ideális esetben a fényszállítási protokollokat elektrofiziológiai ellenőrzéssel kell meghatározni. Ahol az átmeneti fénybemutatás által kiváltott antidromikus tüskék nem elfogadhatók, a felhasznált fényteljesítményt minimalizálni kell. Ez azonban a címezhető agy térfogatának korlátozásához vezet, amikor a fényt klasszikus optikai szálas megközelítéssel szállítják. A maximális helyi fényerő-sűrűséget csökkentő új fényszállítási módszerek segíthetnek ennek a korlátnak a leküzdésében (kúpos szál 62). A visszahúzódó gerjesztés, amely potenciálisan a hosszan tartó gátlást követő szinaptikus depresszió felszabadulásának köszönhető, potenciális figyelmeztetés bármely optogenetikus csendesítési kísérletre, és ezt figyelembe kell venni a kísérleti tervezés és az adatok értelmezése során.
Összefoglalva, megmutattuk, hogy a természetesen előforduló aniont vezető GtACR2 membrán célzása és szomatodendritikus korlátozása ennek a csatornarodopszinnak két fontos korlátját kezeli, jelentősen javítva a fotovezetéseket és minimalizálva a disztális axonokban az antromikus hatáspotenciálokat. Az optimalizált stGtACR variánsokkal nagy hatékonyságú optogenetikus némítást tudtunk elérni, és bizonyítottuk azok hatékonyságát az egér agy neuronális aktivitásának időbeli pontos in vivo elhallgattatásához.
Mód
Rekombináns AAV vektorok előállítása
A vizsgálat során a következő vírusvektort használták:
AAV2/1 & 2.hSyn1.GtACR2-eGFP.WPRE, AAV2/1 & 2.CamKIIα.GtACR2-ts-Fred-Kv2.1.WPRE, AAV2/1 & 2.CamKIIα.GtACR2-ts-Fred-ER.WPRE, AAV2/1 & 2. CamKIIα.GtACR2-ts-Fred-Kv2.1-PEST.WPRE, AAV2/1 & 2. CamKIIα.TagRFP-T.WPRE, AAV2/1 & 2.CamKIIα.eYFP.WPRE, AAV2/1 & 2.CamKIIα.iC ++ - eYFP.WPRE, AAV2/1 és 2.hSyn.iChlOC-eGFP.WPRE.
Elsődleges hippocampalis neuron kultúra
Az elsődleges tenyésztett hippocampus neuronokat hím és nőstény P0 Sprague-Dawley patkány kölykökből (Envigo) készítettük. A CA1-et és a CA3-t izoláltuk, 0,4 mg ml -1 papainnal (Worthington) emésztettük, és 1: 30 Matrigellel (Corning) előzetesen bevont üveglapokra helyeztük. A tenyésztett idegsejteket 5% CO2-os nedvesített inkubátorban tartottuk, Neurobasal-A táptalajjal (Invitrogen), amely 1,25% szarvasmarha-magzati szérumot (FBS, Biological Industries), 4% B-27 szarvasmarha-kiegészítést (Gibco), 2 mM Glutamax-ot (Gibco) tartalmazott, és bevontuk. fedőlemezeken egy 24 üreges lemezen, lyukanként 65 000 sejt sűrűséggel. A glia túlnövekedésének gátlásához 200 µM fluorodeoxiuridint (FUDR, Sigma) adtunk 4 napos in vitro tenyésztés után (DIV).
Tenyésztett idegsejtek kalcium-foszfát transzfekciója
A neuronokat a 64-es kalcium-foszfát módszerrel transzfektáltuk. Röviden: a 24 üregű lemezen tenyésztett primer hippokampusos neuronok táptalaját összegyűjtöttük és 400 µl szérummentes MEM táptalajjal helyettesítettük (ThermoFisher tudományos). Harminc mikroliteres transzfekciós keveréket (2 ug plazmid DNS-t és 250 uM CaCl2-ot HBS-ben, pH 7,05 mellett) adtunk lyukanként. 1 órás inkubálás után a sejteket kétszer mossuk MEM-mel, és a táptalajt visszaváltjuk az összegyűjtött eredeti táptalajra. A tenyésztett idegsejteket 14–17 DIV között használtuk a kísérletekhez.
A következő plazmidokat használtuk ebben a vizsgálatban:
pAAV_hSyn1_GtACR2-eGFP_WPRE (Peter Hegemann ajándéka alapján, Addgene # 85463 plazmid), pAAV_CamKIIα_mNeonGreen_WPRE, pAAV_CamKIIα (0,4 kb) _mScarlet_WPRE, és pCITF_T40.
Állatok
Az összes kísérleti eljárást a Weizmann Tudományos Intézet intézményi állatgondozási és felhasználási bizottsága hagyta jóvá. A hathetes C57BL/6 egereket (P35–45) az Envigótól szereztük be. Legfeljebb 5 hím vagy nőstény C57BL/6 egeret helyeztek el egy ketrecben világos-sötét (12 h – 12 h) ciklusban, étellel és vízzel ad libitum. A kísérlettől függően az egereket a műtét után 3–12 hétig tartottuk a helyreállítás és a vírus expressziója érdekében.
Vírus vektorok sztereotaktikus injekciója
A hathetes C57BL/6 egereket (P35–45) kezdetben ketaminnal (80 mg kg -1) és xilazinnal (10 mg kg -1) indukálták, és sztereotaxiás keretbe helyezték (David Kopf Instruments), az izoflurán altatás előtt. (
1% O2-ben, v/v). Az injekció beadásának helyén craniotomiát (~ 1 mm átmérőjű) hajtottak végre. A vírusszuszpenziókat lassan (100 nl min – 1) injektálták egy 34 g-os ferde tűvel (Nanofil fecskendő, World Precision Instruments). Az injekció beadása után a tűt további 5 percig a helyén hagyták, majd lassan kihúzták. A műtéti eljárást vagy optikai szál, vagy optrode meghajtó implantációkkal folytattuk (az alábbiakban ismertetjük), vagy a műtéti bemetszést szövetragasztóval lezártuk, és 0,05 mg kg -1 buprenorfint injektáltunk szubkután műtét utáni fájdalomcsillapítás céljából. A mediális prefrontális kéregre (mPFC) irányuló injekciókat 1,8 mm-rel elülső, 0,3 mm-es oldalsó és 2,53 mm-es ventrális bregma felé tettük. A bazolaterális amygdala (BLA) injektálásának koordinátái 1,15 mm-es hátsó, 3,0 mm-es oldalirányúak és 5,0 mm-esek voltak a ventrális és a bregma között. MPFC injekciókhoz 1 µl jelzett vírust injektáltunk. A félelemkihalási kísérletek miatt az egereket kétoldalúan 500 nl AAV2/1 és 2. injekcióval injektáltuk. CamKIIα.stGtACR2-Fred.WPRE vagy AAV2/1 & 2.CamKIIα.eYFP.WPRE genomiális titere 2-3 x 10 11 vp ml −1 volt. .
Optikai szál és optróda meghajtó beültetés
A száloptikás beültetéshez craniotomiát (∼ 1 mm átmérőjű) készítettek az implantációs hely fölött, és egy ferrulával végződött optikai szálat (ThorLabs) helyeztek el a kívánt koordinátákra egy sztereotaxiás kerettel (David Kopf Instruments). A bilaterális BLA célzáshoz a szálhegyet 1,15 mm-es hátsó, 3,0 mm-es oldalirányú és 4,8 mm-es ventrális helyzetben helyezzük el a bregma felé. A nucleus accumbens esetében a szálat 45 ° -os szögben ültették be úgy, hogy a hüvely hátrafelé nézzen, hogy lehetővé tegye az optrode meghajtó elhelyezését az mPFC felett ugyanazon állatoknál. A szálcsúcs célja az volt, hogy 1,42 mm elülső, 1 mm oldalirányú és 5 mm ventrális véget érjen a bregma felé. Az optikai szálat a koponyához rögzítettük Metabond (Parkell) és fogászati akril alkalmazásával. A kontroll egereket nem injektálták AAV-kba, hanem egy optrode meghajtóval ültették be őket az mPFC-be, és egyetlen optikai szálat ültettek a nucleus accumbens-be. A félelem kipusztulásától képzett egereknél további fogászati akrilt alkalmaztak egy második alkalommal izoflurán altatásban (
1% O2-ben, v/v) a félelem tanulása után (2. nap). Az optrode meghajtó beültetéséhez a mozgatható meghajtót a kezdeti rögzítési helyzetbe süllyesztették a PL felett (AP: 1,8 mm, ML: 0,3 mm, DV: –2,3 mm). Mielőtt az optródát véglegesen rögzítették a koponyához, az optródavezetőt Kwik-Kast szilikon elasztomerrel (World Precision Instruments) védték és fogakrillal rögzítették. Az egereket a kísérletek előtt legalább 6 hétig hagyták helyreállni. Az implantált optikai szálak és az optródok helyét szövettanilag minden kísérleti egér esetében validáltuk.
Akut agyszelet előkészítés
Az egereknek intraperitoneálisan injektáltuk pentobarbitált (130 mg kg -1, ip), és karbogenált (95% O2, 5% CO2) jéghideg szeletelő oldattal ([mM] 2,5 KCl, 11 glükóz, 234 szacharóz, 26 NaHCO3, 1,25) perfúzióval adtuk be. NaH2PO4, 10 MgSO4, 2 CaCl2; 340 mOsm). Lefejezés után 300 µm koronális mPFC szeleteket készítettünk karbogénezett jéghideg szeletelő oldatban vibratóm (Leica VT 1200 s) felhasználásával, és 20 percig 33 ° C-on hagytuk helyreállni karbogénezett magas ozmolaritású mesterséges cerebrospinalis folyadékban (magas-Osm ACSF [mM] 3,2 KCl, 11,8 glükóz, 132 NaCl, 27,9 NaHCO3, 1,34 NaH2PO4, 1,07 MgCl2, 2,14 CaCl2; 320 mOsm), majd 40 percig inkubáljuk 33 ° C-on karbogénezett ACSF-ben ([mM] 3 KCl, 11 glükóz, 123 NaCl, 26 NaHC03, 1,25 NaH2P04, 1 MgCl2, 2 CaCl2; 300 mOsm). Ezt követően a szeleteket szobahőmérsékleten (RT) tartottuk karbogénezett ACSF-ben felhasználásig. A rögzítő kamrát 2 ml/perc sebességgel karbogenált ACSF-fel perfúzióval 32 ° C-on tartottuk.
Elektrofiziológiai módszerek in vitro felvételekhez
In vivo elektrofiziológia
In vivo optogenetikus némítás a kihalási edzés során
Optogenetikus némítás újszerű környezetkutatás során
A „nem fény” állapot kivételével minden körülmények között az egereket 18 órán át tápláléktól nélkülöztük, majd csatlakoztattuk az optikai patch akkordhoz, és 75 percig dúsított környezetbe helyeztük. A fényt (6 mW a szál csúcsán) folyamatosan szállítottuk ez idő alatt az mPFC-hez. A környezet egy kör alakú arénából (50 cm átmérőjű) állt, amely szétszórt étkezési pelleteket tartalmazott, és gyengén világított (38–44 lux) a stressz minimalizálása érdekében. Ezután az egereket eltávolítottuk az új színtérről, és további 15 perc múlva felöltük. A fény nélküli csoportba tartozó egerekbe nem ültettek be optikai szálakat.
Immunfluoreszcencia és mikroszkópia
In vitro megvilágítás és gyógyszeres alkalmazás
A teljes mező megvilágítását in vitro 470 nm fénykibocsátó dióda (29 nm sávszélességű LED; M470L2-C2; Thorlabs) segítségével végeztük, a mikroszkóp megvilágítási útján keresztül, egy egyedi dikroikusan, a 470 nm aktiválási hullámhossz tükrözése érdekében. A fényteljesítmény-sűrűségeket úgy számoltuk ki, hogy egy teljesítménymérővel (Thorlabs PM100A S146C érzékelővel) megmértük az objektíven átáramló fényt, és elosztottuk a megvilágítási területtel, számítva a mikroszkóp objektív mezőjének számából és a nagyításból 66. A D-AP5-t (25 µM; ab120003; Abcam) és a CNQX-t (10 µM; C-141, Alomone) minden fürdési kísérlet során fürdőbe helyeztük. A neuronális szóma vagy neuritok térben korlátozott megvilágításához 473 nm-es diódalézert (Bruker) galvanometrikus tükrökkel irányítottak a képsíkra, és így diffrakcióval korlátozott fényfoltot kaptak, amely rövid fényimpulzusokat (1 ms) adott minden helyszínen, 500 ms közötti impulzus intervallumok a nem szomszédos helyek között.
Adatelemzés és statisztikai módszerek
Az adatok elérhetősége
Az ebben a tanulmányban bemutatott adatok és egyedi írásos elemzési kódok kérésre a megfelelő szerzőktől állnak rendelkezésre. A DNS-szekvenciákat az Addgene-n rakják le (ID 105669 és 105679).
- Gyógynövényes fogyás formula zöld teával és gyógynövényekkel; Kerstin; s Természeti termékek embereknek és háziállatoknak
- Huminsav - A természet legjobb titka!
- Japán vizes étrend - egy a természettel
- A hízósejtfüggő természetes immunitás károsodása a komplement C3-hiányos egerekben Természet
- Lida fogyás - bizalom a természetben