Probiotikumok a húgykövek megelőzésére
Háttér: A vizelet túltelítettsége a kalcium-oxalát (CaOx) vizeletkő-képződésének egyik meghatározó tényezője, az oxalát és a citrát vizelettel történő kiválasztása két kulcsfontosságú tényező. Mindegyiket befolyásolják a gyomor-bélrendszeri folyamatok.
Mód: Nyílt és randomizált placebo vizsgálatok megvizsgálták az orális probiotikus készítmények hatását a vizelet túltelítettségére és az oxalát kiválasztásra. Embereken végzett keresztmetszeti vizsgálatok az Oxalobacter formigenes kolonizációs státuszának, a vizelet oxalát kiválasztásának és a vizeletbeli kövek prevalenciájának összefüggéseit vizsgálták. Meghatároztuk a reprezentatív állatok bél mikrobiomját, amely alkalmazható a magas oxaláttartalmú étrendhez.
Eredmények: A legjobban vizsgált oxalát-lebontó O. formigenes széklettartalma a kő állapotától függően változik. Az oxalát lebontására tervezett probiotikumokkal végzett vizsgálatok, ideértve az O. formigenes, Lactobacillus és/vagy Bifidobacterium spp. Tartalmúakat is, csalódást okoztak. A magas oxaláttartalmú étrendet folytató állatok több bélszegmense különféle mikroorganizmus-közösségeket tartalmaz, amelyek együttesen képesek lebontani és méregteleníteni a nagy oxalátterhelést.
Következtetések: Bár úgy tűnik, hogy a bél mikrobioma valószínűleg szerepet játszik a litogén anyagok gyomor-bélrendszeri felszívódásának és így a vizeletkő kockázatának megváltoztatásában, továbbra is meg kell határozni, hogy tudunk-e eszközöket kifejleszteni annak manipulálására és a vesekő kockázatának csökkentésére.
Kulcsszavak: Kalcium-oxalát (CaOx); Laktobacillusok; mikrobiom; nephrolithiasis; Oxalobacter formigének
Beküldve 2016. szeptember 30-án. Elfogadva kiadásra 2016. október 12.
Bevezetés
A kalcium-oxalát (CaOx) vesekövek biológiája
Az emberek többségének vizelete túltelített és kedvez a CaOx kristályosodásának. Így talán nem meglepő, hogy a vesekő legalább 70% -a CaOx-ból áll (1). Tekintettel arra, hogy a legtöbb ember vizelete túltelített a CaOx-ra, valóban elgondolkodhat az ember, vajon miért nem mindenki képez követ. Bár a túltelítettség kulcsfontosságú és szükséges a kő kialakulásához, más biológiai események is érintettek. Ide tartozik a lehorgonyzott prekurzorok képződése a vesében, beleértve a Randall-foltot és a gyűjtőcsatlakozókat (2-5), makromolekulákat, amelyek szabályozzák a kristálynövekedés és aggregáció sebességét (6,7), valamint a kristályok internalizálódását és sejtek általi feldolgozását (8). Ezeket a másodlagos tényezőket csak részben értik meg, és jelenleg nincsenek terápiás beavatkozások alatt.
Szerencsére viszonylag többet tudni a kőképző sók vizeletösszetételének szabályozásáról. A vizelet túltelítettségét meghatározó legfontosabb tényezők a kalcium, az oxalát, a citrát és a víz vizelettel történő kiválasztása. Ezek közül erős bizonyíték arra, hogy a genetika nagymértékben befolyásolja a vizelet kalcium kiválasztását (9), bár az étrend is fontos módosító tényező (10). A bizonyítékok arra is utalnak, hogy a vizelet oxalátja, a citrát és még a víz mennyiségének is örökölhető komponensei vannak (utóbbit valószínűleg a szomjúság közvetíti) (11). Azonban a legvalószínűbb környezet (étrend és folyadékbevitel/veszteség) viszonylag fontosabb a vizelet összetételének meghatározásához.
Oxalátbiológia
Az oxalát egy kicsi dikarbonsav, amelyet az ember képez az anyagcsere végtermékeként, nagyrészt a májban (12). Az oxalát bizonyos növényekben is megtalálható, főleg CaOx kristályokként a szárakban és a levelekben. Bármi is keletkezik vagy felszívódik az étrendből az oxalát, azt ki kell üríteni a vizelettel (13). Legalább három genetikai hiba okozza az elsődleges hiperoxaluriát (PH), amely az oxalát túltermeléséhez vezet a májban (12). Az, hogy ezeknek vagy más géneknek más genetikai variációja áll-e az általános populáció enyhébb hiperoxaluriájának hátterében, továbbra sem ismert.
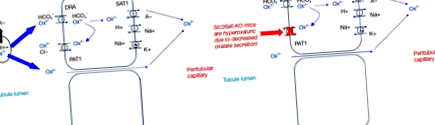
Mivel a növényekben az oxalát CaOx kristályok formájában van, csak kis mennyiség biológiailag hozzáférhető az abszorpcióhoz (általában körülbelül 10% vagy kevesebb) (14). Úgy gondolják, hogy az anionos oxalát többsége paracelluláris úton felszívódik (1. ábra) (15). Az apikális és bazolaterális transzporterekről in vitro oxaláttranszport-aktivitást is kimutattak. Ezzel szemben a transzcelluláris oxaláttranszport szerepe a normális emberi biológiában továbbra sem tisztázott. Érdekes azonban, hogy az SLC26A6 (a PAT1-et kódoló gén) kiütése hiperoxaluriát eredményez, mivel egerekben csökkent oxalát szekréció a bél lumenébe (16,17). Feltételezik tehát, hogy a bél mikrobióma általi fokozott bomlása az oxalátnak mozgatórugót generálhat az oxalát bélbe történő behatolásához, és ezáltal csökkentheti a vizelet kiválasztását. Továbbá bizonyos baktériumok oldható faktorokat szabadíthatnak fel, amelyek növelik a PAT1 aktivitását (18).
Az oxalát nagy részét a vese szűréssel távolítja el. Kisebb mennyiség szekretálódhat a proximális tubulusban. Az oxalát-szekréció mennyisége növekedhet a CKD-ben, talán a növekvő vérkoncentrációkra válaszul (19). Az oxalát nem választódik ki és nem szívódik fel újra a proximális tubulus mellett. Így az oxalátkoncentráció növekszik, amikor a víz újra felszívódik a nefron mentén, és a gyűjtőcsatornán eléri a kritikus küszöbértékeket, ahol kalciummal kristályosodhat (19). Ez kétségtelenül kulcsfontosságú tényező a vizeletkő kockázatában, különösen a már meglévő nidus növekedése szempontjából, mivel a vizeletkő nem alakulhat ki túltelítettség hiányában.
A gyomor-bél traktus az oxalátbiológia kulcsszereplője. Normális egyénekben a bevitt oxalátnak csak körülbelül 10% -a szívódik fel, feltehetően azért, mert szorosan bonyolódik a kalciummal a bevitt növényi anyagon belül (14). Az oxalát felszívódását befolyásoló tényezők közé tartozik a kalcium és a zsír mennyisége az étrendben (20). Úgy gondolják, hogy a zsírsavak megkötik a kalciumot, és ezáltal megnövelik a nem kötött anionos oxalátot, amely aztán paracellulárisan felszívódhat. A bél lumenében található szabad kalcium viszont megkötheti ezt az anionos oxalátot, és megakadályozhatja annak felszívódását. A zsír malabszorpciójának bármely okát kiváltó betegek tehát ennek alapján az enterális hiperoxaluria kockázatának vannak kitéve.
Úgy tűnik, hogy a CaOx kőképzők valamivel nagyobb százalékban veszik fel az oxalátot az ételükből (14). Az okok nem ismertek. Ennek oka lehet az oxaláttranszport genetikai változásai, a zsír felszívódásának a tendenciája vagy a bél mikrobiómájának változásai? A mai napig nincsenek egyértelmű válaszok. Az enyhe hiperoxaluriában szenvedő kőbetegek tipikus kezelési módjai közé tartozik az alacsonyabb oxaláttartalmú étrend megfelelő mennyiségű kalciummal. A kalciumnak előnyösen olyan élelmiszer-forrásokban kell lennie, mint a tejtermékek, mivel a kalcium-kiegészítők kissé növelhetik a kő kockázatát (21). Az alacsonyabb zsírbevitel szintén jó ötlet, bár a csoporton kívül nem vizsgálták átfogóan az enterális hiperoxaluriát. Azt remélték, hogy a bél mikrobiomjának manipulálása megváltoztathatja az oxalát felszívódását is.
Citrátbiológia
Úgy gondolják, hogy a citrát fontos kristályosodás-gátló (22). Szűrött kalciummal citrált komplexek, és a kristály felületén is független hatást gyakorolnak a CaOx és a brushita kristályok növekedésének gátlására (22, 23). Néhány szűrt citrát visszaszívódik a proximális tubulusban, amelyet nagyrészt a proximális tubulus sejtek pH-ja szabályoz, az alacsonyabb intracelluláris pH növeli a citrát visszaszívódását (24). Vese tubuláris acidózis hiányában a vizelet citrát nettó kiválasztásának legfontosabb meghatározója a lúg gyomor-bél traktus általi felszívódása (25). A fehérje, a krónikus felszívódási állapotok, a hipokalémia vagy a disztális vese tubuláris acidózis felé súlyozott étrend tehát a hypocitraturia leggyakoribb oka, amely a kalciumkő-képzők 20–60% -ában található meg (24). A kezelés az alapbetegség, és/vagy a kálium-citrát beadása a rendelkezésre álló lehetőségek (24). Tekintettel a gasztrointesztinális funkció kulcsfontosságú szerepére a citrát homeosztázisában, valószínűnek tűnik, hogy a mikrobiom befolyásolhatja a lúgok nettó felszívódását és így a vizelet citrát kiválasztását. Erről azonban még nem tettek közzé bizonyítékot. Valóban, a vizelet-citrát kiválasztása nem nőtt a vesekő probiotikus vizsgálatokban, ahol ezt az értéket jelentették (26–28).
Mód
Ebben a szisztematikus áttekintésben olyan nyílt és randomizált placebo vizsgálatok eredményeit mutatjuk be, amelyek az orális probiotikus készítmények hatását vizsgálták a vizelet CaOx túltelítettségére és az oxalát kiválasztásra. Beszélünk embereken végzett keresztmetszeti vizsgálatokról is, amelyek az O. formigenes kolonizációs állapot és a vizelet oxalát kiválasztásának összefüggését, valamint a vizeletkő prevalenciáját vizsgálták. Végül áttekintjük az emberek és állatok belében előforduló potenciális oxalát-lebontó szervezetekről szóló jelentéseket.
Eredmények
Lactobacillus-tartalmú probiotikumok vizsgálata kőbetegség esetén
A kutatók meggyőzően bebizonyították, hogy az endogén emésztő mikroflóra komponensei felhasználhatják az oxalátot, ami korlátozhatja annak felszívódását a bél lumenéből (29). Lactobacilli spp. -T tartalmazó probiotikumok általánosan használták gyomor-bélrendszeri tünetek, például antibiotikumok által kiváltott hasmenés kezelésére. Így azt remélhetjük, hogy kedvező hatásuk lesz a vizelet oxalát- és/vagy citrátkiválasztására. Az Oxadrop ® -ot kifejezetten a hiperoxaluria lehetséges kezelésére fogalmazták meg (28). A keverék minden egyes grammja (Oxadrop®) 2 × 10 11 baktériumot (Lactobacillus acidophilus, L. brevis, Streptococcus thermophilus és Bifidobacterium infantis) tartalmaz. A különböző törzseket 1: 1: 4: 4 tömegarányban összekeverjük és granulátumként állítjuk elő. A szervezeteket az oxalát in vitro lebontására való képességük alapján választottuk ki.
Egy kezdeti kísérleti tanulmányban az Oxadrop ® 40% -kal csökkentette a vizelet oxalát kiválasztását az enyhén hiperoxalurikus CaOx kőképzők csoportjában (30) (1. táblázat). A hipo-oxalurikus hatás 1 hónapos mosási időszak után is fennmaradt. Egy későbbi vizsgálatban az enterális hiperoxaluria és a kövek különféle okaival rendelkező tíz betegből álló csoportot szintén Oxadrop®-nal kezelték (28). Ez a vizsgálat szintén vak volt, így hiányzott a placebo kar. A betegek egymás után 4 g Oxadrop®, 8 g Oxadrop® és 12 g Oxadrop® kezelést kaptak egy-egy hónapon keresztül. Ezek az adatok csekély hatást sugalltak 4 és 8 g-nál, a vizelet oxalát kiválasztásának csökkenése körülbelül 20-25% volt (1. táblázat). A harmadik hónap 12 g Oxadrop®-on a vizelet oxalát kiválasztása ismét közel volt a kiindulási értékhez, majd egy újabb kimosási hónap után enyhén esett. Tehát ez a tanulmány azt sugallta, hogy a készítménynek lehet dózisfüggő hatása, vagy talán az, hogy az alacsonyabb (és/vagy magasabb) dózisoknál megfigyelt különbségek a vizelet oxalát kiválasztásában nem specifikusak és egyáltalán nem kapcsolódnak a vizsgált gyógyszerhez.
Ebben a randomizált, placebo-kontrollos vizsgálatban a betegeket kontrollált metabolikus étrendbe helyezték normál kalciummal (1000 mg) és redukált oxaláttal (80–100 mg), a CaOx vizeletkő diagnózisának megfelelően. Maga a diéta hatékony volt, átlagosan 36% -kal csökkentette a vizelet oxalát kiválasztását, a vizelet CaOx túltelítettségének általános javulásával. Azonban a vizelet-oxalát nem esik tovább ettől az alapvonaltól, kontrollált étrend mellett sem probiotikummal, sem placebóval. Lehetséges, hogy az étrend „túl hatékony volt”, lényegében nem hagyott annyi szabad oxalátot a bél lumenében a probiotikumok lebomlásához. Mindazonáltal a korábbi vizsgálatoknál szigorúbb felépítés azt sugallja, hogy a jelenleg rendelkezésre álló Lactobacillus-tartalmú készítmények általános alkalmazása valószínűleg nem működik olyan jól, mint azt eredetileg remélték enterális hiperoxaluriában szenvedő betegeknél.
Ezt követően egy 56 napos randomizált, placebo-kontrollos Oxadrop® vizsgálatot végeztek 20 enyhén hiperoxalurikus kőképzővel, ismert enterális hiperoxaluria nélkül és szabadon választott étrend mellett (31). Ebben a tanulmányban, hasonlóan a placebokontrollált enterális hiperoxaluria-tanulmányhoz (26), sem a karokban, sem a 28., sem az 56. napon nem figyeltek meg hatást a vizelet oxalát kiválasztására.
Amint azt fentebb megjegyeztük, feltételezzük, hogy az oxalát-lebontó baktériumoknak bizonyos mennyiségű szabad oxalátra lehet szükségük a bél lumenében való túléléshez és/vagy virágzáshoz. Így Ferraz és munkatársai 14 kőképző (7 férfi és 7 nő) populációját vizsgálták alacsony kalciumtartalmú (400 mg) és magas oxaláttartalmú (200 mg) étrenden (27). Ilyen étrendi körülmények között a vizelet oxalát kiválasztása 30% -kal nőtt az előző kiindulási ponthoz képest, szabadon választott étrend mellett. A Lactobacillus/Bifidobacterium készítmény hozzáadása azonban nem volt további hatással a vizelet oxalátszintjére.
Így összességében arra lehet következtetni, hogy a szigorúbb vizsgálatokból származó bizonyítékok nem utalnak arra, hogy a jelenleg rendelkezésre álló Lactobacillus vagy más probiotikus termékek és/vagy beadási rendjeik következetesen csökkenthetik a vizelet oxalát kiválasztását.
Oxalobacter és oxalát anyagcsere
Az O. formigenes érdekes organizmus. Ez a kötelező anaerobe az oxalátot használja egyedüli energiaforrásként. A három kulcsgén az oxalát/formiát antiporter (OxlT), a formil koenzim A transzferáz (frc) és az oxalil koenzim A dekarboxiláz (Oxc). Az emberek többsége gyermekkorban kolonizálódik O. formigenes-szel, de a kolonizáció később, felnőttkorban elveszhet, talán az antibiotikumok hatására. Az étkezési kalcium és oxalát (és így a bél lumenében lévő szabad oxalát) egyensúlya befolyásolni látszik a székletből kinyert O. formigének mennyiségét (32). Így az O. formigenes indukálható védekezés lehet a magas oxaláttartalmú étrend bevitele ellen.
Megfigyelési tanulmányok alátámasztják az O. formigenes kolonizáció szerepét a CaOx vizeletkő kockázatában. Például egy nagy keresztmetszeti vizsgálatban a 247 kőbetegnek csak 17% -át telepítették O. formigenes-sel, míg a 259 kontroll-beteg 38% -át (33). A korábbi antibiotikum-használat kolonizációs státusszal társult. Bár a kőbetegeknél magasabb volt a vizelet oxalát kiválasztása, a kolonizációs státusz nem korrelált a vizelet oxalát kiválasztásával ezekben a betegeknél, akik önállóan választott diétát folytattak.
Egy kisebb keresztmetszeti vizsgálat során tizenegy O. formigénnel kolonizált kőalakítónál alacsonyabb a vizelet oxalát kiválasztása (0,31 ± 0,10 mM/nap), összehasonlítva a 26 nem kolonizált kőalakítóval (0,40 ± 0,13 mM/nap) (34 ). A nem gyarmatosított kőalakítóknak több kőesemény volt a története. Érdekes módon az orális radioaktívan jelölt oxalátterhelés abszorpciójának százaléka nem változott a két csoport között, annak ellenére, hogy a plazma-oxalát szignifikánsan magasabb volt az O. formigenes kolonizált csoportban. Ezek a megfigyelések együtt járnak az oxalát gyomor-bélrendszeri szekréciójának csökkenésével azoknál a betegeknél, akiket nem kolonizáltak O. formigenes-sel.
Ezen ígéretes előzetes adatok ellenére abban az évtizedben, hogy egy utólagos kontrollos vizsgálatból nem jelentek meg bizonyítékot az orális O. formigenes terápia PH-ban történő alkalmazásának további támogatására. Az orális O. formigének terápiás alkalmazásának lehetséges problémái közé tartozik ennek a kötelező anaerobának a farmakológiai mennyisége, valamint a kötelező anaerobe hosszú távú életképessége paszta vagy fagyasztva szárított készítményekben. Továbbá, az irodalomban még nem jelentek meg olyan vizsgálatok, amelyek orális O. formigéneket használnának enterális vagy idiopátiás hiperoxaluriában szenvedő betegek csoportjain. Így ennek az érdekes baktériumnak a vizelettel történő oxalátkiválasztás és ezáltal a vesekő-kockázat csökkentésének farmakológiai alkalmazásának szerepe továbbra sem világos.
Egyéb oxalát lebontók
In vitro vizsgálatok szerint az O. formigenes a leghatékonyabb oxalát-lebontó szervezet, amely megtalálható az emberi bélrendszerben. Például ellenőrzött körülmények között az O. formigének a rendelkezésre álló oxalát 98% -áig lebontottak (37). Másrészt ugyanezekben a vizsgálatokban a Lactobacillus és a Bifidobacterium spp. szintén hatékonyan bontotta le az oxalátot, bár valamivel kevésbé hatékonyan (11–68%). Ezenkívül a legfontosabb oxalát-lebontó géneket, az Oxc-t és a frc-t szekvenálták a Lactobacillus és a Bifidobacterium spp. Az O. formigenes egyik potenciálisan egyedülálló tulajdonsága, hogy ez a szervezet az oxalátot szén- és energiaforrásként képes felhasználni, és az anion jelenlétében boldogul (38). Más oxalát-lebontó fajok, például a Lactobacilli méregteleníthetik az oxalátot, és életben maradhatnak jelenlétében, de nem feltétlenül gyarapodnak. Tehát a különböző baktériumok relatív jelentősége az oxalát-homeosztázisban emberben továbbra sem határozott.
Következtetések
Az étrend és a gyomor-bélrendszer működése kulcsfontosságú szerepet játszik a vizelet összetételének meghatározásában. Valószínűnek tűnik az is, hogy a gyomor-bél mikrobioma nagyban befolyásolja az étrend kulcsfontosságú összetevőinek metabolizmusát és felszívódását. A legfontosabb vizelési paraméterek, amelyeket a mikrobiom befolyásolhat, az oxalát és a citrát. Valójában a bél mikrobioma számos kötelező és általános oxalát lebontót tartalmaz. A bizonyítékok arra utalnak, hogy az O. formigenes, a legjobban vizsgált oxalát-lebontó anyag széklettartalma a kő kockázatától és a vizelettel történő oxalát kiválasztás függvényében változik. Az oxalát lebontására tervezett probiotikumokkal - ideértve az Oxalobacter, Lactobacillus és/vagy Bifidobacterium spp. - végzett kísérleteket mind a mai napig kiábrándító hatásúak voltak. Tehát, bár a bél mikrobioma valószínűleg szerepet játszik a vizeletkő kockázatának módosításában, nem tudunk-e kifejleszteni eszközöket annak kezelésére és a kockázat csökkentésére.
Köszönetnyilvánítás
Finanszírozás: A tanulmányokat részben támogatta (I) a Ritka Vese Kő Konzorcium (U54KD083908), amely a Ritka Betegségek Klinikai Kutatási Hálózatának (RDCRN) része, a Ritka Betegségek Kutatásának Hivatala (ORDR), a Translational Advances Országos Központjának kezdeményezése Tudományok (NCATS). Ezt a konzorciumot az NCATS és az Országos Cukorbetegség, Emésztési és Vesebetegségek Intézete (NIDDK) együttműködésével finanszírozzák; (II) Mayo Klinika O’Brien Urológiai Kutatóközpont, DK100227; (III) NIH támogatás, R21AT2534; (IV) V.S.L. Pharmaceuticals Inc., Gaithersburg, MD; és (V) a Mayo Alapítvány. A finanszírozási forrásoknak nem volt szerepük a tanulmány megtervezésében, lebonyolításában vagy jelentésben.
Lábjegyzet
Érdekkonfliktusok: A szerzőnek nincs kijelentendő összeférhetetlensége.
- Osteoarthritis megelőzése és kezelése növényi étrenddel; Növényi étrendek az orvostudományban
- Új terápiás megközelítések az elhízás kezelésére Science Translational Medicine
- Nyálkövek Johns Hopkins orvostudomány
- A hagyományos kínai orvoslás, a tea legújabb tudományos vizsgálata a krónikus betegségek megelőzéséről
- Megfigyelések a belgyógyászat elhízottságáról