Az aminometilezett dihidroquercetin szintézise, jellemzése, oldása, citotoxicitása és antioxidáns aktivitása †
Jianxia Li
a természetvédelmi iskola, Pekingi Erdészeti Egyetem, Peking 100083, Kína
Jieqiong Dong
b Biológiai Tudományok és Technológia Főiskola, Pekingi Erdei Élelmiszer-feldolgozási és Biztonsági Fő Laboratórium, Pekingi Erdészeti Egyetem, Tsinghua East Road 35. szám, Haidian körzet, Peking 100083, Kína. E-mail: moc.361@12283326w; Fax: +8601062336700; Tel .: +8601062336700
Jie Ouyang
b Biológiai Tudományok és Technológia Főiskola, Pekingi Erdei Élelmiszer-feldolgozási és Biztonsági Fő Laboratórium, Pekingi Erdészeti Egyetem, Tsinghua East Road 35. szám, Haidian körzet, Peking 100083, Kína. E-mail: moc.361@12283326w; Fax: +8601062336700; Tel .: +8601062336700
Jie Cui
c Gyógynövény-fejlesztési Intézet, Kínai Orvostudományi Akadémia, Peking 100193, P.R. Kína
Yuan Chen
b Biológiai Tudományok és Technológia Főiskola, Pekingi Erdei Élelmiszer-feldolgozási és Biztonsági Fő Laboratórium, Pekingi Erdészeti Egyetem, Tsinghua East Road 35. szám, Haidian körzet, Peking 100083, Kína. E-mail: moc.361@12283326w; Fax: +8601062336700; Tel .: +8601062336700
Fengjun Wang
b Biológiai Tudományok és Technológia Főiskola, Pekingi Erdei Élelmiszer-feldolgozási és Biztonsági Fő Laboratórium, Pekingi Erdészeti Egyetem, Tsinghua East Road 35. szám, Haidian körzet, Peking 100083, Kína. E-mail: moc.361@12283326w; Fax: +8601062336700; Tel .: +8601062336700
Jianzhong Wang
b Biológiai Tudományok és Technológia Főiskola, Pekingi Erdei Élelmiszer-feldolgozási és Biztonsági Fő Laboratórium, Pekingi Erdészeti Egyetem, Tsinghua East Road 35. szám, Haidian körzet, Peking 100083, Kína. E-mail: moc.361@12283326w; Fax: +8601062336700; Tel .: +8601062336700
Absztrakt
A dihidrokvercetin-származékot (DHQA) aminometilezéssel állítottuk elő a dihidroquercetin (DHQ) alacsony vízoldékonyságának és biohasznosulásának leküzdésére. A DHQA-t HPLC, magmágneses rezonancia, pásztázó elektronmikroszkópia, röntgendiffrakció és termogravimetriás elemzések segítségével jellemeztük. A DHQA átalakult amorf formává, de a DHQ fő szerkezete változatlan maradt. Szolubilizációs és oldódási teszteket is végeztek. Az eredmények azt mutatták, hogy a DHQA oldhatósági és oldódási sebessége körülbelül 16,28, illetve 6,31-szer nagyobb volt, mint a DHQA. A DHQA MTT vizsgálata nem toxikus hatást mutatott a nem rákos HEK-293T sejtekkel szemben (EC50 = 820,00 μM), és a rákos Hela sejtekkel szemben erős gátló aktivitást mutatott (EC50 = 138,17 μM). Végül a DHQA antioxidáns aktivitását in vitro megerősítettük DPPH és ABTS gyökfogó aktivitási vizsgálatokkal. A DHQA magas antioxidáns aktivitást mutatott alacsony IC50 értékekkel (0,043, illetve 0,042 mM). Redukáló Fe 3+ teljesítményvizsgálat azt mutatta, hogy a DHQA nagyobb redukáló erővel rendelkezik, mint a DHQ és az aszkorbinsav.
1. Bemutatkozás
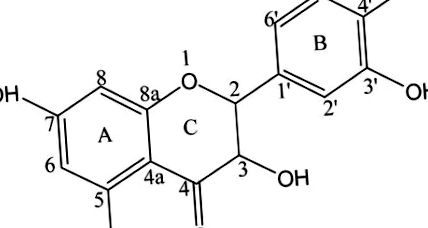
A dihidroquercetin (DHQ; más néven 3,5,7,3,4-pentahidroxi-flavanon vagy taxifolin; 1. ábra) flavonoid és az egyik leghatékonyabb természetes antioxidáns, amely fontos az emberi egészség szempontjából. a Pinus vagy Larix nemzetség kérge és a Silybum nemzetség magjaiban. A 2,3 DHQ daganatellenes, antimikrobiális, 4 gyulladáscsökkentő, fájdalomcsillapító, 5 és anti-adipogén tulajdonságokkal rendelkezik, 6 valamint gyökfogó hatású. 7 DHQ javíthatja az agy vérkeringését és hatékonyan gátolhatja a celluláris melanogenezist, miközben növeli a tirozináz fehérje szintjét. 2,8,9 Ez a vegyület vírusellenes aktivitást mutat, ellenállást vált ki a szív- és érrendszeri betegségekkel és a vérlemezke-aggregációval szemben. Ezért a DHQ-t széles körben alkalmazták orvosi, élelmiszeripari, kozmetikai, mezőgazdasági és műszaki területeken. A DHQ azonban nehezen szívódik fel és metabolizálható alacsony vízoldhatósága miatt, ezáltal korlátozza annak biológiai hozzáférhetőségét és hatékonyságát. 10,13,14 Ezért a DHQ hatékony, vízoldékony és nem toxikus szintetikus származékát kell kifejleszteni alkalmazásának bővítése érdekében.
A DHQ aminometilezését nemrégiben vizsgálták. Nifant'ev et al. szekunder aminokat, primer amint és amilamint használtak amin-komponensként a Mannich (aminometilezés) reakcióban nagyszámú egyszeresen helyettesített és szubsztituálatlan DHQ-származék szintetizálásához.15 Kosheleva et al. szintetizálták a DHQ szoros szerkezeti analógjait a Mannich-reakciók reagenseinek ekvimoláris arányával.16 Kaziev et al. a módosított flavonoidon, a 2,3-dihidrokvercetinen alapuló DHQ heteropoli-vegyületekről számoltak be Mannich-reakciókból.17 Ezek az eredmények azt mutatták, hogy ezeknek a DHQ-származékoknak a DHQ fő szerkezete van, amely öt hidroxilcsoportot tartalmaz. Ezért ezek a DHQ-származékok számos hidroxilcsoport miatt meg tudják őrizni a DHQ antioxidáns tulajdonságait.18 A DHQ-módosítást olyan aminocsoportok bevezetésével érjük el, amelyek új, többfunkciós vegyületeket hoznak létre, amelyek szerkezeti egyensúlya megszakadt az oldhatóság fokozása érdekében. A korábbi vizsgálatok azonban az aminometilezett DHQ-származékok szintézisére és szerkezetére összpontosítottak. Legjobb tudomásunk szerint az aminometilezett DHQ-származékok jellemzéséről, oldhatóságáról, oldódási sebességéről és antioxidáns aktivitásáról eddig nem számoltak be.
Ez a tanulmány egy vízoldható DHQ-származék előállítására és jellemzésére összpontosított, amelyet aminometilezéssel állítottak elő az eredeti DHQ molekuláris szerkezet megváltoztatása nélkül. Végeztük a DHQ szelektív biszaminometilezését l-prolinnal; a reakciót DHQ: formaldehid: 1 -prolin 1: 2: 2 mólaránynál hajtjuk végre (2. ábra). Az aminometilezett DHQ származék szerkezetét és tulajdonságait nagy teljesítményű folyadékkromatográfia (HPLC), magmágneses rezonancia spektroszkópia (NMR), pásztázó elektronmikroszkópia (SEM), röntgendiffrakció (XRD) és termogravimetria (TG) jellemezte. Végül oldhatósági, oldódási sebességi, citotoxicitási és antioxidáns aktivitási teszteket végeztek az aminometilezett DHQ származék biológiai aktivitásának vizsgálatára. Ez a munka értékes információkkal szolgálhat a DHQ oldhatóságának javításához, hogy az emberi test könnyen felszívódjon és metabolizálódjon.
2. Anyagok és módszerek
2.1. Anyagok
Korábbi vizsgálatunk szerint a DHQ-t (96% -os tisztaság) izoláltuk a Larix gmelinii-ből. 19 HEK-293T (emberi embrionális vese 293T) és Hela (humán nyaki karcinóma) sejteket az Union Hospital-tól (Peking, Kína) vásároltunk. A Dulbecco módosított sas táptalaját (DMEM) és a szarvasmarha magzati szérumát (FBS) a Hyclone-tól (Logan, UT, USA) szereztük be. A penicillin – sztreptomicint a Gibcótól (Grand Island, NY, USA) vásároltuk. Ciszplatin, arisztolinsav, dimetil-szulfoxid (DMSO), 3- (4,5-dimetil-tiazol-2-il) -2,5-difeniltetrazolium-bromid (MTT), 1,1-difenil-2-pikril-hidrazil (DPPH) gyök és 2, A 2′-azinobisz (3-etilbenzthiazolin-6-szulfonátot) (ABTS) a Sigma-tól (St. Louis, MO, USA) szereztük be. Az összes többi oldószer és vegyszer analitikai minőségű volt, és a Beijing Chemical Reagents Co., Ltd.-től (Peking, Kína) szerezte be. A vizet az NW ultratiszta vízrendszerrel tisztítottuk (Pudong, Sanghaj, Kína).
2.2. Aminometilezett DHQ előállítása
A vegyületet (DHQA: DHQ aminometilezése) Nifant'ev és munkatársai módszerével szintetizáltuk. enyhe módosításokkal.20 33% formalin (1,32 mmol), l-prolin (0,152 g; 1,32 mmol) és 10 ml etanol keverékét 60 ° C-on keverjük a teljes homogenizálásig. Végül lassan hozzáadunk 0,2 g (0,66 mmol) DHQ-oldatot 5 ml etanolban. A reakcióelegyet 60 ° C-on 1,5 órán át keverjük. A kapott halványsárga porszerű csapadékot szűréssel elválasztjuk, egymás után etanollal, benzollal és hexánnal mossuk, és vákuumban szárító kemencében állandó tömegre szárítjuk.
A DHQA-t HPLC-vel módosított módszerrel analizáltuk. 16 Shimadzu LC-2010A HPLC rendszert (Kiotó, Japán) LC-2010 detektorral és Shimadzu VP-ODS-C18 oszlopot (250 mm × 4,6 mm) alkalmaztunk. A mozgófázis MeOH – CF3COOH (0,1%) volt, gradiens eluálással 10–90% MeOH-t 30 perc alatt. Az eluens izokratikusan áramolt 1,0 ml/perc sebességgel. A mintát 288 nm-en detektáltuk, és az injekció térfogata 20 μL volt. Az összes mintát 0,45 μm membránszűrőn átszűrtük, mielőtt a HPLC készülékbe injektáltuk volna.
2.3. 1H és 13C NMR spektroszkópia
Az 1H és 13C NMR spektrumokat szobahőmérsékleten működő, 400 MHz-es Bruker AV-III spektrométeren (Németország) nyertük, oldószerként DMSO-d6-ot és belső standardként tetrametil-szilánt (TMS). A mérés előtt 20 és 40 mg szárított mintát oldunk 0,5 ml DMSO-d6-ban 1H, illetve 13C-NMR-spektrumban. Az 1H-NMR-spektrumokat minimum 64 szkenneléssel kaptuk, míg a 13C-NMR-spektrumokat impulzus FT módban (100,6 MHz) végeztük, minimum 2048 szkenneléssel.
2.4. SEM
A SEM mintáit HITACHI ES-2030 készülékben liofilizáltuk, kolloid grafittal ellátott fém csonkokra szereltük, és Hitachi E-1010 porlasztó bevonattal 70 másodpercig arannyal vontuk be. Az anyagokat megfigyeltük, és HITACHI S-3400 készülékkel készítettünk mikrográfiákat.
2.5. Por XRD
A por XRD elemzéseket Shimadzu XRD-7000 röntgendiffraktométeren végeztük Cu Kα sugárzással. A diffrakciós mintákat 5 ° és 60 ° között rögzítettük 2θ = 0,02 ° lépésmérettel 5 ° min –1 szkennelési sebességgel .
2.6. Hőelemzések (TG)
A DHQ és DHQA súlycsökkenését TG analizátorral (Q500, TGA Instruments) határoztuk meg. Körülbelül 10 mg mintát használtunk fel minden egyes kísérlethez. A mintát dinamikus nitrogén atmoszférában (áramlási sebesség = 70 ml/min –1) melegítettük szobahőmérsékletről 600 ° C-ra, 10 ° C min –1 fűtési sebességgel .
2.7. Szolubilizációs teszt
A DHQ és a DHQA oldhatóságát Yang és mtsai. 10 szerint határoztuk meg. A megfelelő vegyület felesleges mennyiségét 2 ml vízbe (kb. PH 5,7) helyeztük nitrogén alatt és fénytől védve. Az elegyet 1 órán át 20 ± 2 ° C-on kevertük. Az oldatot 0,45 μm cellulóz-acetát membránon szűrjük. A szűrletet csökkentett nyomáson szárazra pároljuk, és a maradékot mérési módszerrel adagoljuk.
2.8. Oldódási teszt
2.9. Citotoxicitási vizsgálat
A HEK-293T és Hela sejteket DMEM táptalajon tenyésztettük, kiegészítve 10% FBS-szel, 100 U mL –1 penicillinnel és 100 mg mL –1 streptomycinnel. A sejteket 37 ° C-on, 5% CO2-ot tartalmazó párásított inkubátorban inkubáltuk. DHQ-t, DHQA-t és pozitív kontrollokat (ciszplatin és arisztolochosav) DMSO-ban készítettünk, és a tápközeggel különböző koncentrációkra (2–1280 μM) hígítottuk. A DMSO végső koncentrációja a táptalajban kevesebb mint 0,1% volt.
A sejteket 96 lyukú lemezekre oltottuk (1x104 sejt/üreg, 200 μL/üreg) és tenyésztettük 37 ° C-on. 12 órás előinkubálás után, hogy lehetővé tegye a sejtekhez való csatlakozást, a felülúszót eltávolítottuk, és különféle koncentrációjú tesztoldatot tartalmazó vak táptalajt vagy táptalajt adtunk hozzá, és 48 órán át inkubáltuk. Inkubálás után a felülúszót eltávolítottuk, és minden egyes üregbe 100 μl tetrazólium-reagenst (1 mg ml – 1) adtunk, majd további inkubálást folytattunk 37 ° C-on 4 órán át. A felülúszót dekantáltuk, és DMSO-t (lyukanként 150 μl) adtunk hozzá, hogy a formazan oldódjon. Az egyes üregek optikai sűrűségét (OD) mikrotányér-leolvasóval (BIO-RAD Model 680) detektáltuk 570 nm-en. Mindegyik kezelést ötször megismételtük. Az 50% -os effektív koncentrációt (EC50) görbeillesztéssel határoztuk meg.
2.10. Antioxidáns aktivitás vizsgálatok
2.10.1. DPPH gyökfogó tevékenység
A DHQ és a DHQA DPPH gyökökkel szembeni eltávolító aktivitását standard módszerrel értékeltük, néhány módosítással.22 Az extraktumot (2 ml) összekevertük 2 ml DPPH oldattal (2 × 10–4 mol L – 1). A reakcióelegyet sötétben, szobahőmérsékleten inkubáltuk 30 percig, mielőtt az elegy abszorbanciáját 517 nm-en elérjük. Pozitív kontrollként aszkorbinsav DPPH gyököt alkalmaztunk. A DPPH gyökökkel szembeni eltávolító aktivitás százalékát a következő egyenlettel számoltuk: Radikális eltávolító aktivitás (%) = [1 - (A - B)/C] × 100 ahol A a mintakivonattal kevert DPPH gyök oldat abszorbanciája, B az alkohollal kevert mintakivonat abszorbanciája, és C a vízzel kevert DPPH gyökoldat abszorbanciája. Az összes mérést három példányban hajtottuk végre (n = 3).
2.10.2. ABTS radikális eltávolító tevékenység
A vizsgálatot a Li, Wang, Wang, Walid és Zhang által leírt eljárásnak megfelelően hajtottuk végre, néhány módosítással.23 A munkaoldatot 7,4 mM ABTS és 2,6 mM kálium-perszulfát törzsoldatok azonos mennyiségű összekeverésével készítettük; az elegyet 12 órán át szobahőmérsékleten, sötétben reagáltatjuk. A kapott oldatot (1 ml) alkohollal hígítottuk, hogy UV spektrofotométerrel 734 nm-nél 0,7 ± 0,02 egységet kapjunk a szükséges abszorbanciához. A vizsgálathoz frissen készített ABTS oldatot használtunk. Röviden: 0,2 ml kivonatot hagyunk reagálni 0,8 ml ABTS oldattal; az abszorbanciát 734 nm-en 6 perc elteltével spektrofotométerrel rögzítettük. Pozitív kontrollként az aszkorbinsav ABTS gyökeit használtuk. Az ABTS gyökökkel szembeni felszívási aktivitás százalékát a következő egyenlettel számoltuk: Radikális eltávolító aktivitás (%) = (Abscontrol - Abssample)/Abscontrol ahol az Abscontrol az ABTS abszorbanciája az alkoholban, az Abssample pedig a mintával kevert ABTS abszorbancia kivonat. Az összes mérést három példányban hajtottuk végre (n = 3).
2.10.3. A Fe 3+ teljesítményvizsgálat csökkentése
3. Eredmények és megbeszélés
3.1. HPLC elemzés
A DHQA azonosítása és mennyiségi meghatározása a retenciós idők és a terület normalizálási módszer kombinációján alapult, HPLC rendszer alkalmazásával. A 3A. Ábrán az eredmények azt mutatták, hogy a DHQA retenciós ideje 10,39 perc volt, amely különbözött a 3B. Ábrán látható DHQ-tól (RT = 18,01 perc). A terület normalizálási módszer szerint a DHQA csúcsterülete 96% volt. Ez a jelenség egyértelműen megmutatta, hogy a DHQ aminometilezése megtörtént, és a DHQA meglehetősen nagy tisztaságú volt.
- Új DNS-kationos lipidek szintézise, aktivitása és felépítése - aktivitás-kapcsolat tanulmányok
- Ipari törölközőhulladékból származó cellulózszármazékok szintézise és jellemzése - Yıldız - 2019
- Fizikai aktivitás és súlykezelés áttekintő központ
- Csalán az egészségre növényi alapú étrend antioxidáns plantpowerz
- Fizikai aktivitás a fogyáshoz Kaiser Permanente