Táplálkozási ketózis a testsúly kezeléséhez és a metabolikus szindróma megfordításához
Victoria M. Gershuni
1 - Sebészeti Osztály, Perelman Orvostudományi Kar, Pennsylvaniai Egyetem, Philadelphia, PA
2. Gasztroenterológiai osztály, Perelman Orvostudományi Kar, Pennsylvaniai Egyetem; Philadelphia, Pennsylvania
Stephanie L. Yan
3- Gasztroenterológiai és hepatológiai osztály, Kaliforniai Egyetem Belgyógyászati Tanszék Davis, Davis, Kalifornia
Medicina Valentina
3- Gasztroenterológiai és hepatológiai osztály, Kaliforniai Egyetem Belgyógyászati Tanszék Davis, Davis, Kalifornia
Absztrakt
A felülvizsgálat célja:
A cikk célja a táplálkozási ketózissal kapcsolatos jelenlegi irodalom áttekintése a testsúly-szabályozás és a metabolikus szindróma összefüggésében - nevezetesen az inzulinrezisztencia, a lipidprofil és a szív- és érrendszeri betegségek kockázata, valamint az alkoholmentes zsírmájbetegség kialakulása. Megadjuk a ketogenezis mechanizmusának hátterét és leírjuk a táplálkozási ketózist.
Legfrissebb eredmények:
A táplálkozási ketózisról kiderült, hogy javítja az anyagcsere és a gyulladás markereit, beleértve a lipideket, a HbA1c-t, a nagy érzékenységű CRP-t, az éhomi inzulin- és glükózszinteket, és elősegíti a testsúly szabályozását. Megbeszéljük ezeket az eredményeket, és részletezzük a ketonok lehetséges mechanizmusait a fogyás elősegítésére, az éhség csökkentésére és a jóllakottság növelésére.
Összegzés:
Az emberek az anyagcsere rugalmasságának képességével és a ketonok üzemanyagként történő felhasználásának képességével fejlődtek. Alacsony étrendi szénhidrátfogyasztás esetén az inzulinszint alacsony marad, és ketogenezis zajlik. Ezek az állapotok elősegítik a felesleges zsírraktárak lebomlását, a sovány izmok megkímélését és az inzulinérzékenység javulását.
BEVEZETÉS
Az elhízás és a kapcsolódó metabolikus szindróma járvány a nyugati világban. Világszerte az elhízás 1975 óta csaknem megháromszorozódott. 2016-ban a WHO világszerte a felnőttek túlsúlyos és az elhízás arányát meghaladta a 39, illetve a 13% -ot. Az Egyesült Államokban ezek a megdöbbentő statisztikák kétmilliárd felnőttet tartalmaznak, és évente több mint 149 milliárd dollár egészségügyi dollárt jelentenek. 1 Ezzel párhuzamosan a 60 évnél idősebb lakosság 40% -ánál metabolikus szindróma van, amelyet a tünetek és a biomarkerek konstellációja határoz meg, beleértve: elhízás (derék kerülete), emelkedett éhomi vércukorszint inzulinrezisztenciával, hipertrigliceridémia, alacsony HDL-koleszterinszint, és magas vérnyomás. 2 A metabolikus szindróma olyan szisztémás gyulladásos állapot, amely a cukorbetegség ötször megnövekedett kockázatával és a szív- és érrendszeri betegségek (CVD) kétszeres kockázatával jár együtt, és mindkettő a morbiditás és a halálozás egyre gyakoribb oka. 3
Érdekes módon a metabolikus szindróma öt fő összetevőjét - elhízás, éhomi vércukorszint, magas trigliceridszint (TG), alacsony HDL-koleszterinszint és magas vérnyomás - mind javítja a szénhidrát-korlátozás, ami arra utal, hogy a szénhidrát-intolerancia egy közös szál. Az elmúlt évszázadok élelmiszer-ellátásának iparosodásával többlet kalóriát és feldolgozott cukrot és szénhidrátot tartalmazó élelmiszertermékeket élveztünk. Láthattuk együtt az elhízás és a túlsúly arányát, miközben romlik az anyagcsere-erőnlét.
Az étrendi szénhidrátok korlátozásával az inzulinszekréció alacsonyabb szinten stabilizálható. Ha az inzulinszint alacsony, a zsírszövetben tárolt zsír hormonérzékeny lipáz révén lipolízisen megy keresztül. A felszabadulás után a szabad zsírsavak béta-oxidációval mennek át a máj mitokondriumaiban, hogy acetil CoA-t termeljenek keton testek létrehozásához. Ez a folyamat táplálkozási ketózis állapotot indukálhat, ami az anyagcsere elmozdulását eredményezheti. A csökkent inzulin felszabadulás elősegíti az anyagcsere elmozdulását a lipid oxidáció felé, valamint a zsírsavak és ketonok energiaként történő felhasználását. 6.
Ketonok - alternatív üzemanyag-forrás
Fajként anyagcsere-rugalmasságunk van, és képesek vagyunk alternatív üzemanyag-forrásokra támaszkodni az energiához. Az optimális működés érdekében az emberek nem függenek exogén glükózforrásoktól; inkább évezredek alatt fejlődtünk, hogy alkalmazkodjunk a változó körülményekhez, és alkalmazkodjunk mind a szűkösséghez, mind a bőséghez. Dr. Randle a Lancet-ben 1963-ban kifejtette: „A szubsztrát anyagcseréje a normális emberi testben rugalmas. Testünk úgy fejlődött, hogy a különböző üzemanyag-forrásokat felhasználja, azok elérhetőségétől függően. " 7
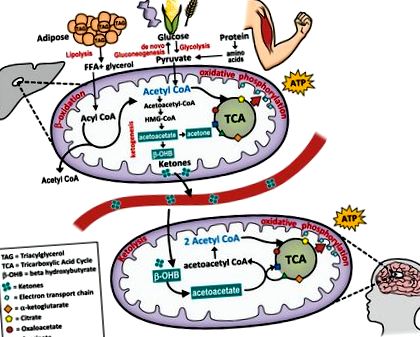
A glükóz hasznosításának alternatívájaként a test metabolikusan hajlamos a ketózis állapotára, amely a májban termelt zsírból származó ketonokra támaszkodik, és így a test szinte minden sejtjének üzemanyagot szolgáltat (lásd 1. ábra). A ketonok - az acetoacetát, a béta-hidroxi-butirát és az aceton - vízben oldódó molekulák, amelyeket a máj zsírsavakból állít elő, amikor a vércukorszint és a májglikogén-raktárak minimálisra csökkentek. Glikogén kimerülés lép fel, és a ketonszint emelkedik böjt, alacsony szénhidrátbevitel, intenzív testmozgás, éhezés vagy kezeletlen I. típusú cukorbetegség teljes inzulinhiánya miatt.
A ketogenezis, a ketonok üzemanyagként történő előállítása normális, fiziológiai folyamat, amely a szabad zsírsavak májbéta-oxidációján keresztül megy végbe a májsejtek mitokondriumában. A zsírszövetben zsírként tárolt energiát acetil-CoA-vá szabadítják fel és ketonokká alakítják. A májon kívüli szövetek képesek ketolízison átesni és a ketonokat visszaállítani acetil-CoA-vá, amely belép a TCA ciklusba, és amelyet a mitokondriumok használnak ATP előállítására energiára.
A lipolízis és a ketogenezis hormonális aktiválódását az epinefrin és a glükagon közvetíti, az inzulin ellenzi. Minimális étrendi szénhidrát esetén az inzulin kevés és a glükagon megnő. Amellett, hogy stimulálja a máj glikogenolízisét, a glükagon stimulálja a lipolízist, hogy a raktározott zsírsavakat felszabadítsa a zsírszövetből. 8 A ketonok képződése mellett a zsírsavak átalakíthatók acetil-CoA-vá - közbenső szubsztrátként a zsírsav-oxidáció és a glükóz metabolizmusa között -, amely belép a citromsav-körforgásba, majd az oxidatív foszforilezésen megy keresztül ATP-képződés céljából. Ezzel szemben a magas vércukorszintre adott válaszként (azaz magas szénhidráttartalmú étkezés után) az inzulinszint emelkedik és leállítja a ketogenezist a de novo lipogenezis (zsírraktározás) érdekében. A ketózis tehát elmozdulást jelent az inzulin által közvetített glükózfüggő állapotról az étkezési zsír- és zsírraktárak üzemanyag-használatának fokozott képességére.
Ennek a folyamatnak a révén a zsírból származó energia keletkezik a májban, majd az egész testben szállítja az energiát az agy, a vesekéreg, a szív és a vázizmok számára. 6 A ketonok a szervezet által igényelt ATP 60% -át képesek ellátni; A fennmaradó rész endogén glükoneogenezisből származik, amely glicerin-triglicerideket és fehérjékből származó glükogén aminosavakat használ fel a glükóztermeléshez. A ketonok átjutnak a vér-agy gáton, és helyettesítik a glükózt, mint az agy elsődleges energiaforrását. George Cahill úttörő munkája az éhezési ketózis modelljeinek felhasználásával feltárta, hogy az agy metabolikus rugalmassággal rendelkezik, és átállhat glükózfüggő szervről (
150 g/nap) olyanra, amely energiájának 2/3-át ketonokból nyeri. 9,10
Táplálkozási ketózis
A táplálkozási ketózis az étrendi szénhidrátbevitel szándékos korlátozásaként határozható meg a ketonok termelésének felgyorsítása és metabolikus hatás kiváltása érdekében, amely stabilizálja a vércukorszintet, minimalizálja az inzulin felszabadulását, és ezáltal enyhíti a hosszú távú inzulinrezisztencia downstream anabolikus és tumorigén hatásait. Amint azt Volek és Phinney leírta, a „jól megfogalmazott” ketogén étrend 5–10% szénhidrátból áll (11 A hasonló hangzású nevek ellenére két különálló anyagcsere-folyamatról van szó. Az endogén inzulin termelése véd a DKA előfordulása ellen; a DKA-ban jelenlévő ketonok tartománya 5–10-szer nagyobb, mint a táplálkozási ketózis során elért szintek. táplálkozási ketózis esetén a test képes fenntartani a normális vércukorszintet és fenntartani a normális pH-t, szemben a DKA-val társított rendkívül magas vércukorszinttel és savas pH-val.
Sok hét után bekövetkezik a „keto-adaptáció”, ami azt jelzi, hogy a test képes alkalmazkodni és reagálni arra, hogy elsősorban ketonokat használjon üzemanyagként. Ennek egyik lehetséges oka másodlagos a metabolikus mechanizmust kódoló gének felülszabályozott transzkripciója miatt, ami megnövekedett mitokondriális sűrűséget eredményez az oxidatív szövetekben, például az agyban és az izmokban. Egérvizsgálatok szerint ez megnövekedett mitogenezissel vagy csökkent mitokondriális károsodással történhet. 12,13 Ezenkívül a ketonok képesek epigenetikus szabályozást indukálni a hiszton dezacetiláció gátlásán keresztül, jelezve, hogy az energiaforrás mellett jelátviteli molekula. 14
A ketogén étrend mint orvosi terápia eredete
A ketogén étrend eredeti kutatása az 1900-as évek elején kezdődött az epilepszia kezelésének és a rohamok minimalizálásának egyik módjaként. A ketózis kiváltásával a betegek enyhítették a roham aktivitását és javították a kognitív funkciókat, kiemelve a ketonok képességét, hogy energiát szolgáltassanak az agynak. 15 Az 1960-as évektől kezdve a nagyon alacsony szénhidráttartalmú ketogén diéták (VLCKD) egyre inkább elhízáskezelő módszerekként váltak ismertté. Az utóbbi néhány évtized legújabb munkája bizonyítékot szolgáltatott a ketogén étrend terápiás potenciáljára számos kóros állapotban, beleértve a cukorbetegséget, a PCOS-t, az aknét, a neurológiai betegségeket (epilepszia, Alzheimer-kór, CVA), a rákot, valamint a légzőszervi és a szív- és érrendszeri betegségek kockázatának enyhítését. tényezők. 15 Az a lehetőség, hogy az élelmiszer-bevitel módosítása csökkentheti vagy megszüntetheti a gyakran jelentős mellékhatásokat hordozó gyógyszerek iránti igényt, komoly vizsgálatot igényel. Az étrendi szénhidrátbevitelt változó eredménnyel vizsgálták, ami gyakran a szénhidrátbevitel szabványosításának hiánya és a ketózis megerősítésének képtelensége a vér ketonszintjének ellenőrzése nélkül.
Volek és Phinney szerint 5,16 a ketogén étrend elsődleges jellemzője a ketózis kialakulása és az inzulinszint stabilizálása, amely a metabolikus szindróma biomarkereivel foglalkozik. Az inzulin emelkedésének csökkentésével a lipidek felszabadulnak a tárolásból és oxidálódnak. 17 Mint ilyen, a ketózis felhasználható a lipolízis indikátoraként. Így az „alacsony szénhidráttartalmú” étrendet összehasonlító tanulmányok során fontos értékelni, hogy az étrend ketogén-e. Ez a táplálkozási szakirodalom széles körben mozog az „alacsony” szénhidrátbevitel meghatározásának meghatározásában, egyesek a szénhidrátokból származó 35% -os vagy kevesebb, mint 140g/d mennyiséget tartják metrikának. Így a VLCKD hatásának értékelésekor fontos, hogy a kutatás 18 felhasználásával történjen
Ez a felülvizsgálat kiemeli a ketogén étrendek súly- és anyagcsere-kezelésben, cukorbetegségben, koszorúér-betegségekben és alkoholmentes zsírmájbetegségben (NAFLD) betöltött szerepének jelenlegi megértését.
FOGYÁS
A túlsúlyos és elhízott felnőttek alacsony szénhidráttartalmú és LFD-beavatkozásait összehasonlító metaanalízis során Sackner-Bernstein és munkatársai 17 RCT-t (összesen 1797 alanyot) tekintettek át. A kiindulási demográfia, a kalóriabevitel és a teljesítési arány hasonló volt a különböző csoportok között. Az alacsony szénhidráttartalmú csoport esetében a makrotápanyagok átlagos napi bevitele 60 g szénhidrát (95% CI: 44, 76), 90 g zsír (95% CI: 77, 104) és 106 g fehérje (95% CI: 77) volt., 104). Az alacsony zsírtartalmú csoport 205 g szénhidrátból (95% CI: 186, 225), 37 g zsírból (95% CI: 32, 42) és 70 g fehérjéből (95% CI: 64, 76) állt. Minden étrend jelentős súlyvesztéssel és a koszorúér-események várható kockázatának csökkenésével járt, de az alacsony szénhidráttartalmú csoport statisztikailag szignifikánsan nagyobb javulást mutatott mindkettőben. 28.
METABOLIKUS SZINDRÓMA
Lipid profil és CVD
Glikémiás kontroll, inzulinérzékenység és cukorbetegség
A plazma glükóz kezelése és az inzulin lipid anyagcserére gyakorolt hatásának módosítása fontos célpont a cukorbetegség kezelésében és a társbetegségek, köztük a szisztémás mikrovaszkuláris szövődmények megelőzésében. Az inzulinrezisztencia fokozott máj lipidfelhalmozódással, a VLDL termelésével és a glükoneogenezissel jár. 57,62 Az inzulinrezisztencia összetett anyagcsere-állapot, amely befolyásolja az energiafelhasználást és serkenti a „méhen kívüli” zsírlerakódást a nem zsírszervekben, nevezetesen a vázizomban, a szívben és a hasnyálmirigyben. 52,61,63 A csontvázizom szintjén gátolja a plazma glükózfelvétel képességét, ami glükóz-eltérítést eredményez a májban, ahol zsírsá alakul és tárolódik zsírként. 15,62 Ezzel szemben a táplálkozási ketózis csökkenti az inzulinszintet, ezáltal elnyomva a lipogenezist. 15
2-es típusú cukorbetegeknél a VLCKD csökkenő exogén inzulinigénnyel jár; a ketonszint emelkedése fordítottan összefügg a máj glükózképződésének szintjével, ami arra utal, hogy a magasabb ketonszintek a jobb glikémiás kontrollhoz kapcsolódnak. Accurso és mtsai. kimutatta, hogy a VLCKD-ben szenvedő 2-es típusú cukorbetegek (67 Hasonlóképpen, McKenzie és mtsai 262 cukorbeteg alanyot vontak be ambuláns programba táplálkozási tanácsadással, viselkedésmódosítással, digitális oktatással és orvos által támogatott gyógyszerkezeléssel. 10 hét után újraértékelés figyelemre méltó volt a következetes szénhidrát-korlátozás miatt, amit az átlagos béta-hidroxi-butirát-szint, a hemoglobin A1c csökkenése, valamint a diabéteszes gyógyszerek dózisának és számának csökkenése bizonyít. 68 Egy prospektív, 1 éves nyílt, nem randomizált, kontrollált vizsgálatban al. a táplálkozási ketózis alkalmazásával értékelték a cukorbetegség folyamatos kezelését a szokásos ellátáshoz képest (262, illetve 87 résztvevő). A táplálkozási ketózis csoport 1 év alatt javította a CVD kockázatának biomarkereit, beleértve a lipidprofil és az LDL részecskeméret javulását, csökkent vérnyomás és gyulladás
Máj steatosis (NAFLD)
A NAFLD-t - a metabolikus szindróma májmegnyilvánulását - a máj steatosis jellemzi más jól ismert májkárosodás hiányában, például túlzott alkoholfogyasztás, vírusfertőzés, autoimmun betegség vagy toxikus (pl. Gyógyszeres) sértések. A NAFLD a májbetegségek állapotainak széles spektrumát öleli fel, az egyszerű steatózistól az előrehaladott, fibrotikus májbetegségig. Az alkoholmentes steatohepatitis (NASH) a NAFLD egyik olyan formája, amelyet hepatocita ballonosodás, gyulladásos beszivárgás és a fibrózis különféle szakaszai jellemeznek, amelyek gyakran előrehaladott májbetegséghez (pl. Cirrhosis és hepatocellularis carcinoma) vezetnek. 56,57,62,74
Úgy gondolják, hogy a NAFLD az méhen kívüli máj lipidfelhalmozódásának negatív következménye az inzulinrezisztencia hátterében, amint azt fentebb említettük. 26,57,61 A steatosis - amelyet triglicerid-lerakódás jellemez a hepatocitákban - aláhúzza a szoros kapcsolatot a zsigeri zsírosság, a NAFLD és a szénhidráttal terhelt, magas zsírtartalmú nyugati étrend között. A zsigeri zsírlerakódás serkenti a gyulladásos citokin felszabadulást és a szisztémás inzulinrezisztenciát, a magas telített zsír- és egyszerű szénhidráttartalmú étrend pedig a zsír zsírsavainak a májba történő bejuttatásához vezet, serkenti a de novo lipogenezist, az oxidatív stresszt és a lipotoxicitást. 57,62
Egy kicsi, kéthetes klinikai vizsgálat 18 NAFLD-ben szenvedő alanyot randomizált szénhidráttartalmú étrend vagy korlátozott kalóriatartalmú étrend mellett, és a szénhidráttal korlátozott kar intra-máj trigliceridtartalmának nagyobb csökkenését tapasztalta. 75 Egy átfogóbb áttekintésben Yki-Jarvinen et al. értékelte a legutóbbi tanulmányokat, amelyek összehasonlították a különféle étrendek májzsír- és inzulinérzékenységre gyakorolt hatását, miközben szabályozták a kalóriatartalmat. Az eredmények nem voltak meggyőzőek, és a hipokaloros, alacsony szénhidráttartalmú ketogén étrendben a máj térfogatának csökkenését mutatták, összehasonlítva a szokásos étrenddel. Az izokaloros csoportok között azonban az alacsony zsírtartalmú, magas szénhidráttartalmú étrend (16–23% zsírtartalom, 57–65% szénhidrát) esetén a máj zsírtartalmának nagyobb csökkenését tapasztalták az alacsony szénhidráttartalmú, magas zsírtartalmú étrendekhez képest (43–23%). 55% zsír, 27–38% szénhidrát). 57 Fontos figyelmeztetés ezekre az eredményekre, hogy az alacsony szénhidráttartalmú csoport nem követett ketogén étrendet, ezért nem lenne ésszerű ezt az ellentmondó eredményt idő előtt az étrendi zsírbevitelnek tulajdonítani anélkül, hogy hasonló kísérletet végeznénk az izokalorikus táplálkozási ketózis értékelésével.
Az áttekintett tanulmányok többségét korlátozta a kis mintaméret és a követés rövid időtartama, ami megerősíti az étrend és a NAFLD összefüggését és annak hosszú távú klinikai vonatkozásait vizsgáló szakirodalom szűkösségét. Ezenkívül számos táplálkozási stratégia javulást mutatott a máj steatosisában, de egyesek egyidejűleg kedvezőtlen hatást mutattak a máj gyulladására és a fibrózisra. 26,61 Egy korábbi tanulmány olyan betegesen elhízott alanyokról, akik csökkent kalóriatartalmú étrendet kaptak, majd gasztroplasztikát végeztek, a máj zsírtartalmának csökkenését mutatta, amely a portális gyulladás és a fibrózis növekedésével járt együtt, amely feltételezések szerint összefüggésbe hozható a fogyás. 76 Ezzel szemben Weiner et al. biopsziával igazolt bizonyítékot mutat a steatosis, a gyulladás és a fibrózis javulására 284 kórosan elhízott bariatrikus műtétnél. Egyelőre nem világos, hogy a máj steatosisának javulása a fibrózis és az előrehaladott májbetegség csökkenését eredményezi-e.
KÖVETKEZTETÉS
Meggyőző bizonyíték áll rendelkezésre a táplálkozási ketózis használatáról a súly és a metabolikus szindróma összetevőinek kezelésére. Alternatív üzemanyagforrások, nevezetesen a ketonok felhasználásával kiaknázhatjuk a magas glükagon és az alacsony inzulinszint antagonista kapcsolatát, amelyek elősegítik a zsír üzemanyag-lebontását, az izmokban lévő glikogén megtakarítását és szükség szerint a de novo glükoneogenezist. További kutatásokra van szükség a VLCKD hosszú távú betartása és praktikussága szempontjából, de a jelenlegi eredmények ígéretesek a súlykezelés, a lipidprofilok és az inzulinérzékenység szempontjából.
Köszönetnyilvánítás:
A szerzők köszönetet mondanak Robin Noelnek az ábra grafikájának elkészítésében nyújtott technikai segítségért.
Lábjegyzetek
Az etikai irányelvek betartása
Összeférhetetlenség
Victoria M. Gershuni, Stephanie L. Yan és Valentina Medici kijelentik, hogy nincsenek összeférhetetlenségük.
Emberi és állati jogok és tájékozott beleegyezés
Ez a cikk nem tartalmaz olyan tanulmányokat emberekkel vagy állatokkal, amelyeket egyik szerző sem végzett.
- Tápanyagok szabad teljes szöveges aterogén index csökkentése és fogyás metabolikus szindrómás betegeknél
- Nutrigenetics, testsúly-szabályozás és étrend-kiegészítők táplálkozási kilátások
- A táplálkozási ajánlások, a súlykezelési előírások, a súly áttekintése és kommentálása
- A Keto-on új fogyókúrát biztosíthat gyorsan Tippek Shop - HazMat Management
- A Keto titkos fogyókúrás tablettákról fogyókúrás tabletták - HazMat kezelése