Hiperinzulinizmus és hiperammonémia szindróma: Tizenkét független beteg jelentése
Absztrakt
A hiperinsulinizmusról és a hyperammonemia szindrómáról beszámoltak, hogy a közepesen súlyos hiperinsulinizmus oka a hasnyálmirigy diffúz érintettsége. A rendellenességet a GLUD1 gén funkcionális mutációinak növekedése okozza, ami a guanozin-trifoszfát gátló hatásának csökkenését eredményezi a glutamát-dehidrogenáz (GDH) enzimre. Tizenkét, egymással nem rokon beteget (hat férfi, hat nő) hyperinsulinismusban és hyperammonemia szindrómában vizsgáltak. A fenotípusok klinikailag heterogének voltak, újszülöttkori és csecsemőkorban kezdődő hipoglikémiával, valamint az orvosi (diazoxid) és diétás (korlátozott leucintartalmú étrend) kezelésre adott reakcióképességgel. Hyperammonemia (90–200 μmol/l, normális
A hiperinzulinizmus a korai csecsemőkorban visszatérő hipoglikémia gyakori oka. Az inzulin szekréciójának állandó növekedése okozza (1, 2). Az inzulin szekréciója függ a B-sejtek ATP/ADP arányától, ami depolarizációt okoz, fokozza a Ca 2+ beáramlást és az inzulin exocitózisát. A glükóz és a leucin szabályozza az inzulin szekrécióját a glükamin glutaminolízisének szabályozásával (3), valamint a glükóz és a leucin GDH-ra gyakorolt közvetlen hatásával. A GDH egy mitokondriális enzim, amely a glutamátot α-ketoglutaráttá oxidálja, NAD és/vagy NADP kofaktorként (4–8).
A közelmúltban beszámoltak arról, hogy egy új szindróma, amely a hiperinsulinizmust és a hyperammonemiát társítja, a HHS, diffúz és mérsékelt hiperinsulinizmus okozója (9–11). Túlzott GDH (EC 1.4.1.3) aktivitást eredményez, amely a szabályozásának a GTP általi gátlásra való érzékenység csökkenése révén bekövetkező változásából ered. Felmerült, hogy a glutamát fokozott oxidációja α-ketoglutaráttá az ATP/ADP arány növelésével serkenti a hasnyálmirigy B sejtjeinek inzulinszekrécióját, bár ezt még kísérletileg nem kellett tesztelni. A glutamát túlzott oxidációja csökkentheti a N-acetil-glutamát a májban, ami nélkülözhetetlen lépés a karbamil-foszfát-szintáz I aktiválásában. Ez az enzim katalizálja az ammónia méregtelenítésének első lépését a karbamidciklusban. A GLUD1 gént 10q23,3-ra (12) térképeztük fel, és 13 exont tartalmaz, amelyek egy 505 aminosavból kiforrott enzimet kódolnak. A HHS-t okozó mutációkat a GLUD1 gén 11. és 12. exonjában azonosították (aminosav pozíciók 445–454) (10, 13). Újabban más mutációkat azonosítottak a 6. és 10. exonban (14, 15). Az összes vizsgált beteg heterogén volt ezen mutációk egyikében, a betegség szórványos formájával vagy a domináns öröklődés szerinti családi betegséggel.
Ez a jelentés 12 független, HHS-t kóros GDH okozta beteget ír le, és részletesen bemutatja a hipoglikémia és a hiperammonémia klinikai és biokémiai jellemzőit. Eredményeink egyértelműen azt mutatják, hogy a hiperinsulinémiás hipoglikémia klinikailag heterogén, újszülöttkori és csecsemőkorban kezdődő hipoglikémia, valamint az orvosi és diétás kezelésekre adott válaszreakció változó, amit a tenyésztett limfociták változó reakciókészsége igazol leucinra. Az orális karbamilglutamát nem normalizálta a vénás vér NH3-értékét. A mutációk a GTP-kötőhelyen belül és kívül egyaránt elhelyezkedtek, a fenotípus és a genotípus közötti összefüggés nélkül.
BETEGEK ÉS MÓDSZEREK
Intézményünkben 175 hiperinzulinémiás beteg sorozatát vizsgálták az elmúlt 20 évben. Ezen betegek közül 71-nél, 45 újszülöttnél és 26 csecsemőnél 1997 óta mértek plazma-ammónium-koncentrációt, 12 betegnél hyperammonemiát (> 50 μM) mutattak ki.
Leírták a hiperinsulinizmus diagnosztikai kritériumait és a hiperinsulinizmusban szenvedő betegek kezelését (16). A hyperammonemiás betegeket tovább vizsgálták. Minden beteg vénás plazma glükóz- és ammóniumszintjét minden étkezés előtt és után meghatározták. A méréseket akkor végeztük, amikor normál fehérjetartalmú étrendet alkalmaztak 72 órán keresztül, orális fehérje (2 g/kg) és leucin (150 mg/kg) terhelés után 48 órán keresztül négy betegnél, majd fehérje- és leucin-korlátozott étrend (2 g fehérje és 200 mg leucin étkezésenként) 72 óra alatt kilenc betegnél (1. táblázat).
Az artériás ammóniumszintet kilenc betegnél a vénás koncentrációval egy időben mértük.
Négy beteg szelektív hasnyálmirigy-vénás katéterezésen esett át (1., 2., 4. és 6. beteg) általános érzéstelenítésben, még mielőtt tudtunk volna a hyperammonemia létéről és okáról. A hasnyálmirigy-katéterezés során az 1. beteg portáljáról és májvénáiból vérmintákat gyűjtöttek, hogy összehasonlítsák a pre- és posthepaticus ammómiát (17). Ezt a beteget kurárral altatták a vázizom ellazítására, abban a hitben, hogy a hiperammonémia izom eredetű lehet. A vizelet karbamidját, a plazma aminosavakat és a vizelet szerves savait gázkromatográfiás tömegspektrometriával mértük.
A betegeknek orális karbamilglutamátot és nátrium-benzoátot adtak 0,5 g/kg mennyiségben, három adagra osztva 3 nap alatt. A vénás vércukorszintet és az ammóniumot mértük e gyógyszerek minden egyes bevétele előtt.
Máj ornitin-transzkarbamiláz, N-acetil-glutamát-szintetázt és glutamin-szintetáz aktivitást mértek az 1. és 5. betegnél.
A GDH aktivitását limfoblaszt homogenizátumokban és az ADP vagy GTP hozzáadásának hatását spektrofotometriásan határoztuk meg a Stanley protokollja szerint et al.(10) A GLUD1 cDNS-t megfordítottuk átírva a lymphoblast mRNS-ből, és a PCR-rel amplifikáltuk Stanley szerint et al.(10) A mutációk keresése céljából a GLUD1 cDNS-t szekvenáltuk. Az eredmények három-öt meghatározás átlag ± SEM-je. A statisztikai összehasonlításokat nem-paraméteres Mann-Whitney-teszt alkalmazásával végeztük. A o érték
EREDMÉNYEK
Hiperinzulinémiás hipoglikémia.
A HHS-ben szenvedő betegek klinikai jellemzőit az 1. táblázat foglalja össze. Valamennyi betegnél (hat férfi és hat nő) egy kivételével (11. beteg) nem rokon szülők voltak. Az 1. beteg anyai nagynénje csecsemőkorában hiperinsulinizmustól szenvedett. A 6. beteg anyja leucin-érzékeny hipoglikémiában szenvedett, amelyet 11 hónapos korában diagnosztizáltak. Fehérjeszegény étrenddel kezelték 9 éves koráig, amikor azt hitték, hogy spontán felépült. Értelmi fejlődése jelenleg normális. A többi betegnél a családban nem volt hipoglikémia. A 2. páciens apja hasnyálmirigy-karcinómában halt meg 43 éves korában, előzetes hipoglikémia nélkül.
Valamennyi beteg teljes idő alatt született, és csak négy beteg volt makroszóma a születéskor (1. táblázat). A hipoglikémia négy esetben az élet első 3 napján kezdődött, a többi esetben később csecsemőkorban. A roham volt a hipoglikémia tünete a legtöbb betegben. Tíz betegnél folyamatos orális vagy iv. glükóz, hogy a plazma glükóz> 3 mmol/l legyen. A glükóz beadásának átlagos sebessége azonban csak 11,7 mg/kg/perc volt, és egyetlen betegnek sem volt szüksége iv. glükagon a glükóz mellett. Kilenc beteg volt teljesen érzékeny a diazoxidra, egy diazoxid-rezisztens volt (6. beteg), kettőnek pedig a diazoxid mellett kukoricakeményítőre volt szüksége (1. és 8. beteg). A korlátozott leucinszintű étrend (200 mg/étkezés) öt esetben (1., 4., 5., 6., 10. beteg) megfelelően kontrollálta a hipoglikémiát, a plazma glükózszintjét> 3 mmol/l szinten tartva, miközben a betegeket normál időközönként etették, és nem kaptak iv glükóz vagy bármely más gyógyszer legalább öt egymást követő napon keresztül. Négy esetben hatástalan volt (3., 7., 8., 11. beteg). A leucin-korlátozott étrendre érzékeny betegek közül négynek orális leucin-terhelést adtak, és a terhelés után 1 órával hiperinsulinémiás hipoglikémiában szenvedtek. Ez utóbbi betegeknek nem adtak orális leucinterhelést a súlyos hipoglikémia potenciális kockázata miatt.
Összességében egy kivételével minden beteget (6. beteg) sikeresen orvosilag kezeltek diazoxiddal, leucin-korlátozott étrenddel és/vagy kukoricakeményítővel. A 6. betegnek, akit a HHS leírása előtt diagnosztizáltak, hasnyálmirigy-reszekción esett át, beleértve a hasnyálmirigy farkát és testét. A preoperatív hasnyálmirigy-vénás katéterezés magas inzulinszintet mutatott az egész hasnyálmirigyben. Szövettani vizsgálata megerősítette, hogy a hiperinzulinizmus diffúz, de az elváltozás szokatlan volt a szalagmintákba rendezett hipertrófiás szigeti sejteknél. A műtét után a páciensnek még mindig hipoglikémiája volt, de leucin-korlátozott étrenddel sikeresen kezelték. A három másik betegnél (1., 2. és 10. beteg), akiknél hasnyálmirigy-katéterezést végeztek, az egész hasnyálmirigyben diffúz inzulin szekréció volt látható, és nem operálták őket.
Hyperammonemia és metabolikus vizsgálatok.
Hiperammonémiát a hipoglikémia előtt fedeztek fel az 1. és az 5. páciensben, míg utólag a többi páciensnél, akinél korábban hiperinzulinizmust diagnosztizáltak. A hyperammonemia jellemzőit a 2. táblázat foglalja össze.
A vénás plazma ammónia koncentrációja minden betegnél kissé megnőtt (90–200 μmol/L, normál 50 μmol/L) az összes vizsgált betegben, kivéve az 1. beteget (artériás ammónia 36–40 μmol/L, perifériás vénás ammónia 150 μmol/L). Ennek a betegnek az ammónia koncentrációja megemelkedett a portális vénában (111–132 μmol/L), de a subhepatikus vénákban normál értékek voltak (38–41 μmol/L) a hasnyálmirigy katéterezése során (17).
A plazma glutamin és a vizelet alfa-ketoglutarát koncentrációja változó volt (2. táblázat), míg a plazma arginin, a vizelet karbamid és az orotsav koncentrációja minden vizsgált betegben normális volt. Máj ornitin-transzkarbamiláz és N-az acetil-glutamát-szintáz (1. és 5. beteg) és a glutamin-szintáz (1. beteg) aktivitása normális volt.
Glutamát-dehidrogenáz.
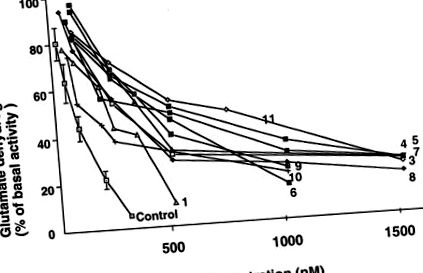
A 12 betegből 10-ben a GDH aktivitását és alloszterikus válaszait a lymphoblastokban a 2. táblázat mutatja. Valamennyi vizsgált beteg normális bazális GDH aktivitással rendelkezett. A GTP IC50-értéke 70–600% -kal magasabb volt, mint a kontrolloké, összhangban a GDH túlzott aktivitásával (1. ábra). Az ADP általi aktiválás alloszterikus hatása normális volt. Az 1 mM leucin hatása a GDH aktivitására a betegek körében változó volt (2. ábra). Jelentősen csökkent a GDH érzékenysége a leucin általi aktiválásra a 4., 7., 8. és 10. betegeknél.
A GTP hatása a HHS-ben szenvedő betegek és normál alanyok lymphoblastjainak GDH-aktivitására. Basal GDH aktivitások a betegek számára (n = 10) és a kontrollok (n = 9), nmol/perc/mg fehérje értékben kifejezve, a 2. táblázatban mutatjuk be. Az ID50 értékeket grafikusan határoztuk meg, és a 2. táblázatban mutatjuk be.
A GDH gén molekuláris elemzése azt mutatta, hogy négy beteg heterozigóta volt egy missense mutációval szemben a 11. exonban (1., 8., 9., 11. páciens), kettő pedig az enzim antennarégiójában (3., 12. páciens) a 12. exonban (2. táblázat). ). Négy másik betegnél (1., 5. és 7. beteg) heterozigóta mutáció volt a 6. és 7. exonban a GTP-kötőhelyen (18). A gén 5–13 exonjának szekvenálása után a 10. beteg esetében eddig nem találtak mutációt. A legtöbb vizsgált betegnél egy mutáns és egy vad típusú allél volt, összhangban a mutációk domináns expressziójával. A betegek szüleitől származó minták nem álltak rendelkezésre mutációelemzéshez.
VITA
Itt 12 HHS-ben szenvedő beteg jellemzőit közöljük. Ezek közül az enzimatikus és molekuláris vizsgálatokon átesett betegek közül tíznek rendellenes glutamát-dehidrogenáz-aktivitása volt, ami alátámasztotta azt az elgondolást, hogy a GHS változás a HHS oka. Stanley szerint et al.(1), és ellentétben áll Yorifuji-val et al.(14), a GDH enzim érzékenysége a GTP gátlására csökkent, bár az alapaktivitása normális volt, ami összhangban van a túlaktivitásával in vivo. Heterozigóta mutációkat találtak a GLUD1 génben, egy kivételével minden betegnél. Ezek a mutációk az enzim antennarégiójában hat betegnél, a GTP kötőhelyén pedig négy betegnél helyezkedtek el. A 6. és 7. exon által kódolt GTP-kötőhely mutációit Miki is leírta et al.(15) és Santer et al.(19) Nem találtunk fenotípus-genotípus összefüggést a mutációk helye szerint (15). A mutációk mind a GTP-kötő, mind az antenna régióban összefüggésbe hozhatók az újszülöttkori és csecsemőkori hypoglykaemia kialakulásával, valamint a diazoxiddal szembeni változó reakciókészséggel. Ugyanígy a GDH összehasonlítható túlaktivitását találtuk azoknál az egyéneknél, akiknél mindkét mutáció helye volt.
Bár a leucin közvetlenül szabályozza az inzulin szekrécióját azáltal, hogy egy külön leucint kötő alloszterikus helyre hat a GDH-n (8), meglepő módon az 1 mM leucin hatása a lymphoblast GDH aktivitására a betegek között változó volt (2. ábra). A limfoblaszt GDH aktivitása a 4., 7., 8. és 10. betegekben csökkent a leucinra adott válaszként. Ezen betegek GLUD1 génjének mutációi a 11. és 12., valamint a 6. és 7. exonon helyezkedtek el. Ezek a megállapítások nem támasztják alá azt az elgondolást, hogy a leucinnal korlátozott étrend folyamatosan hatékony a HHS plazma glükózszintjén (9, 20, 21).
Míg a hipoglikémia a megnövekedett B-sejt ATP/ADP arány következménye, mivel csökkenti a GDH GTP alloszterikus gátlására való érzékenységet, a hiperammonémia mechanizmusa még nem tisztázott. Valamennyi vizsgált beteg normális vizeletkiválasztási és vizeletciklus-enzim aktivitást mutatott. Ugyanígy a vénás ammónia sem függ az étrendi fehérjebeviteltől, és nem csökkent a nátrium-benzoátra adott válaszként, ami arra utal, hogy az ammóniát a máj méregtelenítette. Még érdekesebb, N-karbamilglutamát, annak analógja N-Az acetil-glutamát, a karbamid ciklus természetes alloszterikus aktivátora egyetlen betegnél sem normalizálta a vénás ammóniát, ami azt a hipotézist állítja, hogy a hiperammonémiát a csökkent N-acetilglutamát szintézise a májban. Végül az 1. betegben, akinek GLUD1 mutációja van a 7. exonban, a perifériás vénás vér ammónia szintje normalizálódott a kurarizáció során, artériás ammónia pedig normális volt. Ez arra utal, hogy az izomlazítás csökkentette a keringő ammónia koncentrációját, és hogy a hyperammonemia perifériás izom eredetű lehet (17).
Összegzésként elmondható, hogy a szérum ammónia koncentrációját meg kell mérni minden hiperinsulinizmus miatt vizsgált betegnél, mert a kezelés, az utánkövetés és a genetikai tanácsadás radikálisan eltér egymástól. Ezzel szemben hipoglikémiát kell keresni bizonytalan etiológiájú hiperammonémiában szenvedő betegeknél. A Santer által nemrégiben leírt kérdés, hogy a hiperammonémia nélküli mérsékelt hiperinzulinizmus a GDH rendellenesség következménye lehet-e et al.(19), még tisztázandó, különösen azoknál a betegeknél, akik leucin-érzékeny hiperinsulinizmusban szenvednek. Végül, ha a GDH mutáció glükóz metabolizmusra gyakorolt következményei egyértelműen összefüggenek a nem megfelelő inzulin szekrécióval, a GDH mutáció következményei az ammónia anyagcseréjére még nem tisztázottak.
Rövidítések
hiperinsulinizmus és hyperammonemia szindróma
- JFMK Free Full-Text A testmozgás és a kinesiószalag hatása a betegek fizikai korlátozására
- IJMS szabad teljes szövegű bél mikrobiota által közvetített gyulladás és béláteresztő képesség betegeknél
- Köszvény Rochester klinikai kutatás
- Végzős bizonyítvány gyermekgyógyászati táplálkozásról - Robert Stempel Közegészségügyi Főiskola; Szociális munka
- Journal of Obesity and Diabetes (ISSN 2638-812X) Biliáris diszkinézia Kutatási cikkek epehólyag