A benne rejlő versus indukált fehérje rugalmasság: összehasonlítás az apo és a holo struktúrákon belül és között
Jordan J. Clark
1 Gyógyszerkémiai Tanszék, Michigani Egyetem, Ann Arbor, Michigan, Amerikai Egyesült Államok
Mark L. Benson
2 Számítógépes Orvostudományi és Bioinformatikai Tanszék, Michigani Egyetem, Ann Arbor, Michigan, Amerikai Egyesült Államok
Richard D. Smith
1 Gyógyszerkémiai Tanszék, Michigani Egyetem, Ann Arbor, Michigan, Amerikai Egyesült Államok
Heather A. Carlson
1 Gyógyszerkémiai Tanszék, Michigani Egyetem, Ann Arbor, Michigan, Amerikai Egyesült Államok
2 Számítógépes Orvostudományi és Bioinformatikai Tanszék, Michigani Egyetem, Ann Arbor, Michigan, Amerikai Egyesült Államok
Társított adatok
Minden szerkezeti fájl szabadon elérhető a Protein Data Bank-ból. A vizsgálatban használt struktúrákat kifejezetten felsorolják a kiegészítő információk (S1 táblázat).
Absztrakt
Szerző összefoglalása
Itt megvizsgáljuk, hogy a ligandumkötés hogyan befolyásolja a fehérje rugalmasságát, több mint 4000 kristályszerkezet elemzésével, ami nagyságrenddel több, mint az apo-holo párokon alapuló korábbi vizsgálatok. Az irodalomban vita folyik arról, hogy a fehérjékben milyen rugalmas kötődési helyek vannak. Azok a tanulmányok, amelyek arra a következtetésre jutnak, hogy a ligandum kötődésénél kevés a mozgás, általában a gerincoszlop RMSD-jét mérik, de a nagyobb konformációs változást mutató tanulmányok az oldallánc-orientációkra alapozzák elemzéseiket. Ezen tanulmányok egyike sem használta ugyanazokat a fehérjéket, ezért nem világos, hogy a különböző következtetések mennyiben következnek be a választott elemzések és a felhasznált különböző adatkészletek függvényében. Ezenkívül számos tanulmány apo-holo párokat használt a fehérjék konformációs változásának mérésére, de egyik sem vizsgálta az apo és a holo állapotok sajátos rugalmasságát. Az apo-holo párban észlelt indukált változást annak összefüggésében kell elhelyezni, hogy az apo és a holo állapot mennyire változó. Elemzéseink összeegyeztetnek minden létező vitát azzal, hogy megerősítik a gerincek és az oldalláncok eredendően eltérő viselkedését, ahol a gerincek általában nagyon kevés konformációs teret vesznek mintát, és az oldalláncok a ligandum megkötésekor gyakran új konformációkba szorulnak.
Bevezetés
A fehérjék természetes rugalmasságú biopolimerek, amelyek aminosavakból állnak, nagyrészt nem kovalens struktúrába hajtva. [1] A rugalmasság mértéke gyakran szorosan kapcsolódik a fehérje működéséhez, különösen az enzimek esetében. A fehérjék rugalmasságának megértése fontos a fehérje hajtogatásában, a fehérjetervezésben és a racionális gyógyszertervezésben.
A fehérje-ligandum kötőhelyek egyik fő jellemzője, hogy mind jellegzetesen merev, mind rugalmas maradványokkal rendelkeznek. [2, 3] A merevség elősegítheti a ligandum kötődésének specifitását és szorosságát, míg a rugalmasság lehetővé teszi a ligandumok bejutását a kötési helyre, és emellett részt kell vennie az alloszterikus és ortoszterikus kötőhelyek közötti kommunikációban. A kötőhelyek közelében lévő maradékok csoportjait gyakran figyeljük meg feszült konformációkban. [4, 5] A ligandkötésről kiderült, hogy ezekben a maradékokban törzs indukálódik, és feltételezték, hogy a belső energia emelését a fehérje felhasználhatja a katalízishez és a ligandum egy aktív helyről.
Az indukált változások teljes körű figyelembevétele különösen fontos a fehérje-ligand dokkolásban. A dokkolás nagyon nehéznek bizonyul a gyakorlatban, amikor konformációs változások következnek be a megkötéskor. [6, 7] A keresztdokkolási probléma szemlélteti a fehérje rugalmasságának elszámolásának nehézségeit a ligandumkötésben. Keresztdokkolási kísérletek megkísérlik egy ligandum kikötését egy kristályszerkezetről ugyanazon fehérje másik szerkezetének kötési helyére, de a kutatások azt mutatják, hogy sok ligandum nem illeszkedik, hacsak a fehérjét nem hagyják alkalmazkodni a ligandumhoz. [8–11] Minél nagyobb a szükséges beállítás, annál nehezebb pontosan megjósolni a fehérje-ligandum kötődését. [12] A fehérje-ligandum kötődés pontos ábrázolásához be kell építeni a fehérje rugalmasságát.
Amint az alábbiakban vázoljuk, számos tanulmányban megvizsgálták a ligandumkötés mértékét és tulajdonságait apo és holo fehérje kristályszerkezetek összehasonlításával. Számos tanulmány megvizsgálta megkötőhelyeik helyi jellemzőit, például az oldallánc rugalmasságát vagy az oldószerrel elérhető felületet (SASA), míg egyes tanulmányok csak a globális fehérje változásokat vizsgálták a ligandum megkötésekor. A legtöbb vizsgálat elemzése két kategóriába esett: a gerincatomok gyökér négyzet deviációs (RMSD) számításai vagy az aminosav oldalláncok rotamer elemzése. Ezek a különböző megközelítések ellentmondásos következtetésekhez vezettek, amelyeket tanulmányunk segít összeegyeztetni. Az alábbiakban összefoglaljuk az eddigi legjelentősebb megállapításokat.
Gerincelemzés
A szerkezeti variáció csekélynek tűnik, ha a gerinc mozgásával értékeljük. Gutteridge és Thornton megállapította, hogy az enzimek a szubsztráthoz vagy a termékhez kötődő 11 fehérjét (11 apo, 14 holo) tartalmazó kis adatkészletükben általában strukturálisabban hasonlítanak egymásra, mint a szabad enzimre (a szubsztráthoz kötött és a termékhez kötött struktúrák átlagos Cα RMSD értéke 0,36 Å, míg az apo enzimek átlagosan 0,75 Å RMSD-értéket mutatnak a szubsztrát struktúrákra és 0,69 Å RMSD-t a termék szerkezetére). [13]
Gutteridge és Thornton a fentiekben említett munkájukat követve konformációs változásokat kerestek a ligandum megkötésekor egy nagyobb struktúrában. 60 enzim vizsgálatában,
A holo-apo párok 75% -ának Cα RMSD értéke ≤ 1 Å. Ezt az RMSD-t szembeállították az Apo-apo fehérjepárok között megfigyelt Cα RMSD-vel, mint alapértékkel, ahol
A 31 apo-apo pár 83% -ának Cα RMSD értéke ≤ 1 Å. [14]
Gunasekaran és Nussinov 98 fehérjét három kategóriába sorolt a holo és apo szerkezetek közötti maximális Cα elmozdulás alapján: merev fehérjék (≤ 0,5 Å), mérsékeltek (0,5 Å 2 Å). [15] Valamennyi osztálynak azonos volt az érintkezési sűrűsége, így bizonyos szermaradványok rugalmasságát nem a laza csomagolás okozta. A merev és mérsékelten hajlékony fehérjék polárpolárisabb kölcsönhatásokat tapasztaltak: 35% és 34% a merev és mérsékelten rugalmas, míg 28% a rugalmas fehérjék esetében. Összességében a legtöbb φ és ψ változás apo és holo között minimális volt. Valamennyi osztályban volt néhány kötőhely-maradvány with és ψ szöggel a Ramachandran térkép szegény régióiban. Több volt az apo, mint a holo szerkezetekben, és hajlamosak voltak a kötési hely közelében összegyűlni. Továbbá nem találtak figyelemre méltó különbséget a SASA-ban a kötési helyek három osztályozásának (merev, közepesen rugalmas és nagyon rugalmas) kötési hely maradványai között. [15]
Brylinski és Skolnick megállapította, hogy a legtöbb apo-holo fehérjepár nem mutatott szignifikáns szerkezeti különbséget, és hogy a holo-holo fehérjepárok még kevésbé változtak, a Cα RMSD metrika segítségével. [16] 521 egydoménes apo-holo szerkezeti pár esetében 80% -uk RMSD-értéke ≤ 1 Å, és az egydoménes holo-holo párok halmaza között,
92% -uk RMSD-értéke ≤ 1 Å.
Marks és mtsai. megállapította, hogy a hurokfragmensek hossza a szekvencia-azonos fehérjeszerkezetek együtteseiben pozitívan korrelált azzal a valószínűséggel, hogy azok a hurkok bizonyítják a magas strukturális variációkat (lokalizált gerinc RMSD> 2Å). [17] A nagy strukturális eltérések kimutatásának valószínűsége azonban viszonylag alacsony volt, még hosszabb ciklusokban is (mintavételezett 20 szermaradék-hurkok 3,85% -a). Ez az adatkészlet 5548 egyedi fehérjeszekvenciát tartalmazott, amelyek esetében legalább két röntgenkristály-szerkezet volt jelen a PDB-ben, 2,0 Å vagy nagyobb felbontással.
Qi és Hayward 203 enzimkészletet vizsgáltak doménpárokból álló szerkezetekkel, funkcionális ligandumokkal és anélkül is. [18] Ezekben a doménpárokban lévő ligandumokat két csoportra osztottuk annak alapján, hogy mindkét doméntől 4Å-en belül (150 ligandum) vagy csak egy doménen (53 ligandum) voltak-e. Megállapították, hogy a kettős doménnel érintkező ligandumok gyakran (84%) érintkeztek a „kiterjesztett hajlítási régióval” (az annotált domének között jelenlévő maradványok és az egyes annotált doménekben három maradék). Ezzel szemben az egy doménnel érintkező ligandumok ritkán (13%) érintkeztek azzal a kiterjesztett hajlítási régióval. Ez azt jelzi, hogy azok a ligandumok, amelyek kötődési eseményükön keresztül váltanak ki doménmozgásokat, és nem lépnek kapcsolatba mindkét doménnel (nem átívelő trigger-ligandumok), ritkán kötődnek a két fehérje domén közötti hajlítási régió közvetlen közelében. A tanulmány szerzői azonban megjegyezték, hogy munkájuk terjedelme a nagy kiterjedésű „domain mozgásokra” korlátozódik, amint azt az általuk használt forrásanyag megjegyzi.
Amemiya és mtsai. létrehozta a Protein Structural Change DataBase (PSCDB) [19, 20], amely nagyobb léptékű fehérje konformációs változásokra összpontosít, hasonlóan Qi és Hayward korábban említett munkájához. A PSCDB lefedettsége meghaladja a tartomány mozgását, a tartományok helyi alkomponenseire, de nem a maradék szintű mozgásokra. A fehérje mozgásainak bemutatását a domén alkomponensek atomkiszorításával és lineáris válaszelméletével hajtják végre, 839 apo-holo fehérjepárt tartalmazó adatkészlet felhasználásával. Adatkészletükön csak fehérjéik 7% -a mutatott doménmozgást, közvetlenül kapcsolódva ligandumkötéshez, 15% -a mutatott helyi (szubdomén) mozgást, közvetlenül kapcsolódva ligandumkötéshez, és 39% -uk nem mutatott szignifikáns mozgást az apo és a holo állapot között.
Fradera és mtsai. megállapította, hogy a kötési hely szerkezete megőrződik a ligandum megkötésekor, amit bizonyít az a tény, hogy az átlagos összes atom, a kötőhely RMSD értéke ≤ 1 Å, és hogy a ligandummal érintkező atomok több mint 90% -a kevesebb, mint 1 Å, és hogy a legtöbb kötőhelynek csak szerény változásai voltak elektrosztatikus potenciáljukban. [21] Megállapították azonban, hogy ezek a kis mozgások jelentős térfogat- és alakváltozásokat képesek kiváltani, így a térfogat-hasonlósági indexek (η) 0,44 és 0,90 között mozognak. A geometriai hasonlósági mutatók eltérése rámutat arra, hogy más elemzési módokra van szükség az RMSD kíséretében. Ezek az eredmények arra utalnak, hogy a gerinc elmozdulásának apró változásai az oldallánc konformációs térének nagymértékű rendelkezésre állását eredményezhetik.
Oldallánc elemzés
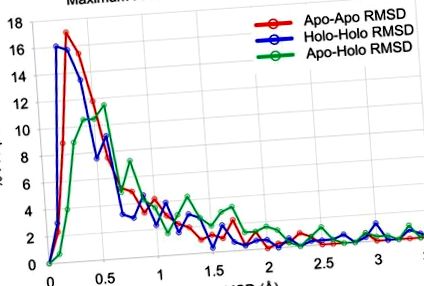
Az apo-apo párok adatai piros színnel, a holo-holo párok kék színnel, az apo-holo párok pedig zöld színnel jelennek meg. Nincs statisztikai szignifikancia az apo-apo és a holo-holo adatok különbségében (p> 0,05, mediánok különbsége = 0,025 Å). Az apo-holo adatok és az apo-apo adatok közötti különbség szignifikáns (p 2 Å, a családok 6% -ánál holo-holo RMSD> 2 Å, és a családok 10% -ánál apo-holo RMSD> 2 Å. aláhúzza a fehérjecsaládok legalább 90% -ának viszonylag alacsony konformációs rugalmasságát.
Minden pont az egy fehérjecsaládban megfigyelt maximumokat jelöli, és az egyes szakaszok pontjainak száma fekete színnel van jelölve (a zárójelben lévő számok> 3,5 Å értékű pontok). A) Az apo-apo párok közötti maximumot összehasonlítjuk a holo-holo párok maximumával; 207 fehérje RMSD értéke ≤ 1 Å mindkét csoport esetében. B) Az apo-holo párok közötti maximumot összehasonlítjuk az apo-apo párok maximumával; 201 fehérje RMSD értéke ≤ 1 Å mindkét csoport esetében. C) Az apo-holo párok közötti maximumot összehasonlítjuk a holo-holo párok maximumával; 201 fehérje RMSD értéke ≤ 1 Å mindkét csoport esetében. A családi adatpontokat az apo + holo szerkezetek száma a családban színezi: a fekete 4 szerkezetű (67 család 2 apo és 2 holo szerkezettel), a lila 5–14 (184 család), a kék 15–30 szerkezetű (32 család) és a zöldnek> 30 szerkezete van (22 család).
Asztal 1
| Apo-Apo párok | 0,86 | 0,45 |
| Holo-Holo párok | 0,72 | 0,43 |
| Apo-Holo párok | 1.16 | 0,69 |
Az Apo struktúrák és a holo struktúrák hasonló konformációs variációval rendelkeznek az egyes fehérjék maximális apo RMSD-jének és a maximális Holo RMSD-k összehasonlításán alapulva (1. és 1. és 2.A ábra). 2A. A fehérjék általában ugyanolyan konformációs rugalmassággal rendelkeznek az apo és a holo állapotokon belül. A fehérjék apo-struktúráinak csak 10% -a mutat szignifikánsan nagyobb gerinchajlékonyságot, mint holo struktúrájú társaik, és a fehérjék holo struktúráinak 12% -a szignifikánsan nagyobb gerincrugalmasságot mutat, mint apo struktúra társai (31 apo család, 39 holo család). 28 olyan család volt, ahol az Apo és a Holo maximális RMSD értéke> 1 Å, ami azt jelzi, hogy mindkét kötési állapot viszonylag rugalmas. Az apo és a holo szerkezetek maximális gerinc RMSD értéke egyaránt 0,05 volt (lásd Módszerek).
Amint az várható volt, nagyobb eltérés tapasztalható az apo-holo párok között (ábra (1. és 2.B és 2C. Ábra). Az apo-apo és holo-holo párokhoz képest a fehérjék 15% -ának (45 fehérjecsalád) szignifikánsan nagyobb konformációs tér áll a gerincükhöz rendelkezésre a kötetlen és kötött állapot (apo-holo párok) között, akár az apo (1B ábra), akár a holo (1C ábra) állapotokhoz képest. Fontos, hogy ez a 45 fehérjecsalád nem teljesen felesleges a két esetben csak 14 fehérjét osztanak meg abban a 45-ben.
Az összes fehérje RMSD-méréseit elemezve az apo-fehérjék rendelkezésére álló konformációs tér mennyisége nem különbözik szignifikánsan a holo-fehérjékétől (p> 0,05) (1. ábra (1 és 2A, 2A, 1. táblázat). az apo és a holo struktúrák közötti konformációs tér mennyisége nagyobb, mint bármelyik apo-n belül (p (1. és 2.B ábra és 2C. ábra, 1. táblázat). Ez arra utal, hogy az apo és a holo adatkészletek mindegyikének gerince azonos méretű alcsoportokat foglal el A rendelkezésre álló teljes konformációs tér, és nagy átfedés van a két halmaz között: Bár statisztikailag szignifikáns, az apo struktúrákban 0,86 Å RMSD, a holo szerkezetekben 0,72 Å RMSD és az összes szerkezet között 1,16 Å RMSD különbség kisebb, mint 0,5 Å RMSD változás. Ez egy teljes fehérje-struktúra összefüggésében valószínűleg elhanyagolható, és közel van a kísérleti hibához, mivel a legtöbb gerincatom atomjának B-faktorai vannak.
Az alacsony globális RMSD-mérés nagyon kevés maradványban képes elfedni a nagy elmozdulásokat. Ezért az RMSD értékeket kifejezetten az egyesített kötési helyeken levő atomokra is kiszámolták, hogy a ligandumkötés során bekövetkező lokalizált változásokra összpontosítsanak. A kötődési hely gerincének elmozdulása valamivel nagyobb, mint az egész gerinc (2. táblázat). Az RMSD család és típus szerinti megoszlása azonban nagymértékben változatlan (S1A, S1B és S1C ábra a támogató információkban). Ezeket az eredményeket mind az apo, mind a holo struktúra részhalmazokra (S1D és S1E ábra) megfigyeltük a támogató információkban.
- Házi fehérjetartók 5 fehérjés rúd, amelyet otthon könnyen elkészíthetünk Hogyan készítsünk fehérjetartókat otthon
- Hogyan lehet javítani a fehérje felszívódást a test egészségében Luke Coutinho edzőnek van válasza
- Mézes mustár dupla falatú fehérje snack - SlimGenics-Direct
- Fokozott rugalmasság; Oxycise!
- Megnövekedett testtömeg-növekedés és testfehérje a kasztrált és adrenalektomizált patkányokban