A Canephron® N biztonságossága a húgyúti fertőzések kezelésében a terhesség első trimeszterében
Absztrakt
Háttér
A húgyúti fertőzések (UTI-k) a leggyakrabban előforduló bakteriális fertőzések közé tartoznak, különösen terhes nőknél. A Canephron® N (Bionorica, Németország) olyan fitoterápiás gyógyszer, amely pleiotróf hatással van a húgyúti rendszerre, beleértve a vizelethajtó, görcsoldó, gyulladáscsökkentő, antimikrobiális és nephroprotektív hatásokat. Ennek a retrospektív vizsgálatnak az volt a célja, hogy felmérje a Canephron® N biztonságosságát, amikor a terhesség első trimeszterében húgyúti fertőzések kezelésére használják.
Mód
Ez egy retrospektív, több központból álló vizsgálat volt, amely 384 olyan nőnél értékelte a Canephron® N hatását, akik a terhesség első trimeszterében (2004 és 2009 között) a gyógynövényes gyógyszert használták, és akiknek terhessége élve született. Az ebben a vizsgálatban értékelt végpontok az újszülött veleszületett rendellenességeinek jelenléte voltak.
Eredmények
Nem voltak szignifikáns különbségek a veleszületett rendellenességek előfordulási gyakoriságában azoknál az újszülötteknél, akiknek anyja a terhesség első trimeszterében szedte a Canephron® N-t, összehasonlítva a kijevi népességre vonatkozó azonos statisztikai adatokkal. Az újszülöttek többségének (> 65%), akiknek anyja a terhesség első trimeszterében kapta a Canephron® N-t, Apgar-pontszáma 8 vagy annál magasabb volt, ami kiváló biztonsági állapotot jelez.
Következtetések
Vizsgálatunk eredményei azt mutatják, hogy a Canephron® N alkalmazása a terhesség első trimeszterében nem társult semmilyen teratogén, embriotoxikus vagy fetotoxikus hatással a magzatra.
Háttér
A húgyúti fertőzések (UTI-k) a leggyakrabban előforduló bakteriális fertőzések közé tartoznak, különösen terhes nőknél. A terhesség a húgyutak specifikus fiziológiai, strukturális és funkcionális változásaival jár, amelyek megkönnyítik a baktériumok szaporodását és az emelkedő fertőzéseket [1]. A nők 5-10% -a UTI-t tapasztal terhesség alatt, általában tünetmentes bakteriuria, akut cystitis és pyelonephritis [2]. Az UTI-k többségét enterális eredetű baktériumfajok okozzák, nevezetesen Escherichia coli, amely az esetek 70–85% -át teszi ki [3], valamint Klebsiella pneumoniae, Staphylococcus aureus és a B csoportú streptococcusok [4–6]. Megfelelő kezelés nélkül ezek a fertőzések súlyos következményekkel járhatnak az anyára és a magzatra, növelve a preeklampszia, a koraszülés és az alacsony újszülöttkori születési súly kockázatát [1].
Az antibiotikumokat gyakran írják fel a húgyúti fertőzések kezelésére terhes nőknél. A terhesség alatti megváltozott gyógyszer farmakokinetika és a placenta gáton történő gyógyszerátadás lehetősége miatt az antibiotikumok terhesség alatti használatát körültekintően kell kezelni [7, 8]. Potenciális teratogén hatásuk miatt egyes antibiotikumok alkalmatlanok terhes nőknél történő alkalmazásra [9]. A terhesség alatt biztonságosnak tartott antimikrobiális szerek a β-laktám osztályba tartoznak, beleértve a penicillineket, a cefalosporinokat és a foszfomicin-trometamolt [6, 10]. Mindazonáltal az antibiotikumok alkalmazása általában mellékhatásokkal jár, beleértve az allergiás reakciókat, a gyomor-bélrendszeri mellékhatásokat és a szívritmuszavart [11, 12], ezeket a terhesség alatt a legnagyobb körültekintéssel kell alkalmazni. Ezenkívül a terhesség alatt biztonságosan alkalmazható antimikrobiális szerek számát tovább korlátozza a gyógyszerrezisztencia megjelenése a különféle baktériumfajok között [6, 13]. Ezért alternatív kezelési módokra van szükség a terhesség alatt fellépő UTI-k kezelésére.
A Canephron® N (Bionorica, Németország) fitoterápiás gyógyszer, amely centaury gyógynövény rögzített kombinációjából áll (Centaurium sp.), lovage gyökér (Levisticum officinale Koch) és rozmaring levelek (Rosmarinus officinalis L.). A gyógyszerben jelenlévő növényi komponensekről kiderült, hogy pleiotróf hatással vannak a vizeletrendszerre, beleértve a vizelethajtót [14, 15], a spasmolyticát [16, 17], a gyulladáscsökkentőt [18–20], az antimikrobiálisot [21–24] és nefroprotektív hatások [25]. A klinikai adatok terápiás előnyöket mutattak ki UTI-ben, nephrolithiasisban vagy urolithiasisban szenvedő betegeknél [26, 27]. A Canephron® N több mint 40 éve elérhető az európai piacon, és hagyományos növényi gyógyszerként van bejegyezve, de terhesség és szoptatás alatt jelenleg nincs engedélye. Az Európai Unión (EU) kívül azonban ez az egyik leggyakrabban felírt fitoterápiás gyógyszer terhes nőknél a felső és az alsó húgyúti fertőzések kezelésére. Bár a terhes nőkön végzett klinikai vizsgálatok bebizonyították, hogy a Canephron® N biztonságos és jól tolerálható, egyelőre egyetlen tanulmány sem foglalkozott kifejezetten annak biztonságossági szempontjaival, amikor a terhesség első trimeszterében alkalmazták.
Ennek a retrospektív vizsgálatnak az volt a célja, hogy felmérje a Canephron® N biztonságosságát, amikor a terhesség első trimeszterében húgyúti fertőzések kezelésére használják. A vizsgálat fő végpontja az újszülött veleszületett rendellenességeinek jelenléte volt.
Mód
Dizájnt tanulni
Ez egy retrospektív, több központból álló vizsgálat volt, amely 384 olyan nőnél értékelte a Canephron® N hatását, akik a terhesség első trimeszterében a növényi gyógyszert használták, és akiknek terhessége élveszületéssel ért véget. Az összes nőt a terhesség végéig figyelték az Ukrán Orvostudományi Akadémia Gyermekgyógyászati, Szülészeti és Nőgyógyászati Intézetének Isida Szülészeti és Nőgyógyászati Klinikáján 2004 és 2009 között. Minden beteg írásos tájékozott beleegyezést nyújtott be a adatok tanulmányi célokra. A nemzeti nyilvántartásban szereplő adatokat csak gyakoriságként (a rendellenességek% -ában) adják meg a munkadokumentumok. Ezért a kontroll betegek pontos számát nem lehet megadni. Ennek ellenére az adatokat ellenőrzik és jelentik a nemzeti nyilvántartásban.
Vizsgálja meg a populációt és a Canephron® N kezelést
Mivel az egyén paritási állapota köztudottan jelentős hatással van a terhesség kimenetelére [28], és a különféle vizsgálatok száma nem volt elegendő egy külön vizsgálat elvégzéséhez, ezért az elsődleges (szingulett) és a többpáros eseteket vettük fel értékelésünkbe. Minden résztvevőnek a terhesség első trimeszterében legalább 14 napig szednie kellett a Canephron® N-t az UTI-k kezelésére. A használt Canephron® N napi adag 6 tabletta vagy 150 csepp volt. Az esetek többségében a nők a Canephron® N-t szedték, mielőtt tudatában lettek volna terhességüknek. A fő kizárási kritériumok örökletes betegségek, többes terhességek jelenléte, valamint ismert toxikus vagy genotoxikus anyagok krónikus expozíciója voltak.
Végpontok
A vizsgálat fő végpontja az újszülött veleszületett rendellenességeinek jelenléte volt. Ezenkívül a méhen belüli fejlődési rendellenességeket az Egészségügyi Világszervezet (WHO) Nemzetközi Betegségek Osztályozása (ICD) -10 osztályozása szerint értékelték [29]. Pontosabban a nemi szervek veleszületett rendellenességeinek, a vizeletrendszer veleszületett rendellenességeinek, a mozgásszervi rendszer veleszületett rendellenességeinek és deformitásának, valamint egyéb veleszületett rendellenességeknek az értékelését értékelték [29]. A kapott eredményeket összehasonlítottuk a kijevi országos statisztikai adatokkal, ugyanabban az 5 éves időszakban, azoknál a nőknél, akik nem használták a Canephron® N-t. Az újszülött állapotát 10 perc Apgar pontozási rendszer alkalmazásával értékelték. születés után [30].
Abban az esetben, ha kóros terhesség és/vagy fejlődési rendellenesség volt az újszülöttnél, további értékeléseket végeztek annak érdekében, hogy felmérjék a rendellenességek és a Canephron N® bevitel közötti kapcsolatot (beleértve a gyógyszer beadásának időtartamát, más gyógyszerek beadását, az anya életkorát), hibák jelenléte a családban, laboratóriumi adatok, más ismert kockázati tényezőknek való kitettség, például dohányzás vagy néhány szakmai veszély). A csecsemőben veleszületett rendellenességek jelenlétét értékelték azzal az időzítéssel együtt, amikor az anya bevette a Canephron® N-t (referenciapontként az utolsó menstruáció első napját használva).
Statisztikai analízis
Az eredmények statisztikai elemzését a Statistics for Windows® (5.3 verzió, Statsoft, USA) segítségével végeztük. A relatív kockázat (RR) arányokat a következő képletek szerint számoltuk:
Ahol RR = relatív kockázat, o 1 = az esemény gyakorisága a kísérleti csoportban, és o 2 = az esemény gyakorisága a kontrollcsoportban.
ahol SE = standard hiba 0,05,
r 1 és r 2 = a kísérleti és a kontrollcsoport eseményeinek száma,
n 1 és n 2 = a betegek száma a kísérleti és a kontroll csoportban,
95% CI konfidencia intervallum = loge RR ± 1,96 × SM.
Eredmények
A résztvevők életkora 17 és 39 év között volt (átlagosan 21 ± 2,2 év). Összesen 170 nő (44,3%) volt primiparus, 214 (55,7%) pedig többpáros. A 384 nőből 361 vett Canephron® N tablettát (napi 6 tabletta), 23 pedig Canephron® N cseppet (150 csepp naponta). A kezelés átlagos időtartama 23 ± 1,25 nap volt. 196 esetben (51,05%) a Canephron® N monoterápiát, 188 esetben (48,95%) kombinációs terápia részeként alkalmazták (az antibakteriális szerek mellett a foszfomicin, aminopenicillinek és cefalosporinok). A Canephron® N kezelés indikációit a vizsgálati populációban az 1. táblázat foglalja össze.
Nem voltak szignifikáns különbségek a fejlődési rendellenességek előfordulási gyakoriságában azoknál az újszülötteknél, akiknek anyja a terhesség első trimeszterében szedte a Canephron® N-t, összehasonlítva a kijevi népességre vonatkozó statisztikai adatokkal 2004 és 2010 között (2. táblázat). A terhesség első trimeszterében a Canephron® N-t szedő 384 nő közül összesen 14 (3,65%) született csecsemővel veleszületett rendellenességekben. Ez a százalék hasonló az általános kijevi lakosság arányához ebben az időszakban (3,71%. Az Ukrajna Egészségügyi Minisztérium Egészségügyi Statisztikai Központjának állami intézmény jelentése szerint).
Két eset fordult elő a vizeletrendszer malformációival a Canephron® N populációban (mindkét vese agenesis). Egy esetben előfordult a kismedencei rendszer duplikációja, és egy esetben a méhen kívüli kismedencei vese. A szív rendellenességei magukban foglalták a nagy artériák transzpozícióját, a pitvari septum hibáját és az Ebstein-rendellenességet. Az idegrendszeri rendellenességek magukban foglalják a corpus callosum, az agyi ciszta és a ventriculomegalyával járó veleszületett hydrocephalus agenesisét. Az emésztőrendszer rendellenességei anális atresiából és pylorostenosisból álltak. A mozgásszervi rendellenességek az ujj disztális falanxjának és a láb szindaktíliájának hiányát jelentették.
Ezt követően megvizsgáltuk a Canephron® N beadásának időzítése a terhesség első trimeszterében és az esetleges veleszületett rendellenességek jelenlétét az újszülöttben (3. táblázat). A Canephron® N bevitelének időzítését az utolsó menstruáció első napjához viszonyítva értékelték.
A 4 nő közül, akik a terhesség legkorábbi és legkiszolgáltatottabb időszakában (29–50. Nap) szedték a Canephron® N-t, egyik csecsemőjüknél sem voltak veleszületett rendellenességek. A 106 nő közül, akik az 51–70. Nap között szedték a Canephron® N-t, 4 született veleszületett rendellenességgel rendelkező csecsemőt, és a 274 nőből 10, aki a Canephron® N-t szedte a 71–84. Nap között, veleszületett fejlődési rendellenességeket szenvedett. Ezeknek a rendellenességeknek az előfordulása hasonló az általános kijevi népességéhez.
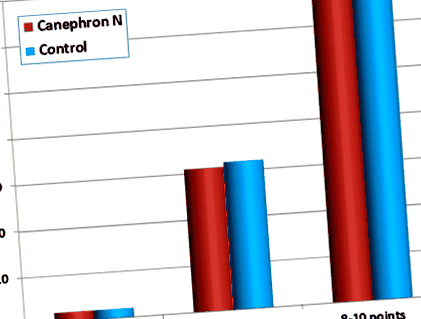
Kiszámítottuk az RR-t és a veleszületett születési rendellenességek kialakulásának 95% -os konfidenciaintervallumát (CI) azoknál az újszülötteknél, akiknek anyja a terhesség első trimeszterében szedett Canephron® N-t. Az RR értéke 0,941 (95% CI: 0,526–1,68), ami azt jelzi, hogy a Canephron® N semmilyen hatással nem jár a veleszületett születési rendellenességek előfordulására vonatkozóan. Végül az újszülöttek állapotát a születés után egy perccel értékeltük az Apgar pontrendszer segítségével (1. ábra). Az Apgar pontozási rendszer használatával az öt fő jellemző mindegyikének (pulzus, légzési erőfeszítések, izomtónus, reflex ingerlékenység és szín) 0 és 2 közötti értéket kapunk. Az összes pontszám az öt részpontszám összege, 7 vagy annál magasabb pontszám azt jelzi, hogy az újszülött állapota jó vagy kiváló [30]. Az újszülöttek többségének 8–10 pontértéke volt az Apgar-skálán, jelezve, hogy állapotuk kiváló, és arra utal, hogy a Canephron® N alkalmazása a terhesség első trimeszterében nem befolyásolja az újszülöttek általános állapotát.
Apgar pontszám olyan újszülötteket, akiknek anyja a terhesség első trimeszterében a Canephron® N-t használta. Piros: Canephron® N-vel kezelt betegek újszülöttjei a terhesség első trimeszterében. Kék: Statisztikai adatok ugyanazon klinikák újszülöttjeiről, akiknek az anyja nem szedett Canephron® N-t
Vita
A húgyúti rendszer gyulladásos betegségei a terhes nőknél a leggyakrabban előforduló betegségek közé tartoznak [31]. A vese medencéjének és az uretereknek a hormonokkal összefüggő tágulása miatt a terhes nőknél megnő a vesék bakteriális inváziójának és a pyelonephritisnek a kockázata [31]. A terhesség alatt a pyelonephritissé fejlődő bakteriuriát az anya és a gyermek rossz eredménnyel járta. A terhesség alatti UTI-k növelik az anyai magas vérnyomás, vérszegénység és az idő előtti vajúdás, valamint az alacsony születési súly kockázatát [32, 33]. Ezért a terhesség alatt előforduló UTI-k kezelése fontos eszköz a terhességi szövődmények megelőzésében.
Vizsgálatunk biztonsági megállapításai alátámasztják a Canephron® N-ről korábban közzétett megállapításokat a várandós nőknél a húgyúti fertőzések és a kapcsolódó betegségek megelőzésében és kezelésében. Három tanulmány vizsgálta a Canephron® N terhes nőkön kifejtett hatásait, elsősorban a hatékonyságra összpontosítva [35–37]. Ordzhonikidze és mtsai tanulmánya. 300 terhes nőt tartalmazott, akiknek számos vizelési kórképe volt, beleértve a tünetmentes bakteriuriát, a terhességet, a krónikus pyelonephritis súlyosbodását vagy súlyosbodás nélküli krónikus húgyúti betegséget [36]. Medved és mtsai független tanulmánya. 30 olyan I. típusú cukorbetegségben szenvedő terhes nő volt, akiknél terhességi pyelonephritis vagy krónikus pyelonephritis súlyosbodása volt [35]. A harmadik vizsgálat egy prospektív, randomizált vizsgálat volt, amelyben 85 terhes nő vett részt, különböző vesepatológiákkal [38]. Mindhárom vizsgálatban a Canephron® N-t a szokásos terápiával együtt adták, és jótékony hatással volt a különböző vesebetegségekben szenvedő terhes nőkre. Bár ezekben a vizsgálatokban nem végeztek részletes biztonsági elemzéseket, a Canephron® N jó biztonsági és tolerálhatósági profilt mutatott az összes vizsgálati populációban [27]. Meg kell jegyezni, hogy a gyógyszert a terhesség első trimeszterében nem adták be mindhárom vizsgálatban.
Két további tanulmány vizsgálta a Canephron® N lehetséges hatásait a veleszületett rendellenességek arányára [38, 39]. Repina és mtsai. követett 115 gyermeket (5 hónapos – 3,5 éves), akik olyan nőknél születtek, akiket a terhesség második vagy harmadik trimeszterében Canephron® N-vel kezeltek. A tanulmány nem számolt be káros hatásokról a magzatra a terhesség alatt, valamint a szülés utáni hatásokról azokra az anyákra született gyermekekre, akiket terhesség alatt kezeltek a gyógyszerrel [39]. Egy nagy prospektív-retrospektív tanulmány, amely 1647 nőnél értékelte a Canephron® N teratogén, embriotoxikus és fetotoxikus hatásait, nem mutatott semmilyen fejlődési vagy veleszületett hatást [38]. Adataink ezen vizsgálatok eredményeire építenek, ami arra utal, hogy a Canephron® N alkalmazása a terhesség első trimeszterében nem jár teratogén hatásokkal a magzatban.
Vizsgálatunk korlátai összefüggenek retrospektív felépítésével, valamint az ebből adódó hiányos adatokkal azon potenciális zavaró tényezőkről, amelyek befolyásolhatják a veleszületett születési rendellenességek előfordulását vizsgálati populációnkban. Ezenkívül a vizsgálati populációba bevont egyedek száma viszonylag kicsi volt (összesen 384), és (48,95%) esetekben a Canephron N-t alkalmazták kombinációs terápia részeként (a foszfomicin, aminopenicillinek és cefalosporinok antibakteriális szerei mellett). . Érdemes megemlíteni azt is, hogy néhány felhasználó a terhesség korai szakaszában a „mindent vagy semmit” szabály miatt vetélést tapasztalhatott, és ilyen esetekről ebben a tanulmányban nem számoltak be.
Következtetések
Vizsgálatunk eredményei azt mutatják, hogy a Canephron® N alkalmazása a terhesség első trimeszterében nem társult semmilyen teratogén hatással a magzatra, és nem volt hatással az újszülöttek általános állapotára.
- Mycoplasma fertőzések tünetei, kezelése és megelőzése
- Sebészeti abortusz (első trimeszter) Feltételek és kezelések UCSF Health
- A Safety First Nestle India, ausztrál gluténmentes ételek, hamisított indiai méz és még sok más
- Terhességi gyakorlatok az első trimeszterben
- A tények szögezése Körömkezelés biztonságossága terhességben - MotherToBaby