A glutation hatékonysága nem alkoholos zsírmájbetegség kezelésében: nyílt, egykarú, multicentrikus, kísérleti tanulmány
Absztrakt
Háttér
A glutation döntő szerepet játszik a sejtek méregtelenítő és antioxidáns rendszerében, és intravénás injekcióval heveny mérgezések és krónikus májbetegségek kezelésére használták. Ez az első tanulmány a glutation orális alkalmazásának terápiás hatásait vizsgálva nem alkoholos zsírmájbetegségben (NAFLD) szenvedő betegeknél.
Mód
A vizsgálat nyílt, egykarú, multicentrikus, kísérleti kísérlet volt. Harmincnégy ultrahangvizsgálattal diagnosztizált NAFLD beteget prospektív módon értékeltek. Valamennyi beteg életmódbeli szokásainak (étrend és testmozgás) javítása érdekében először 3 hónapon keresztül beavatkozott, majd glutation (300 mg/nap) kezelés következett 4 hónapig. Kiértékeltük klinikai paramétereiket a glutation-kezelés előtt és után. A májzsírt és a fibrózist számszerűsítettük rezgésvezérelt tranziens elasztográfiával is. A vizsgálat elsődleges eredménye az alanin-aminotranszferáz (ALT) szintjének változása volt.
Eredmények
Huszonkilenc beteg fejezte be a protokollt. Az ALT szintje 4 hónapig tartó glutation-kezelést követően szignifikánsan csökkent. Emellett a trigliceridek, nem észterezett zsírsavak és ferritin szintek is csökkentek a glutation kezeléssel. Az ALT-válaszadók dichotomizálását követően a kiindulási értékhez viszonyított átlagos medián 12,9% -os csökkenés alapján azt találtuk, hogy az ALT-válaszadók fiatalabbak voltak és nem szenvedtek súlyos cukorbetegségben, mint az ALT-kezelésre nem reagálók. A kontrollált csillapítási paraméter az ALT válaszadóknál is csökkent.
Következtetések
Ez a kísérleti tanulmány bemutatja a glutation orális alkalmazásának lehetséges terápiás hatásait gyakorlati dózisban NAFLD-ben szenvedő betegek számára. Nagy hatékonyságú klinikai vizsgálatokra van szükség.
Próba regisztráció
UMIN000011118 (regisztráció dátuma: 2013. július 4.).
Háttér
A nem alkoholos zsírmájbetegség (NAFLD) világszerte fontos oka a krónikus májkárosodásnak [1, 2]. A NAFLD spektruma az alkoholmentes zsírmájtól kezdve az alkoholmentes steatohepatitisig (NASH), a cirrhosisig és a hepatocelluláris carcinomáig terjed [3]. A NAFLD metabolikus szindrómákkal társul, és a NAFLD előfordulása az idők során növekedett [4, 5]. A NAFLD első vonalbeli kezelése az életmód módosítása a súlycsökkentés elérése érdekében, különösen diéta és testmozgás révén [6]. A súlycsökkentést azonban nagyon nehéz megvalósítani és fenntartani. A NAFLD hatékony terápiáját még nem sikerült megállapítani.
A glutation, a γ-L-glutamil-L-ciszteinil-glicin, az emberi test minden sejtjében jelen lévő tripeptid [7]. Noha funkciói összetettek és továbbra is a jelenlegi kutatások tárgyát képezik, úgy gondolják, hogy a glutation döntő szerepet játszik a sejtek méregtelenítő és antioxidáns rendszerében. Mivel a sejtek glutationszintjének csökkenése megállapította, hogy növeli a betegségek és a mérgezések kockázatát, krónikus májbetegségben szenvedő és mérgező betegek kezelésére glutation közvetlen intravénás injekcióját alkalmazták [8, 9].
A glutation a sejtekben szintetizálódik glutaminsavból, ciszteinből és glicinből. A ciszteint és a glicint metioninból, illetve szerinből állítják elő, a glutaminsavat pedig a glükóz metabolitjából, az a-ketoglutarátból szintetizálják. Ezeket az aminosavakat általában táplálékból szállítják. Beszámoltak arról, hogy a glutation orális beadása nem változtatta meg a glutation és a glutation-diszulfid szintjét a vér fehérje nélküli frakciójában [10], és felvetették, hogy a szájon át beadott glutation az aminosavakra bomlik, és nem gyakorol specifikus aktivitást az aminosavforráson túl. Beszámoltak azonban arról, hogy a glutation lebomlás nélkül képes a Caco-2 sejtek monorétegén átjutni [11]. Ezenkívül Park és mtsai. orális beadás után a glutation fehérjéhez kötött formájának növekedéséről számolt be az emberi vérben, míg a deproteinizált frakcióban a glutation nem változott [12]. Ezek a tanulmányok azt sugallják, hogy az orálisan beadott glutation felszívódik a vérben, és hatással lehet az emberi test redox állapotára. Ezek a megállapítások arra ösztönöztek minket, hogy vizsgáljuk meg a glutation orális beadásának terápiás hatásait a NAFLD-re.
A jelenlegi vizsgálat célja az volt, hogy bemutassa a glutation orális beadásának terápiás lehetőségét egy nyílt, egykarú, multicentrikus, kísérleti vizsgálatban a következő nagyszabású klinikai vizsgálatok előtt. Ebben a tanulmányban összehasonlítottuk a klinikai paramétereket a glutation-kezelés előtt és után. Kiértékeltük a kontrollált csillapítási paramétert (CAP) és a májmerevség mérést (LSM) is, rezgésvezérelt tranziens elasztográfiával (VCTE) meghatározva.
Mód
A betegek és a tanulmányterv
A vizsgálati protokollt a Helsinki Nyilatkozatban foglalt irányelveknek megfelelően végezték el, és a Jokohama Városi Egyetem és a Kiotói Prefekturális Orvostudományi Egyetem etikai bizottságai hagyták jóvá. A vizsgálatba való belépés előtt minden résztvevő írásos tájékoztatáson alapuló beleegyezést kapott. A vizsgálatot az Egyetemi Kórházi Orvosi Információs Hálózat (UMIN) klinikai vizsgálatok nyilvántartásában regisztrálták (UMIN000011118).
Mivel a szérum alanin-aminotranszferáz (ALT) szintjeiről beszámoltak a NASH szövettani lefolyásának előrejelzésében, és mivel a NASH progressziójának megakadályozásához szigorú ALT-ellenőrzés szükséges [13], ennek a vizsgálatnak az elsődleges eredménye az ALT-szint változása volt.
Antropometriai és laboratóriumi értékelések
A beteg súlyát és magasságát kalibrált skála segítségével mértük, miután a betegek levették cipőjüket és minden nehéz ruházatukat. A vénás vérmintákat azután vettük, hogy a betegek egy éjszakán át (12 órát) éheztek. A vérlemezkék száma és az éhomi vércukor (FBS), a hemoglobin A1c (HbA1c), az immunreaktív inzulin (IRI), a nagy sűrűségű lipoprotein (HDL) koleszterin, az alacsony sűrűségű lipoprotein (LDL) koleszterin, a trigliceridek, a nem észterezett zsírsavak ( NEFA), az aszpartát-aminotranszferázt (AST), az ALT-t, a y-glutamil-transzpeptidázt, a ferritint és a IV-es típusú kollagént 7 standard laboratóriumi technikákkal mértük a glutation-kezelés előtt és után. Azoknál a betegeknél, akiknek FBS ≥126 mg/dl, HbA1c ≥6,5%, és/vagy jelenleg antidiabetikus gyógyszereket használnak, a Japán Diabetes Társaság kritériumai szerint cukorbetegek voltak [14].
A dehidratizált frakció glutationját és a plazma fehérjéhez kötött frakcióját Park és munkatársai által leírt módszerrel határoztuk meg. [12]. Röviden: 100 μl plazmát összekevertünk három rész etanollal. A felülúszót használtuk deproteinizált frakcióként. A csapadékot 100% 5% triklór-ecetsavval extraháljuk, amely 2% 2-merkaptoetanolt tartalmaz. A felülúszót fehérjéhez kötött frakcióként alkalmaztuk. Ezekben a frakciókban a glutationt lúgosítottuk és 6-aminokinolil-N-hidroxi-szukcinimidil-karbamáttal derivatizáltuk az előzőekben leírtak szerint. A származékokat feloldottuk és folyadékkromatográfia/elektronpermet-ionizáció/tandem tömegspektrometria alkalmazásával detektáltuk, több reakciót követve.
Rezgésvezérelt tranziens elasztográfia
A VCTE-t M-szondás eszközzel (Fibroscan; EchoSens, Párizs, Franciaország) végeztük. Az LSM technikájának és vizsgálati eljárásának részleteit korábban leírták [15, 16]. A CAP-t VCTE-vel mértük a steatosis stádiumában. A technika egy saját algoritmus, amely a VCTE nyírási hullámának ultrahangos csillapítási együtthatóján alapul, amely a teljes ultrahangos csillapítás becslése 3,5 MHz-en. A CAP ugyanazokat a rádiófrekvenciás adatokat használja, mint az LSM, és csak akkor értékelik, ha a megszerzés érvényes. Ezt decibelben fejezik ki méterenként. A méréseket a máj jobb lebenyéből kaptuk az interkostális tereken keresztül, a beteg a hátsó decubitus helyzetben feküdt, a jobb kar pedig maximális elrablással. Csak a legalább 10 érvényes felvételen alapuló és ≥60% -os sikerarányon alapuló VCTE-méréseket tekintették megbízhatónak, és statisztikai elemzéshez használták.
Statisztikai analízis
Az adatokat átlag ± szórásként fejezzük ki, hacsak másként nem jelezzük. A minta nagyságát egy korábbi jelentés alapján határozták meg [17]. Becsléseink szerint ezzel a mintanagysággal a tanulmánynak 80% -os ereje lenne az ALT javulási arányának abszolút különbségének 30 százalékpontos kimutatására, az 1. típusú kétoldalas hibával 0.05. Az összes statisztikai elemzést a JMP ver. 11.2.0 szoftver (SAS Institute, Cary, NC, USA). A betegcsoportok közötti egyváltozós összehasonlításokat a Student's segítségével elemeztük t-vagy Mann – Whitney U-tesztje. A o-érték
Eredmények
Biokémiai válasz 4 hónapos glutation-kezelés után
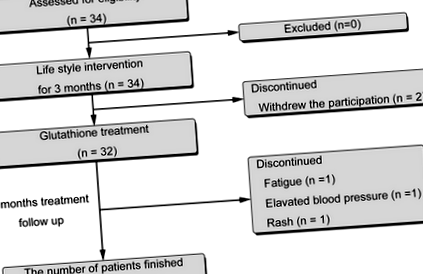
A vizsgálati folyamatábra az 1. ábrán látható. A beiratkozott 34 beteg közül kettő visszalépett a kezelés megkezdése előtt. A fennmaradó 32-et L-glutationnal (300 mg/nap; KOHJIN Life Sciences, Tokió, Japán, US FDA GRAS # GRN000293) kezeltük 4 hónapon át orális beadással. Huszonkilenc beteg (14 férfi, 15 nő, átlagéletkor 56,0 ± 13,3 év) fejezte be a vizsgálati protokollt. Három beteg esett ki, egy-egy fáradtság, magas vérnyomás és kiütés miatt.
Tanulmány folyamatábrát mutat be a betegek elosztását
A vizsgálatban résztvevők klinikai és laboratóriumi jellemzőit az 1. táblázat mutatja. Huszonnégy betegnél (82,8%) volt diszlipidémia, 12-nél (41,4%) sztatin szedett. Tizennégy betegnél (48,3%) volt cukorbetegség.
4 hónapos glutation-kezelés után az ALT-szint jelentősen csökkent. A glutation-kezelés csökkentette a trigliceridek, a NEFA és a ferritin koncentrációját. A glutation-kezelés után a HbA1c szint emelkedett. Váratlanul a glutation a plazmafehérje-frakcióban jelentősen csökkent a glutation-kezelés után. Nem volt szignifikáns különbség a glutation szintjeiben a deproteinizált frakcióban. Bár a glutation-kezelés nem befolyásolta szignifikánsan a CAP és az LSM értékeket, mindkettő tendenciája csökkent.
A glutation-kezelés javította a CAP értékeket az ALT-válaszban szenvedőknél
Az ALT szint medián csökkenése a kiindulási értékhez képest 12,9% volt. A 29 beteget ALT-kezelésre reagálókra osztották (n = 15), meghatározva azokat, akiknél az ALT-csökkenés ≥12,9%, és az ALT-t nem reagálók (n = 14), meghatározva azokat, akiknek ALT-csökkenése 2 vs. 26,6 ± 3,8 kg/m 2, o = 0,47). Bár a diszlipidémiában szenvedő ALT-válaszadók és nem válaszolók százalékos aránya nem különbözött (80,0% vs. 85,7%), o = 0,68), a HDL-koleszterin és az LDL-koleszterinszint magasabb volt az ALT-válaszban szenvedőknél. A sztatinhasználat aránya alacsonyabb volt az ALT-kezelésben részesülőknél, mint a nem válaszolóknál (26,7% vs. 57,1%), o = 0,10). A cukorbetegség aránya szintén alacsonyabb volt (33,3% vs. 64,3%, o = 0,10) és a HbA1c szint szignifikánsan alacsonyabb volt az ALT-kezelésben részesülőknél a nem válaszolókhoz képest. A glutation-kezelés előtt nem volt szignifikáns különbség a glutation szintjeiben a plazmafehérjében és a deproteinizált frakciókban az ALT-válaszadók és a nem válaszolók között.
Az ALT-válaszolók és a nem válaszolók jellemzőit a glutation-kezelés előtt és után a 3. táblázat mutatja be. A glutation-kezelés csökkentette az ALT-szintet az ALT-válaszadóknál (2a. Ábra), de megnövelte az AST- és az ALT-szintet az ALT-nem reagáló betegeknél (2b. Ábra). Az ALT-válaszadóknál a glutation-kezelés csökkentette a NEFA, a ferritin és a HDL koleszterinszintjét, de megemelte a HbA1c szintet. Az ALT-kezelésre nem reagáló betegeknél a glutation-kezelés csökkentette a triglicerid szintet, de növelte az FBS-szintet. A glutation-kezelés szignifikánsan csökkentette a glutationt a plazmafehérje-boud frakcióban az ALT-válaszadókban; az ALT-t nem reagáló betegeknél nem történt változás. Meglepő módon a CAP értékek szignifikánsan csökkentek az ALT válaszadóknál; nem voltak különbségek az ALT-t nem reagáló betegek körében.
Az alanin - aminotranszferáz (ALT) szintje a glutation - kezelés előtt és után a ALT reagálók és b ALT nem válaszolók
Vita
Úgy tűnik, hogy a glutation fehérjéhez kötött formájának szintje 1-2 órával emelkedik a glutation bevitele után, ami arra utal, hogy a szájon át adott glutation felszívódik a vérbe [12]. Ez a fehérjéhez kötött glutation lerakódhat a májban, enyhítve a hepatitist.
A fehérjéhez kötött glutation szintjei egy éjszakai böjt után visszatérnek az alapszintre [12]. A jelenlegi tanulmányban azt tapasztaltuk, hogy a glutation fehérjéhez kötött formájának kiindulási szintje jelentősen csökkent egy éjszakai böjt után 4 hónapos glutation beadását követően, különösen az ALT-válaszadóknál. A fehérjéhez kötött glutation szintje a jelenlegi vizsgálatban a betegeknél lényegesen magasabb volt, mint a korábbi vizsgálatok egészséges önkénteseinek [12] ugyanazon módszerrel becsült szintje. A glutation-kezelés a fehérjéhez kötött glutationt a normál alapszintre csökkentette. Ezek a megállapítások azt sugallják, hogy a glutation orális beadása fokozhatja a fehérjéhez kötött glutation beépülését a májba, vagy csökkentheti a glutation májból történő kiválasztását.
A NAFLD összetett betegség. Úgy gondolják, hogy patogenezise különféle tényezőket foglal magában, beleértve az inzulinrezisztenciát, a lipotoxicitást, a bélből/tápanyagokból származó szignálokat, az adipocitokineket, az oxidatív stresszt és a genetikai tényezőket. A NAFLD-ben szenvedő betegek 20–80% -ában diszlipidémiáról számoltak be [20]. Korábbi tanulmányunk feltárta, hogy az orálisan beadott glutation felgyorsítja a zsírsav-felhasználást azáltal, hogy a fehérje-peroxiszóma-proliferátor-aktivált receptor-y-koaktivátor-1α szintjét és a mitokondriális DNS-t csökkent plazma NEFA-szinttel szabályozza [21]. A jelenlegi tanulmány azt is feltárta, hogy betegeink közül 24-nek (82,8%) volt diszlipidémiája, és a glutation-kezelés szignifikánsan csökkentette a triglicerid- és a NEFA-szintet.
A NAFLD-betegeknél gyakran észleltek ferritin- és testvas-növekedést [22, 23]. A ferritin és a vas oxidatív stressz révén elősegítheti a NAFLD fejlődését [24]. A PIVENS vizsgálat eredményei azt mutatták, hogy az antioxidáns E-vitamin orális beadása javította a májműködési rendellenességeket és a NASH kóros állapotát [17]. Az E-vitaminnal való hosszú távú kezelés azonban az összes okból bekövetkező halálozás növekedésével és a prosztatarák kockázatának növekedésével járt [25,26,27], ami arra utal, hogy értékelni kell ennek a szernek a hatékonyságát és biztonságosságát. A jelenlegi tanulmányban a glutation-kezelés szignifikánsan csökkentette a ferritinszintet, de a csökkenés mögött álló mechanizmus továbbra sem tisztázott. Úgy gondolják, hogy a glutation enyhíti a hiperferritinémiát és az oxidatív stresszt, valamint terápiás hatást fejt ki a NAFLD-ben szenvedő betegeknél.
A májzsírt nem invazív módon értékelték VCTE és CAP alkalmazásával. Egy metaanalízis megállapította, hogy a CAP jó érzékenységgel és specifitással rendelkezik a májzsír kimutatására [28]. Vizsgálatunkban a CAP-értékek általában csökkentek minden betegnél, és szignifikánsan csökkentek az ALT-válaszadóknál a 4 hónapos glutation-kezelést követően. Bár a máj steatosis szövettani javulása és a CAP értékek csökkenése közötti összefüggést még nem sikerült meghatározni, a glutation csökkentheti a máj steatosisát.
Vizsgáltuk a glutation terápiás hatásaival összefüggő beteg tényezőket is. Megállapítottuk, hogy a HDL-koleszterin és az LDL-koleszterin szintje magasabb és a HbA1c-szint alacsonyabb volt az ALT-kezelésben részesülőknél, mint a nem válaszolóknál. Bár a sztatinokat használó betegek százalékos aránya nem különbözött szignifikánsan a két csoport között, az ALT-válaszadóknál ez a százalék alacsonyabb volt, mint azoknál, akik nem reagáltak ALT-ra. Noha a kis minta nagysága miatt nem lehet más, mint spekuláció, a glutation-kezelést követően terápiás hatást mutató betegek fiatalabbak voltak, és nem szenvedtek cukorbetegségben vagy enyhe cukorbetegségben.
Három beteg a fáradtság, az emelkedett vérnyomás és a kiütés miatt kivonult a vizsgálatból. Az ALT-kezelésben részesülőknél a HbA1c szint emelkedett és a HDL koleszterin szint csökkent a glutation kezelés után. Egy 6522 betegen végzett vizsgálatból kiderült, hogy 24-en (0,4%) tapasztaltak mellékhatásokat, amelyek közül a leggyakoribb az étvágytalanság, hányinger, hányás és kiütés [29]. Noha a jelenlegi vizsgálatban a glutation beadása egy betegnél kiütéssel járhatott, a glutation és más káros hatások közötti okozati összefüggések nem tisztázottak.
Ennek a tanulmánynak voltak bizonyos korlátai. Először tanulmányunk egykaros vizsgálat volt kontrollcsoport nélkül. Másodszor, a vizsgálatot korlátozta a kis mintaméret és a rövid kezelési periódus (4 hónap). Harmadszor, mivel a betegek kóros állapotait nem értékelték májbiopsziával, az orálisan beadott glutation beépülése a májba nem volt megerősítve. Negyedszer, számos beteg kivonult a vizsgálatból, de ok-okozati összefüggést nem lehet meghatározni.
Következtetések
A glutation-kezelés jelentősen javította az ALT-szintet. Ezenkívül a CAP értékek jelentősen csökkentek az ALT-válaszadóknál. Kísérleti tanulmányunk azt sugallja, hogy a glutation orális beadása támogatja a máj metabolizmusát és javítja a NAFLD-t. A glutation jótékony hatásainak mechanizmusának tisztázása érdekében további vizsgálatokra van szükség, amelyek megvizsgálják az orálisan beadott glutation májba való beépülését és a gazda redox rendszerre gyakorolt hatását stabil izotóppal jelzett glutation és állatmodellek alkalmazásával. Nagyszabású klinikai vizsgálatokra van szükség a glutation terápiás hatásainak megerősítéséhez.
- Étrendi összetétel és alkoholmentes zsírmájbetegség SpringerLink
- Krónikus vesebetegség és alkoholmentes zsírmájbetegség - van-e összefüggés
- Az első nemzeti tanulmány a nem alkoholos zsírmájbetegség fokozódó járványát jósolja
- A széklet és a vér mikrobiota profiljai, valamint az alkoholmentes zsírmájbetegség jelenléte elhízottaknál
- Az étrendi lenmagolaj megakadályozza a nyugati típusú étrend okozta alkoholmentes zsírmájbetegséget