A zsírlerakódás elnyomása a brojlercsirkékben (-) - hidroxi-citromsav-kiegészítéssel: proteomikai perspektíva
Tárgyak
Absztrakt
Bevezetés
Az elmúlt évtizedekben a baromfitermelés fő célja sok országban az állatok növekedési ütemének növelése volt. A modern brojler törzseknél azonban gyakran előfordul a hasi zsír túlzott mértékű lerakódása 1,2, amelyet ellenőrizni kell, mivel negatív hatással van a baromfitermelésre, amit a tenyésztés során felmerülő takarmányköltség, a hús végső minőségének romlása bizonyít. és a baromfifeldolgozó üzemek jelentős gazdasági vesztesége 3,4,5. A túlzott zsírlerakódás gazdasági aggályai és a fogyasztói idegenkedés miatt a túlzott zsírkontroll és a húsminőség javítása fontos kutatási téma a baromfitudósok számára.
(-) - Hidroxi-citromsav [(-) - HCA], amely a gyümölcshéjak fő hatóanyaga. Garcinia cambogia 6,7, ismert módon elősegíti a súlycsökkenést 8,9,10, növeli a 11 glikogénszintézis sebességét, elnyomja de novo zsírsavszintézis 12,13 és fokozza a lipidoxidációt 14,15,16. Nemrégiben laboratóriumunk is ezt találta Garcinia cambogia kivonatok csökkenthetik a zsír felhalmozódását a lipolízis gén expressziójának szabályozása révén az adiponektin-AMPK jelátviteli útvonalon magas zsírtartalmú étrend által kiváltott patkány elhízási modellben 17. Továbbá, korábbi vizsgálatok kimutatták, hogy állatokban és emberekben a (-) - HCA az ATP-citrát-liáz 18,19 erős inhibitora, amely katalizálja a citrát oxaloacetáttá és acetil-CoA-ként való hasítását, és végül korlátozza az acetil hozzáférhetőségét. -CoA egységek, amelyek szükségesek a zsírsavszintézishez és a lipogenezishez 10,20. Az alapul szolgáló biokémiai mechanizmus azonban nem érthető jól, különösen a (-) - HCA hatása brojlercsirkékben.
A baromfi lipidanyagcseréje eltér az emlősökétől, a baromfi metabolikus aktivitásában a máj a fő szerv, 21,22. Baromfiban a zsírsavak katabolizmusa (β-oxidáció) elsősorban a mitokondriumokban következik be, míg a zsírsavak a hepatociták citoplazmájában szintetizálódnak 22. A proteomikai megközelítés hatékony eszköz a biológiai mechanizmusok tanulmányozására 23, 24. Ezenkívül a máj globális fehérje expressziós elemzése elősegítené a lipid anyagcserében részt vevő, differenciálisan expresszált fehérjék azonosítását, és új betekintést nyújtana a brojlercsirkék zsírlerakódásának mechanizmusába.
Étrend-kiegészítők Garcinia cambogia kivonatok, a zsírlerakódás csökkentésének potenciális terápiája, praktikus módszer lehet a hasított test túlzott zsírtartalmának csökkentésére a baromfiban. A jelenlegi vizsgálatot a (-) - HCA-kiegészítés hatásának feltárására tervezték a lipid metabolizmushoz kapcsolódó fehérjék/enzimek máj expressziójára (mitokondriális és citoplazmatikus) brojlercsirkékben. A cél az volt, hogy azonosítsák a lipidanyagcserében részt vevő különböző fehérjéket, és jobban megértsék a baromfi zsírlerakódásának (-) - HCA-szabályozásának biokémiai mechanizmusát.
Anyag és módszerek
Anyagok és reagensek
Izoelektromos pH-gradiens (IPG) csíkok (pH 3,0–10,0; NL, 17 cm), karbamid, Pharmalyte (pH 3–10), glicerin (87% w/w), Tris (elektroforézis fokozat), 1,2-di ( dimetilamino) -etán (TEMED; elektroforézis tisztaságú reagens), akrilamid (40% -os oldat; akrilamid/biszakrilamid arány, 37,5: 1), 3 - [(3-kolamidopril) dimetil-ammónium] -1-propánszulfonát (CHAPS; elektroforézis minőségű), tiokarbamidot (ACS fokozat), ditiotreitolt (DTT, elektroforézis fokozat), jód-acetamidot (elektroforézis fokozat), ásványi olajat, Coomassie G-250 festéket és alacsony olvadáspontú agarózt kaptunk a Bio-Rad cégtől. Az állati sejt/szövetminőségű tisztított mitokondrium izolációs készleteket a Genmed Scientifics-től, az enzimaktivitás-vizsgálati készleteket a Nanjing Jiancheng Biotechnology Institution-tól vásároltuk. A vizsgálat során a Milli-Q gradiens víztisztító rendszerből (Millipore) készített nagy tisztaságú vizet használtunk.
Garcinia cambogia kivonatok
Garcinia cambogia kivonatokat az An Yun Co. Ltd.-től (Zhengzhou, Kína) szereztünk be. A Garcinia cambogia kivonatok 56–58% (-) - HCA-t, valamint 12–14% cellulózt, 5,5–6% α-d-melibiózt, 2,5–3% β-d-laktint, 1,5–2% d-man-no-piranózt, 11 –12% oxofénsav, 2–3% oktadecil-alkohol, 3,5–4% A koenzim és 1,5–2% szervetlen elem.
Állatok és kezelés
Összesen 120 egynapos brojlercsirkét (Ross 308) nyertek a Jiangsu Wuxi csirketenyésztő vállalattól (Wuxi, Kína). A madarakat megmértük, és négy kezelési csoportba soroltuk, amelyek mindegyike 10 madár három ismétlését tartalmazta. A brojlercsirkéket ugyanazokkal az alapvető étrendekkel etették 1 és 49 nap között (beleértve az indító fázist [1–21. Nap] és a befejező fázist [22–49. Nap]). Az étrendi tápanyagszintek megfeleltek a brojlercsirkék tápanyagigényének, amelyet az Országos Kutatási Tanács ajánlott 25. Valamennyi állatkezelési eljárást szigorúan a laboratóriumi állatok gondozására és felhasználására vonatkozó útmutatónak megfelelően hajtották végre a Nanjing Mezőgazdasági Egyetem (Nanjing, Kína) központjában, és a protokollt a Nanjing Mezőgazdasági Egyetem Intézményi Állattenyésztési és Felhasználási Bizottsága jóváhagyta ( Nanjing, Kína).
A befejező szakaszban a négy csirkecsoportot kiegészítették Garcinia cambogia kivonatok 0, 25, 50 és 75 g/kg étrend koncentrációban, amelyek 0 mg/kg, 1000 mg/kg, 2000 mg/kg és 3000 mg/kg (-) - HCA egyenértékűek voltak. Az indító fázisban a brojlercsirkéket állandó megvilágítású kivilágított ketrecekben helyezték el, és folyamatosan szolgáltattak vizet. A hőmérsékletet az első 5 napban 32 ° C-ra állítottuk, majd a szokásos kezelési gyakorlatnak megfelelően fokozatosan csökkentettük, amíg el nem érte a 22 ° C-os hőmérsékletet. A brojlereket a befejező szakaszban természetes megvilágítás mellett padlón tenyésztették. A kísérlet végén a madarakat véletlenszerűen választottuk ki, 12 órán át nem kaptak takarmányt, lemérték és felölték. A májat összegyűjtöttük és folyékony nitrogénben gyorsfagyasztottuk. A fagyasztott szöveteket az elemzésig -80 ° C-on tároltuk.
A minta előkészítése
A citoplazmatikus és mitokondriális frakciókat differenciál centrifugálással választottuk el, és kétlépcsős gradiens alkalmazásával tisztítottuk a készletben megadott utasításoknak megfelelően. Ebben az extrakciós folyamatban a sejtmag utáni felülúszó és a mitokondriális frakciókat megvizsgáltuk mitokondriális marker enzimekre a korábban közölt módszerekkel 26 .
Kétdimenziós elektroforézis
Az egyes végső felülúszók fehérjekoncentrációját a Bradford 27-es assay alkalmazásával, szarvasmarha-szérum albuminnal (BSA) alkalmaztuk. A fehérjekivonatokat (850 μg) izoelektroforézissel (IEF) választottuk el IPG-csíkokkal (pH 3,0–10,0; NL, 17 cm) a protea rendszerben (Bio-Rad) 20 ° C-on. A fókuszálást 1 órán át 250 V feszültségen, 1 órán át 500 V feszültségen, 1 órán át 2000 V feszültségen és 2,5 órán át 8000 V feszültségen végeztük; ezt követően 8000 V feszültségen tartottuk, amíg a teljes potenciál legalább 60 000 V volt. Miután az IEF futtatása befejeződött, a csíkokat eltávolítottuk és két egymást követő lépésben 15 percig 5 ml egyensúlyi pufferben (0,05 M Tris -HCl [pH 8,8], 6 M karbamid, 30% glicerin és 2% SDS), amely az első lépésben további 0,1 mg DTT-t és a második lépésben 0,1 mg jód-acetamidot tartalmaz. A második dimenziót 12,5% poliakrilamid SDS gélen futtattuk, a Multiphor rendszert (Amersham Biosciences) alkalmazva. Minden minta kétdimenziós elektroforézisét (2-DE) háromszor megismételtük.
Neuhoff kolloid Coomassie Blue G-250 festését Giovanni által leírt módszer szerint végeztük et al. 28. A festett géleket beszkenneltük és elemeztük a PDQuest 2-D analízis szoftver 8.0 (Bio-Rad) verziójával. Az összehangolás után a gélek közötti foltokat először automatikusan egyeztették, majd az egyeztetett foltokat manuálisan újra megvizsgálták a pontosság érdekében. A további elemzéshez csak azokat a foltokat választottuk, amelyek minősége> 50 és expressziós különbség> 2. A foltmennyiség normalizálását az „érvényes foltok összmennyisége” módban végezték.
MALDI-TOF MS elemzés
A fehérje foltok gélben történő tripszin emésztését és a mátrix által támogatott lézeres deszorpció/ionizációs idő repülési tömegspektrometriát (MALDI-TOFMS; Reflex III, Bruker-Daltonics) Chen által leírt eljárásokkal hajtottuk végre. et al. 26. Az MS ujjlenyomat-adatainak keresését MS-fit keresőmotorok (http://prospector.ucsf.edu) segítségével végezték az NCBInr adatbázissal szemben. Gallus gallus, a tripszin emésztés paramétereivel, két elmulasztott hasítással, a jód-acetamid (Cys) teljes módosításával, a metionin oxidációjának részleges módosításával, a fehérjetömeggel (a megfigyelt fehérjetömeg ± 20% -a, pI) és a 100 ppm. A fehérjét akkor azonosítottuk, ha legalább négy egyező peptid volt és szekvencia lefedettségük> 20% volt. Az MS ujjlenyomat-adatokon keresztül azonosított fehérjék funkcióit az UniprotKB fehérje-tudás adatbázis lekérdezésével jegyeztük fel (http://www.uniprot.org/uniprot/).
Az azonosított fehérjék funkcionális megjegyzései
A gén ontológiát (GO) széles körben használják a fehérje működésének szabványosított formátumban történő leírására 29. Az azonosított fehérjék GO elemzését a Database for Annotation 30 segítségével végeztük el. A GoMiner eszközt használták a fehérjék csoportosítására biológiai folyamatuk és molekuláris funkciójuk szerint, mivel ez az eszköz áttekintést nyújt azokról a főbb biológiai folyamatokról, amelyekben ezek a fehérjék részt vesznek. Útdúsítási elemzést is végeztünk a Kyoto Encyclopedia of Genes and Genomes (KEGG) útvonal-térképek 31 felhasználásával. Ezenkívül az Ingenuity Pathway Analysis-t (IPA) is használták az interakciós hálózat és a kanonikus útvonalak kiépítéséhez.
Eredmények
Az izolátum mitokondriális frakciójának tisztasági elemzése
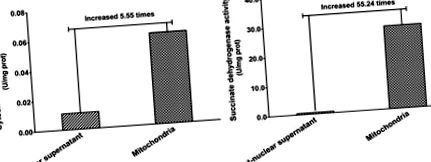
A mitokondriális fehérjék tisztaságát a mitokondriális specifikus marker enzimek aktivitásának értékelésével értékeltük. Amint az az 1. ábrán látható, a citokróm C-oxidáz (mitokondriális marker enzim) aktivitása a mitokondriális frakcióban 5,55-ször nagyobb volt, mint a sejtmag utáni felülúszóban (1A. Ábra). A szukcinát-dehidrogenáz egy másik marker enzim, amely az egyetlen enzim, amely a sejtekben a belső mitokondriális membránhoz kötődik. Eredményeink azt mutatták, hogy a mitokondriális frakcióban a szukcinát-dehidrogenáz aktivitás 55,24-szer nagyobb volt, mint a mag utáni felülúszóban (1B. Ábra). Ezek az eredmények azt mutatják, hogy a mitokondriális frakció hatékonyan gazdagodott, és ezért a mitokondriális minták felhasználhatók a fehérjeelemzéshez 2-DE gélelektroforézissel.
A mitokondrium-specifikus marker enzimek aktivitása.
(A) Citokróm C-oxidáz aktivitás; (B) Szukcinát-dehidrogenáz aktivitás. Az értékek a marker enzimek aktivitását reprezentálják a sejtmag utáni felülúszó és a mitokondriális frakcióban, egy óra/abszorbancia fehérje milligrammjának változásaként kifejezve.
A máj fehérje profilja brojlercsirkékben (-) - HCA-kiegészítőkkel
A (-) - HCA hatása a máj mitokondriális frakciójának fehérje/enzim profiljára brojlercsirkékben.
A nyilak minden gélben különbözően expresszált fehérjéket/enzimeket jeleznek, amelyek legalább 2,0-szeres különbséget mutatnak a kontrollcsoport és a (-) - HCA-val kezelt minták között. A megváltozott foltok jelentőségét mátrix-segített lézeres deszorpciós/repülési ionizációs idő (MALDI-TOF) tömegspektrometriával értékeltük, és az azonosított fehérjéket/enzimeket az 1. táblázat tartalmazza.
A (-) - HCA hatása a máj citoplazmatikus frakciójának fehérje/enzim profiljára brojlercsirkékben.
A nyilak minden gélben különbözően expresszált fehérjéket/enzimeket jeleznek, amelyek legalább 2,0-szeres különbséget mutatnak a kontrollcsoport és a (-) - HCA-val kezelt minták között. A megváltozott foltok jelentőségét mátrix-segített lézeres deszorpciós/repülési ionizációs idő (MALDI-TOF) tömegspektrometriával értékeltük, és az azonosított fehérjéket/enzimeket a 2. táblázat tartalmazza.
Az azonosított fehérjék funkcionális megjegyzései
Az azonosított fehérjefoltok sematikus Venn-diagramja.
Panelek (A, B) a mitokondriális, illetve a citoplazmatikusan differenciáltan expresszált fehérjéket ábrázolják. (a) 1000 mg/kg (-) - HCA csoport, (b) 2000 mg/kg (-) - HCA csoport, (c) 3000 mg/kg (-) - HCA csoport. A diagramot az azonosított fehérjék GoMiner eszközzel történő elemzése után készítettük. Besorolásuk alapján a differenciálisan expresszált fehérjéket választottuk ki a funkcionális elemzéshez.
Az azonosított fehérjék biológiai hálózati elemzése
Annak a metabolikus útnak a tisztázása érdekében, amelyben az azonosított fehérjék részt vesznek, a differenciálisan expresszált fehérjék elemzéséhez KEGG útdúsítási elemzést alkalmaztunk. Az eredmények azt mutatták, hogy az azonosított fehérjék főleg a citrátciklusban, a glikolízis/glükoneogenezisben, a piruvát metabolizmusban, a zsírsav metabolizmusban, a béta-alanin metabolizmusban, az oxidatív foszforilációban és a PPAR jelátviteli folyamatban vettek részt. Fontos, hogy a differenciálisan expresszált fehérjék többsége részt vett az anyagcsere útjaiban (ACO2, ALDH2, ALDH6A1, ATP5H, CPOX, DLD, DLST, DYPS, GLUL, HGD, NDUFA10, NDUFS3, NDUFS8, PC, PCK2, ADSL, BHMT, BP, ECHS1, GAMT, GART, HMGCS2, MAT1A, ME1, PAH, PGK, PDXK, PFAS, TPI1, PDHA1, PDHB, RGN, SDHA, SUCLG2, TST és UQCRC2).
66 különbözőképpen expresszált fehérje felhasználásával épített kanonikus út.
A hálózatot az Ingenuity Pathway Analysis segítségével hozták létre. A piros azt jelzi, hogy a megfelelő fehérje expressziója csökkent, a zöld pedig azt jelzi, hogy a megfelelő fehérje expressziója a (-) - HCA-t kapott brojlercsirkék májában felfelé szabályozódott. A teljes és szaggatott vonal a fehérjék közötti közvetlen, illetve közvetett kölcsönhatást jelöli. A hálózati alakzatokat a jelmagyarázat magyarázza.
Vita
Bár számos tanulmány arról számolt be, hogy (-) - a HCA elősegíti a fogyást 9, 10, elnyomja de novo a zsírsavszintézis 13,32, növeli a lipidoxidációt 14,16 és növeli az energiafelhasználást 33,34, miközben a pontos biokémiai mechanizmus nem teljesen világos. Az emlősöktől eltérően a máj a lipidanyagcsere fő szerve a baromfiban 21,22. Jelen tanulmány a brojlercsirkék globális májfehérje-profilját mutatja be étrendi (-) - HCA-pótlást követően: 40, illetve 26 differenciálisan expresszált fehérjét azonosítottak a mitokondriális, illetve a citoplazmában. Ezek a differenciálisan expresszált fehérjék részletes biológiai információkat nyújthatnak a (-) - HCA brojlercsirkékben kifejtett hatásáról.
Korábbi vizsgálatok kimutatták, hogy a (-) - HCA állatokban és emberekben az ATP-citrát-liáz 19 erős gátlója. Ez az enzim katalizálja a citrát oxaloacetáttá és acetil-CoA-ként való hasítását, és végül korlátozza a zsírsavszintézishez és a lipogenezishez szükséges acetil-CoA egységek elérhetőségét. A mögöttes biokémiai mechanizmusokat azonban nem ismerjük jól; különösen nem állnak rendelkezésre részletes információk a (-) - HCA brojlercsirkékben kifejtett hatásáról. Ebben a tanulmányban a (-) - HCA-kiegészítőket kapott brojlercsirkéknél nem figyeltek meg jelentős változásokat az ATP-citrát-liáz expresszió szintjeiben, ami ellentmond a korábbi jelentéseknek, miszerint a (-) - HCA ennek az enzimnek az inhibitora. Ez az eltérés azért fordulhatott elő, mert a jelen tanulmányban az ATP-citrát-liáz fehérje expressziós szintjét, nem pedig annak aktivitását mutatták ki.
A madármájban a zsírsav-szintáz által a palmitát szintézisének katalizálására használt NADPH nagy részét almasav enzim (ME1) hozza létre. Beszámoltak arról, hogy a máj almas enzim szintje pozitívan korrelál a zsírsavszintézis sebességével, a testzsír százalékával és a hasi zsír százalékával a csibéknél 47. Jelen tanulmányban a (-) - HCA kezelés növelte a NADP-függő ME1 fehérje expressziós szintet brojlercsirkéknél. Így úgy gondoljuk, hogy a (-) - HCA zsírlerakódásra gyakorolt szuppresszív hatása a citoszolos acetil-CoA és a NADPH szintjének csökkenésével járt, amelyek a zsírsavszintézishez szükségesek, keresztül az ME1 fehérje expressziójának gátlása.
Jelen eredményeink azt mutatták, hogy az enoil-CoA hidratáz rövid láncú 1 (ECHS1) fehérje expressziója, amely a zsírsav-anyagcsere 48 béta-oxidációs útjában aktív, a (-) - HCA-kezelés után a brojlercsirkék májában szabályozott volt. . Beszámoltak arról, hogy az ECHS1 csökkentése hozzájárul a máj lipidfelhalmozódásához 49,50. Eredményeink azt is megmutatták, hogy a (-) - HCA kezelés után a brojlercsirkékben a foszfoglicerát kináz 2 (PGK2) fehérje expresszió szintje megnőtt. A glicerin a PGK hatására átalakulhat α-foszfogliceráttá, majd a máj glükoneogén útjába kerül. Így a fenti adatok azt mutatják, hogy a (-) - HCA-szabályozás másik fontos hatása a hasi zsírlerakódásra a zsírsav-béta-oxidáció elősegítése volt keresztül Az ECHS1 fehérje expressziójának szabályozása brojlercsirkékben.
Összefoglalva, a jelenlegi adatok azt mutatják, hogy a (-) - HCA elsősorban a két mechanizmus révén gátolta a brojlercsirkékben a zsírlerakódást: (1) a zsírsavszintézis gátlása keresztül az acetil-CoA-ellátás csökkenése, amelyet főleg a trikarbonsav-ciklus elősegítésével (a PDHA1, PDHB, ACO2, DLST fehérje expressziójának szabályozása) és az ME1 fehérje expressziójának gátlásával értek el; (2) a zsírsav-béta-oxidáció elősegítése az ECHS1 fehérje expressziójának szabályozásával. Továbbá, az IPA kimutatta, hogy ezek a differenciálisan expresszált fehérjék részt vettek a glikometabolizmusban és a lipid anyagcserében, beleértve a PDHA1-et, a PDHB-t, az ECHS1-t és az ME1-et a kanonikus úton, ami biokémiailag releváns (-) - HCA által kiváltott zsírcsökkentő mechanizmust tükrözött a brojlercsirkéknél. Ezenkívül a globális fehérje expressziós elemzés alapot adhat a (-) - HCA mechanizmusának további tanulmányozásához az állatok testtömeg-növekedésének és zsírlerakódásának gátlásában.
további információ
Hogyan lehet idézni ezt a cikket: Peng, M. et al. A zsírlerakódás elnyomása a brojlercsirkékben (-) - hidroxi-citromsav-kiegészítéssel: proteomikai perspektíva. Sci. ismétlés. 6., 32580; doi: 10.1038/srep32580 (2016).
- Előfeltételes folsavpótlás Japánban
- A brojlercsirkék válasza az étrendi szójabab bioaktív peptid- és kokcidium-fertőzésre -
- Keményítő emésztése brojlercsirkékben, gabona diétával - ScienceDirect
- Rick és Morty összefoglalja a The Vat of Acid eddigi legjobb 4. évad epizódját - CNET
- A megfelelő köszvényes kezelésnek alacsonyabb húgysav-kristálylerakódásokhoz kell vezetnie