A gyulladás fékezi a mitokondriális anyagcserét az elhízásban
Tárgyak
Egy ördögi kör, amely összekapcsolja az elhízást a krónikus gyulladással, táplálja a metabolikus szindróma és más rendellenességek kialakulását és súlyosbodását. A mitokondriális energia-anyagcsere modulálása interleukin-1β jelátvitel útján létrehoz egy szökött pozitív visszacsatolási ciklust, amely elősegíti és megerősíti a magas zsírtartalmú étrend következményeit.
Az elhízás gyorsan globális egészségi veszélyt jelent 1. Az Egészségügyi Világszervezet szerint az elmúlt években az elhízás elterjedtsége világszerte elérte a járvány mértékét 2. Ennek a zord fejlődésnek a társadalmi következményei széles skálán mozognak, tekintve, hogy az elhízás szintén fő kockázati tényező a pusztító emberi kórképeknél, és szorosan kapcsolódik hozzájuk, beleértve a szív- és érrendszeri betegségeket, a 2-es típusú cukorbetegséget, a rákot, az anyagcserezavarokat, a demenciát és a felgyorsult öregedést., többek között 2. Így az elhízás komplex fiziológiájának hátterében és fenntartásában rejlő bonyolult jelátviteli utak és molekuláris mechanizmusok megértése sürgető prioritássá válik.
Régóta ismert, hogy a túlsúly sokféle gyulladásos reakciót vált ki 3,4. A hátramenetet is feltételezték; a krónikus szisztémás gyulladás olyan állapot, amely megkönnyítheti a metabolikus szindróma és az elhízás kialakulását 5. Ez utóbbi asszociáció sejtes és molekuláris alapjai azonban nagyrészt megfoghatatlanok maradtak. Ebben a számában Természet immunológia, Zhou és munkatársai (6) azonosítanak egy jelátviteli kaszkádot, amelyet a proinflammatorikus citokin interleukin (IL) -1β vált ki, hogy végső soron csökkentse az energiatermelést és az adipocita mitokondriumokban történő felhasználást (1. ábra). Ez az újonnan alapított társulás lényegében pozitív visszacsatolási hurkot hoz létre, amelynek során a magas zsírtartalmú étrend (HFD) az elhízást és alacsony szintű krónikus gyulladást vált ki, ami viszont gátolja a mitokondriális energia-anyagcserét, hogy tovább fokozza a zsír felhalmozódását és a súlygyarapodást.
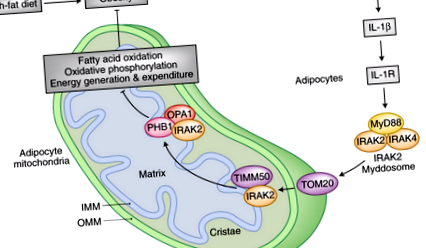
Az elhízás okozta gyulladás gyengíti az adipocita mitokondrium energiatermelését és ráfordítását, tovább súlyosbítva az elhízást. Az IL-1β gyulladásos citokin-jelzés az IL-1R-n keresztül toborozza az IRAK2 – Myddosomát a mitokondriumokba, ahol a külső mitokondriális membránon lévő TOM20 mitokondriális import receptor alegységgel társul. Az IRAK2 ezt követően transzlokál a belső mitokondriális membránra, ahol kölcsönhatásba lép a belső membrán transzlokáz TIMM50 alegységével. Míg a belső mitokondriális membránnál az IRAK2 megköti a PHB1 banitin komplex alegységet. A PHB1-gyel való asszociáció megkönnyíti az IRAK2 és a mitokondriális dinamin-szerű GTPáz OPA1 kölcsönhatását. Az IRAK2 PHB1-hez és OPA1-hez való kötődése megváltoztatja a belső mitokondriális membrán cristae morfológiáját, és zavarja a légzési komplexek kialakulását és működését. Ennek eredményeként az adipociták oxidatív foszforilációja és zsírsav-oxidációja csökken. Ezenkívül a termogenezishez hozzájáruló, nem kapcsolt mitokondriális légzés károsodik, csökkentve az energiafogyasztást a barna zsírszövet sejtjeiben. Így az IRAK2 kulcsfontosságú eleme a pozitív visszacsatolási mechanizmusnak, amely a mitokondriális energia-anyagcserét elkerüli, hogy végső soron növelje a zsír felhalmozódását és az elhízást.
A gyulladást az elhízással összekötő korábbi jelentésekkel összhangban a szerzők azt találták, hogy az IL-1β szint sokkal magasabb a HFD-vel táplált egerek zsírszövetében, mint az alacsony zsírtartalmú étrendet fogyasztó kontroll állatoké. A megnövekedett IL-1β a mitokondriális oxidatív foszforilációt zavarja azáltal, hogy elnyomja a légzési lánc szuperkomplex képződését, anélkül, hogy befolyásolná a mitokondriális fiziológia és a homeosztázis egyéb aspektusait, mint például a mitofágia, a reaktív oxigénfajok (ROS) termelése, a kalciumszivárgás vagy a citokróm c kiadás. Az I – IV légzési lánc komplexek szuperkomplexekké szervezése a belső mitokondriális membránban (IMM) fontos az energiatermeléshez szükséges protongradiens létrehozásához és fenntartásához. Következésképpen az ATP termelés és a kapcsolódó oxigénfogyasztás, valamint a zsírsav oxidáció (FAO) csökken az adipocitákban az IL-1β stimuláció hatására.
Hogyan idézi elő ezeket a változásokat az adipocita mitokondriális energia-anyagcserében az IL-1β? Az interleukin 1 receptort (IL-1R) az IL-1β aktiválja, és felveszi a MyD88-at, egy veleszületett immunitás szignál transzdukciós adaptert, amely megköti mind az IL-1R, mind a Toll-szerű receptor (TLR) komplexeket 7. Az IL-1R eliminációja adipocitákban enyhítette az IL-1β kezelés hatását az adipocita mitokondriumokra. Ezenkívül azok az egerek, amelyeknél a MyD88 hiányzik kifejezetten a zsírszövetben, javított rezisztenciát mutattak a HFD káros hatásaival szemben. Ezek az állatok soványabbak voltak, és megnövekedett barna zsírszövet (BAT) termogén kapacitásuk volt, kevesebb lipidfelhalmozódással és megnövekedett FAO-val az adipocitákban. Figyelemre méltó, hogy a MyD88 kimerülése az IMM kiterjedt átalakulását idézi elő az adipocitákban, fokozott cristae képződéssel és ezzel együtt fokozott légzési lánc szuperkomplex szereléssel. Ezek az eredmények azt mutatják, hogy az IL-1β jelátvitel mitokondriális adaptációkat vált ki, amelyek csökkentik az adipociták energiafelhasználását.
Az IRAK2 hiányos egerek lényegesen jobban ellenálltak a káros HFD-nek. Ezek az állatok a MyD88-hiányos mutánsokat összegezték a súlygyarapodás, az inzulinérzékenység és a zsírszövet-fiziológia szempontjából. Hasonlóképpen, megnövekedett FAO- és termogén génexpresszió mutatkozott a kriszta kiterjedése mellett a zsírszöveti mitokondriumokban. Ezenkívül a MyD88 vagy az IRAK2 eltávolítása elősegítette a légzési lánc szuperkomplex képződését és a megnövekedett energiafelhasználást, különösen a BAT mitokondriumokban, ahol a legtöbb termogenezis úgy valósul meg, hogy leválasztják az elektrontranszportláncot az ATP-termelésről, és az elektrokémiai protongradiens energiát hővé disszipálják 10. Ennek eredményeként ezek az állatok magasabb testhőmérsékletet és csökkent lipidfelhalmozódást mutattak. Ezek a megfigyelések együttesen azt mutatják, hogy a HFD fékezi a mitokondriális energia-anyagcserét a MyD88 és az IRAK2 segítségével, ami tovább súlyosbítja az elhízást.
Most felmerül a kérdés, hogy az IRAK2 hogyan látja el szabályozó funkcióját a mitokondriális légzési lánc szuperkomplex szerelésén? A szerzők a mitokondriális állványfehérje-banitin 1-t (PHB1) azonosították az IRAK2 interaktoraként az IMM 6-on. A PHB1 és a kapcsolódó protein-banitin 2 (PHB2) az IMM nagy, gyűrűszerű makromolekuláris szerkezetének alegységei, amelyek a mitokondriális biogenezistől az inzulin – inzulinszerű növekedési faktor 1 (IGF1) jelátvitelig, a rákig és az öregedésig terjednek 11, 12. Fontos, hogy a baninok a cristae morfogenezisében is szerepet játszanak azáltal, hogy szabályozzák az optikai atrófia protein 1 (OPA1), a mitokondriális fúziós mechanizmus komponenseként szolgáló dinaminszerű GTPáz feldolgozását13. Az IRAK2 és a PHB1 asszociációja IL-1β stimuláció után szintén toborozza az OPA1-et a komplexbe. Az IRAK2 és PHB1 által végzett OPA1 szekvenálás következtében a cristaák destabilizálódnak és a légzési lánc szuperkomplex képződése csökken. Ebben az összefüggésben a PHB1 megkönnyíti az IRAK2 és az OPA1 kölcsönhatását. Ennek megfelelően a PHB1 elvesztése enyhíti a mitokondriális energia-anyagcsere IRAK2-közvetített mértékű mérséklését, amelyet az IL-1β stimuláció okoz az adipocitákban.
Nevezetesen az IRAK2 foszforilezésére van szükség annak megfelelő lokalizálásához a TIMM50-gyel az IMM-ben, valamint a PHB1-gyel és az OPA1-gyel való kölcsönhatáshoz. Az IRAK2 kináz funkciójának inaktiválása kiküszöbölte az IL-1β kezelés hatását a mitokondriális energia anyagcserére. Míg a kináz-inaktív variáns még mindig asszociál a TOM20-val, és IL-1β stimulációval belép a mitokondriumba, az IRAK2 foszforiláció megszűnik, ami arra utal, hogy az IRAK2 autofoszforilálódik. Ez a módosítás a TIMM50-tel való interakció és a PHB1 – OPA1-hez való kapcsolódás előfeltétele. Mint ilyen, elengedhetetlen az IRAK2-szuppresszív funkciókhoz a mitokondriumokban. A kináz-inaktív IRAK2 mutáns állatok fenotípusa teljes mértékben megerősíti ezt az eseményláncot, és nagymértékben hasonlít az IRAK2 knockout egerekéhez. HFD-nek vetve ezek az állatok karcsúbbak és kevésbé inzulinrezisztensek. Ezenkívül megnövekedett FAO aktivitást és légzési lánc szuperkomplex képződést, valamint magasabb testhőmérsékletet mutatnak, ami a fokozott termogenezisre és az energiafelhasználásra utal a BAT-ban.
Zhou és munkatársai eredményei együttesen egy váratlan jelzési tengelyt tárnak fel, amely meghatározza a mitokondriális aktivitást az adipocytákban azáltal, hogy a proinflammatorikus IL-1β jeleket továbbítják a Myddosome és az IRAK2 segítségével a légzési lánc szuperkomplex képződésének modulálása érdekében, ezáltal befolyásolva az energiatermelést és a ráfordítást. Fontos, hogy ez a transzdukciós kaszkád pozitív visszacsatolási hurkot hoz létre, amely felerősíti a HFD káros hatásait és súlyosbítja az elhízást (1. ábra). Hasonló molekuláris mechanizmus vezérelheti a mitokondriális energia anyagcserét az emberi zsírszövetben. A HFD valóban alacsony szintű gyulladást és a proinflammatorikus citokinek, köztük az IL-1 szekrécióját okozza az emberekben 18. Ezenkívül más tanulmányokkal 19 összhangban a szerzők azt találják IL1B a génexpresszió nagyobb a cukorbetegek 6 zsírszövetében. Ezért Zhou és munkatársai tanulmánya bőséges lehetőséget kínál az IRAK2-re és az adipocitákban újonnan felfedezett út más komponenseire irányuló lehetséges beavatkozási stratégiák vizsgálatára, az emberi elhízás és a kapcsolódó anyagcserezavarok enyhítése céljából.
Hivatkozások
Blüher, M. Nat. Rev. Endocrinol. 15, 288–298 (2019).
Egészségügyi Világszervezet. Elhízottság https://www.who.int/topics/obesity/en/ (2020).
Stolarczyk, E. Curr. Opin. Pharmacol. 37, 35–40 (2017).
- Gyulladás, elhízás és trombózis Blood American Society of Hematology
- Az IRhom2 elősegíti az elhízást azáltal, hogy fokozza a zsírgyulladást és az inzulinrezisztenciát
- Az anyák elhízása megzavarja a hipotalamusz fejlődését Nature Review Endocrinology
- Leptin, ideggyulladás és elhízás - Kivonat - Endokrin immunológia - Karger Publishers
- Orvosi eszközök elhízás kezelésére Természet Vélemények Gasztroenterológia; Hepatológia