A hem-oxigenáz-indukció elnyomja a máj hepaticidjét, és megmenti a Ferroportin és a Ferritin expresszióját elhízott egerekben
Nitin Puri
1 Fiziológiai és Farmakológiai Tanszék, Toledo Egyetem Orvostudományi Főiskola, Toledo, OH 43614, USA
Jevgenyij Arefjev
2 Orvostudományi Intézet, Weill Cornell Medicine/NYP Brooklyn Methodist Hospital, Brooklyn, NY 11215, USA
Robert Chao
2 Orvostudományi Intézet, Weill Cornell Medicine/NYP Brooklyn Methodist Hospital, Brooklyn, NY 11215, USA
David Sacerdoti
3 Klinikai és Kísérleti Orvostudományi Tanszék, Padovai Egyetem, Padoua, Olaszország
Hibba Chaudry
4 Orvostudományi és Élettani Tanszék, Marshall Egyetem Orvostudományi Kar, Huntington, WV, USA
Alexandra Nichols
4 Orvostudományi és Élettani Tanszék, Marshall Egyetem Orvostudományi Kar, Huntington, WV, USA
Srikanthan Krithika
4 Orvostudományi és Élettani Tanszék, Marshall Egyetem Orvostudományi Kar, Huntington, WV, USA
Athar Nawab
4 Orvostudományi és Élettani Tanszék, Marshall Egyetem Orvostudományi Kar, Huntington, WV, USA
Dana Sharma
4 Orvostudományi és Élettani Tanszék, Marshall Egyetem Orvostudományi Kar, Huntington, WV, USA
Vishal Hari Lakhani
4 Orvostudományi és Élettani Tanszék, Marshall Egyetem Orvostudományi Kar, Huntington, WV, USA
Rebecca Klug
4 Orvostudományi és Élettani Tanszék, Marshall Egyetem Orvostudományi Kar, Huntington, WV, USA
Komal Sodhi
4 Orvostudományi és Élettani Tanszék, Marshall Egyetem Orvostudományi Kar, Huntington, WV, USA
Stephen J. Peterson
2 Orvostudományi Intézet, Weill Cornell Medicine/NYP Brooklyn Methodist Hospital, Brooklyn, NY 11215, USA
Absztrakt
3.2. Redox-egyensúly a sovány és elhízott egerek májszövetében, a CoPP hiányában vagy jelenlétében
3.3. Vas homeosztázis sovány és elhízott egerekben, CoPP-vel és anélkül kezelve
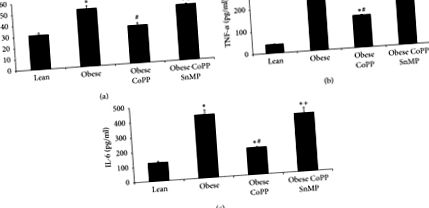
Amint a 3. (a) ábrán látható, a máj hepcidin expressziója szignifikáns volt (p 3. ábra (b)). A redukált ferroportin megkönnyíti a sejtek túlterhelését, ezáltal aktiválva a vasra reagáló gének, köztük a ferritin transzlációját. Azonban elhízásképpen a máj ferritinszintje lényegesen alacsonyabb volt az elhízott egerekben (p 3 (c) és 3 (d)). CoPP-kezelés megmentve (p 3 (a) - 3 (d)).
A HO-1 indukció hatása a sovány és elhízott egerek májának hepcidin, ferroportin és ferritin szintjére. (a) Hepcidin mRNS szintje, (b) ferroportin fehérje szintje, valamint ferritin mRNS és fehérje szintje a (c), illetve (d) pontban. Az eredmények átlag ± SEM. n = 3-4, ∗ p # p + p 4. ábra (a)). Ezt a csökkenést gátolta a CoPP beadása, míg a CoPP és az SnMP együttes adása visszaadta szintjüket a kezeletlen elhízott expresszióhoz (4. ábra (a)). Hasonló eredményeket figyeltek meg az 1466 tirozinnál és az 1322 tirozinnál foszforilezett máj inzulin receptor expressziójában (4. (b) és 4. (c) ábra).
A CoPP és az SnMP adagolásának hatása az UCP-1 és az UCP-2, valamint az Mfn-1 és Mfn-2 fehérje szintre a sovány és elhízott egerek májában. Reprezentatív blotok és a hozzájuk tartozó grafikonok, amelyek az (a) UCP-1, (b) UCP-2, (c) Mfn-1 és (d) Mfn-2 β-aktinjához viszonyított densitometriai elemzést ábrázolják. Az eredmények átlag ± SEM, n = 3-4, ∗ p # p •), a Fenton reakció. A hidroxil gyök a biológiai rendszerek egyik legreaktívabb szabad gyöke, és diffúziós határa közelében reagál. Membrán károsodást, DNS és RNS fragmentációt és lipid peroxidációt okozhat, miközben hozzájárul a redox egyensúlyhiányhoz [34].
Egy vassal teli sejtben a vas feleslege transzmembrán fehérje, a ferroportin útján kerül ki a sejtből. Krónikus gyulladásos állapotokban, például elhízásban, a hepcidin által kiváltott citoplazmatikus újrafeldolgozásban és a ferroportin lizoszómális lebontásában csapdába kerül a felesleges vas a sejtben [5–7]. Ez a szabad vas egy [4Fe-4S] klasztert képez az 1 vas-szabályozó fehérjével (IRP1), így leválasztva a vas-válasz elemektől (IRE) [35]. Az IRP1 ellenőrzi a vasra reagáló gének több mRNS-jének transzlációját és/vagy stabilitását azáltal, hogy a nem transzlált régióikban a vasra reagáló elemekhez kötődik. A ferritin képes több ezer vas-ion megkötésére, ezáltal távol tartva az oldattól. Az intracelluláris vas túlterhelés, a ferroportin downreguláció következménye, poszttranszkripcionálisan aktiválja a ferritin expresszióját azáltal, hogy az IRP1 gátló hatásából származik [36]. A vas prooxidáns tulajdonságai azonban a vas túlterhelt sejtjeit redox egyensúlyhiányra hajlamosítják. Ez a vas által kiváltott oxidatív stressz destabilizálhatja a kubán [4Fe-4S] klasztereket [37].
A vas-felhalmozódással párhuzamosan a ferritin-szabályozás központi szerepet játszik a vas homeosztázisának fenntartásában. A ferritin azon kívül, hogy tartsa a vasat a citoszolban lévő oldatból, antioxidáns [38] és gyulladáscsökkentő tulajdonságokkal is rendelkezik [39].
Az ebben a tanulmányban bemutatott második legfontosabb megállapítás a HO-1 elősegítő szerepét határozza meg a celluláris ferritin szintekben. A ferritin expressziójának megmentése CoPP-vel kezelt egerekben kiemeli a HO-1 által közvetített antioxidáns hatás szerepét a ferritin felülszabályozásának lehetővé tételében a sejtszintű vas túlterhelés esetén. A HO-1 antioxidáns tulajdonságait nagyrészt a BV keletkezésének tulajdonítják, amely a lipidperoxidáció csillapításával csökkenti az oxidatív stresszt. A redox homeosztázis BV-függő helyreállítása ellensúlyozhatja az ROS IRP- [4Fe-4S] komplexre gyakorolt gátló hatását, ezáltal lehetővé téve az IRP-1 leválasztását és a ferritin mRNS transzlációját. Következésképpen a vas által indukált oxidatív stresszt elnyomó ferritin ezen körkörös hurokját, amely a szabad vas megnövekedéséhez vezet, ami viszont fokozza a ROS-termelést, a HO-1-es szabályozás megszakítja.
A ferritin-expresszió csökkentésének másik lehetősége lehet az elhízás gyulladásos környezete. Valószínű, hogy a gyulladásos citokinek egy még ismeretlen mechanizmus révén megzavarhatják a ferritin szabályozását. Ez lehet az oxidatív redox állapot és a gyulladásos közeg kölcsönhatása is. Mindenesetre a HO által indukált ferritin-mentés meglehetősen figyelemre méltó, és kapcsolódhat akár a antioxidánshoz, akár a gyulladáscsökkentőhöz, vagy a HO független hatásához. Bár a CoPP hatással lehet a sejtek más jelátviteli útjaira, a HO által közvetített ferritinmentés következtetéseinket megerősíti az a tény, hogy a HO-inhibitor képes blokkolni a ferritinmentést CoPP-vel kezelt elhízott egerekben. Ezen következtetések másik lehetséges korlátja az a tény, hogy nem mértük a plazma ferritin vagy transzferrin szintjét. Nem valószínű, de lehetséges, hogy a sejtek szintje eltér a plazmában levőktől.
A fokozott ROS-generáció hozzájárul az inzulinrezisztenciához és a downstream metabolikus célpontok, azaz az AMPK, az LKB1 és az AKT diszregulációjához. Ismeretes, hogy a P-AMPK a sejtek túlélésének szabályozásában jár, véd az oxidatív stressz ellen, és aktiválásakor hozzájárul a glükóz transzportjához, a zsírsav oxidációjához és a megnövekedett mitokondriális funkcióhoz. Az LKB1 egy szerin-treonin kináz, amely közvetlenül foszforilálja az AMPK-t és javítja a glükóz toleranciát. A máj AMPK aktiválása megkönnyíti az inzulinfüggő glikoneogenezis gátlását [40]. Az LKB1 foszforilációjának redoxfüggő csillapítása [41] megakadályozta az AMPK aktiválódását elhízott egerekben. Az AMPK-aktiváció hiánya növeli a máj glükóztermelését és hozzájárul a hiperglikémiához, miközben elősegíti az inzulinrezisztenciát.
Úgy tűnik, hogy ez nem jelenti a NAFLD emberekben történő bemutatását. Az Egyesült Államok lakosságának kétharmada túlsúlyos vagy elhízott [54]. Az USA lakosságának 30% -a rendelkezik NAFLD-vel. A szérum ferritin az előrehaladott fibrózis és még a szövettani súlyosság független előrejelzője a NAFLD-ben [55, 56]. Úgy tűnik, hogy a vas metabolizmusa megváltozott a NAFLD-ben. A legtöbb étel glükózt és vasat tartalmaz, ami hiperglikémiát, cukorbetegséget és vas túlterhelést eredményez [57]. Ez a vas túlterhelés serkenti a hepcidin szekrécióját. Nem világos, hogy a fokozott hepcidin-szekréció az elhízás gyulladásából vagy a vas túlterhelésének gyulladásos hatásaiból származik-e, vagy mindkettőből. Ezeknek a betegeknek csak 20% -ában emelkedett a ferritin szintje, ami előrehaladott májfibrózissal jár [55].
Nyilvánvaló, hogy tanulmányunk eredményei azt mutatják, hogy a vas metabolizmusa megváltozott a NAFLD-ben. Nem világos, hogy a ferritin hogyan változik a normális májban védő szerepből az előrehaladott fibrózis független előrejelzőjévé. Több munkát kell elvégezni a vas-anyagcsere-változások dilemmájának feltárása érdekében a NAFLD-ben.
Eredményeink azt mutatják, hogy a krónikus alacsony fokú gyulladás és az oxidatív stressz elősegíti a máj hepcidin szekrécióját, ami ezután gyengíti a sejtek ferroportin szintjét. Ezek az események vas túlterhelést idézhetnek elő a sejtben, amelynek prooxidáns tulajdonságai súlyosbítják az anyagcsere egyensúlyhiányát és megzavarják a ferritin szabályozását. A HO-1 indukció gyengíti a máj hepcidin szintézisét és helyreállítja a redox egyensúlyt. Következésképpen a ferroportin és a ferritin expressziójának megmentése ellensúlyozza a sejtek túlterhelését és enyhíti a vas által kiváltott oxidatív stresszt. A HO-1 indukció kóros fiziológiai hatása magában foglalja a mitokondriális energia javítását és az egér metabolikus profiljának általános javulását. Az alkoholmentes zsírmáj és az alkoholmentes steatohepatitis egérmodelljeivel kapcsolatos jövőbeni vizsgálatok további bizonyítékokkal szolgálhatnak a HO-indukció szerepének alátámasztására ezen anyagcserezavarok kezelésében.
Köszönetnyilvánítás
Ezt a munkát a Toledói Egyetem Orvostudományi Főiskolája, a Marshall Egyetem Orvostudományi Kar és a New York-i presbiteri brooklyni metodista kórház támogatta. Minden szerző elolvasta és egyetért a leírt kézirattal. A szerzők köszönetet mondanak Jennifer Brownné szerkesztői segítségéért a kézirat elkészítésében. A szerzők köszönetet mondanak Dr. Shailendra P. Singh és Lars Bellner kiemelkedő segítségükért.
Közzététel
Ennek a munkának egy korábbi változatát poszterként mutatták be az American Heart Association 2016. évi magas vérnyomásért felelős tudományos tanácsának ülésén, valamint a Marshall Egyetem 2017. évi 29. éves kutatási napján.
- Veszélyes étrend-kiegészítők Transzplantációt igénylő Garcinia cambogia-val összefüggő májelégtelenség
- Egészséges fogyás Sanyasi Ayurveda fogyás gyógyszer mellékhatások hindi nyelven press Elnyomja
- Gyors fogyókúrás fogyókúrás laboratórium press elnyomja az étvágyat és gyors fogyást biztosít C - CREA-RS
- A Chaga gomba (Inonotus obliquus) vizes kivonatának folyamatos bevitele elnyomja a rákot
- Az elektromos izomstimuláció működik-e-Stim