A méhben Későbbi adipozitás programozása: A magzati növekedés korlátozásának szerepe
1 Szülészeti és Nőgyógyászati Osztály, Gyermekegészségügyi Kutatóintézet és Lawson Kutatóintézet, University of Western Ontario, 1151 Richmond Street, London, ON, Kanada
2 Dental Science Building, 2027-es szoba, University of Western Ontario, 1151 Richmond Street, London, ON, Kanada
Absztrakt
1. Bemutatkozás
Az elhízás a zsírszövet túlzott felhalmozódására utal, és az Egészségügyi Világszervezet (WHO) testtömegindexként (BMI: súly (kg)/hosszúság (m 2)) határozza meg, amely nagyobb vagy egyenlő 30 [1]. Az elhízást súlyos egészségügyi problémának nyilvánították, és 1980 óta világszerte több mint kétszeresére nőtt, 2008-ban a WHO szerint több mint 200 millió férfit és közel 300 millió nőt soroltak elhízottnak. Az elhízás számos káros egészségügyi következménnyel jár, beleértve a 2-es típusú cukorbetegséget, az inzulinrezisztenciát, a magas vérnyomást, a szív- és érrendszeri betegségeket és bizonyos rákos megbetegedéseket [2, 3]. A becslések szerint az elhízáshoz kapcsolódó közvetlen költségek az ország teljes egészségügyi kiadásainak 0,7–2,8% -át teszik ki, az elhízott személyek egészségügyi költségei körülbelül 30% -kal nagyobbak, mint normális testsúlyú társaiké [4]. Így a fejlett országokban az elhízással kapcsolatos társadalmi és gazdasági költségek ma már jól felismerhetők.
Beszámoltak arról, hogy az elhízás és az azzal összefüggő betegségek megelőzésére és kezelésére szolgáló jelenlegi beavatkozási stratégiák a posztnatális életre korlátozódnak, a testedzésre, a sóbevitelre, az étrendi beavatkozásokra és a dohányzásról való leszokásra összpontosítva [5]. Ezeknek a beavatkozásoknak csak korlátozott sikere van, és nem meglepő, hogy az elhízás és az ahhoz kapcsolódó betegségek elleni küzdelem, különösen a gazdag iparosodott országokban, jelenleg elbukik. Gluckman és Hanson [5] szerint fontos a terhesség alatt az anyák egészségi és táplálkozási problémáira összpontosítani, amelyek ma már fontos szerepet játszanak az elhízás kialakulásában.
Ebben az áttekintésben összefoglaljuk a mellékhatásokat összekötő epidemiológiai és állatkísérleteket a méhben környezetekben, különösen az IUGR-ben, a postnatalis zsírszövet-felhalmozódásig. Kiemeljük továbbá az IUGR és a zsírszövet hosszú távú terjeszkedése közötti kapcsolatok mögött álló lehetséges mechanizmusokat, és néhány ötletet kiemelünk az IUGR modellek további kutatásához.
2. A magzati programozási koncepció
3. Zsírszövet
3.1. A zsírszövet különböző típusai
Kétféle zsírszövet, a fehér zsírszövet (WAT) és a barna zsírszövet (BAT) létezik együtt a legtöbb emlősfajban. A WAT-nak alapvető szerepe van az energiatárolásban azáltal, hogy hosszú távú üzemanyag-tartalékot biztosít triacil-glicerin formájában, amely az élelmiszer-nélkülözés során mobilizálható zsírsavak felszabadításával más szervek oxidációjához [18]. A BAT ezzel szemben az energia eloszlatására specializálódott hőtermelés révén [19].
Emlősökben a WAT egyenetlenül oszlik el a testen, és két fő zsírraktár képviseli őket, amelyeket elhelyezkedésük határoz meg: szubkután és zsigeri [30]. Embereknél a szubkután depók a bőr alatti zsírszövetből állnak, elsősorban a fenékben, a combban és a hasban. A zsigeri zsírszövetraktárak közé tartoznak a mesenterialis, omentális, perirenalis, retroperitoneális és pericardialis zsírraktárak [31]. Juhoknál, a felnőttkori elhízás nagy állatmodelljénél a WAT az omentális, a szubkután és a hátsó lábakon található [32–34]. A rágcsálók (patkányok és egerek) WAT-raktára két fő szubkután zsírraktárban létezik, az egyik elülső és egy hátsó, diszkrét anatómiai helyeken fekszik [35]. Az elülső depó összetett, elfoglalja a lapockák közötti és alatti háti testrégiót, az elülső végtagok axilláris és proximális régióit, valamint a nyaki területet. A hátsó depó a hátsó lábak tövében, valamint a dorsolumbalis, inguinalis és fenékrészeken helyezkedik el. A zsigeri zsírraktárak az emberhez hasonlóan a mellkasi és a hasüregekben helyezkednek el: mediastinicus, mesenterialis, retroperitoneális, perirenalis és perigonadalis depók.
A zsírszövet második típusa, a BAT, az energia eloszlására specializálódott hőtermelés révén [19]. Jellemzője, hogy a WAT-hoz képest sötét színű, ami vaszkularizációjából és számos mitokondriumból fakad [36, 37], és úgy tűnik, hogy sűrűbb az idegellátása, mint a WAT-nak [38]. A BAT-ban a multilokuláris zsírsejtek általában sok kis lipid vakuolt és nagy mitokondriumot tartalmaznak, szorosan összepakolt párhuzamos cristaákkal [39, 40], ahol az 1. szétkapcsolódó fehérje (UCP1) erősen expresszálódik, és BAT-specifikus markernek tekinthető [41]. . Az UCP1-gyel együtt számos más gén, köztük a 2-es típusú jodotironin-jód-dináz, a transzmembrán glikoprotein Elovl3, a zsírsavval aktivált transzkripciós faktor peroxiszóma-proliferátor-aktivált receptor-α (PPARα), a nukleáris koaktivátor peroxiszóma proliferátor által aktivált receptor-γ koaktivátor 1α (PGC-1α), és a HoxA1 és HoxC4 fejlődési homeobox géneket előnyösen BAT-ban fejezik ki [37, 42]. Összehasonlításképpen: a leptin, a RIP140 mag-corepresszor, a fibrillin-1 mátrixfehérje és a fejlődő humán HoxA4 és HoxC8 gének expressziója BAT-ban alacsony a WAT-ban megfigyelt nagyobb expressziójukhoz képest [37, 42].
Régóta feltételezik, hogy a fehér és a barna adipociták közös fejlődési eredetűek, és nagyon hasonló morfológiai differenciálódási programon mennek keresztül, amelyet PPAR vezérel.γ és a C/EBP transzkripciós faktorok családjának tagjai [43]. A legújabb kutatások azonban azt mutatják, hogy a barna adipociták a központi dermomyotomában lévő tripotens, bekötött-1-expresszáló sejtekből származnak a PRD1-BF-1-RIZ1 homológ doméntartalmú protein-16 (PRDM16) dinamikus részvételével [43, 44]. Ezenkívül a PRDM16 koaktiválja a PGC-1 transzkripciós aktivitásátα, PGC-1β, PPARα, és a PPARγ közvetlen interakció révén, és ezáltal a preadipocyták fejlődése barna adipocitákká válik [43]. Ez a differenciális eredet valószínűleg meghatározó a BAT és a WAT emlősök evolúciós szerepére nézve.
Az emberi magzatban és újszülöttben a BAT főként a nyaki, hónalji, perirenális és periadrenális depókban található [45, 46], és fontos szerepet játszik az újszülöttek életében nem rezgő hőtermelésben, és így védelmet nyújt a halálos hideg hatásának (hipotermia) ellen. . Felnőtteknél a BAT raktárai a nyaktól a mellkasig terjedő régióban találhatók, különösen interscapularis, supraclavicularis, cervicalis, axilláris és paravertebralis régiókban [47, 48], és ezek a depók ma már a testtömeghez kapcsolódnak. rendelet [49]. Összehasonlításképpen, a rágcsálókban a BAT főleg a hátsó felső régióban helyezkedik el (interscapularis BAT) [50], és először a vemhesség utolsó napjaiban jelenik meg, az újszülött korában érik meg, és az állatok élettartama alatt viszonylag stabil szinten marad [51]. A BAT a szubkután elülső depóban, valamint a normál körülmények között fenntartott felnőtt rágcsálók mediastinicus és perirenalis helyein is látható [35]. Más fajokban egészen más a helyzet. Például a bárányok szinte 100% -os BAT-val születnek [52, 53], ennek a zsírszövetnek a többsége a vesék körül helyezkedik el [33, 34]. A fiatal életben posztnatálisan a BAT lokalizációja a perirenalis depó mellett a szegycsont, a clavicularis, a pericardialis és az epicardialis depóvá válik [34].
3.2. A zsírszövetek ontogenitása
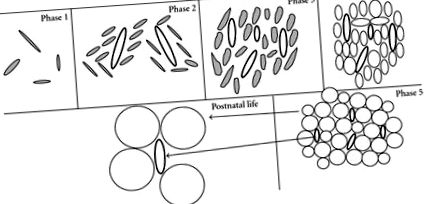
A zsírszövet fejlődési szakaszai (Brooks és Perosio [17] adaptálva). 1. fázis: amorf őrölt anyagból és csillagképes sejtekből álló laza kötőszövet megjelenése (iktatott). 2. fázis: A mezenhimális sejtek aggregációi (iktatott) kondenzálódnak a szaporodó primitív erek (vastag oválisok) körül. 3. fázis: a mezenhimális sejtek a glomeruluson belül sztellátott preadipocitákká differenciálódnak. 4. fázis: a kapillárisok körül szorosan összepakolt, több kis lipidcseppekkel rendelkező adipociták megjelenése. 5. fázis: Nyilvánvaló a zsírlebeny sok egysejtű sejttel (tiszta körök). Ez a fejlődési folyamat (1–5. Fázis) a 14–23 hetes terhességi időszak között megy végbe. 23. és 29. hét között a zsír lobulák száma viszonylag állandó. A 23. és 29. hét között, valamint az egész posztnatális élet során a zsírszövet növekedését főként az adipocita hipertrófiából és a zsíros kapillárisok megnagyobbodásából eredő zsírlobulák méretének növekedése határozza meg.
Összehasonlításképpen, a prenatális WAT differenciálódás három különálló szakaszát feltételezik patkányokban [56]. Az 1. szakaszban a nagy kapillárisok ritka hálózata alakul ki. A 2. szakaszban a sejtek többsége orsó alakú sejt, és a környező kötőszövet nagyon kevés eret tartalmaz, amelyet kapilláris ágy képződik. A 3. stádiumot érett kapilláris ágy és lekerekített adipociták jellemzik. A legkorábbi embrionális szubkután zsírsejteket a vemhesség 15-16. Napján (a vemhesség hossza) detektálják
21–23 nap) [57]. A perirenalis zsírszövet patkányokban főleg a születés körül jelenik meg, vagyis 12 órával a születés előtt és után [58]. Csak két-öt nap választja el az első perirenalis zsírsejtek képződését és az utóbbit fejlesztő mesenterialis zsírsejtek megjelenését. Ennek következtében minimális mennyiségű zsírszövet (1%) rakódik le a születés előtt, és ennek a szövetnek az érése elsősorban posztnatálisan történik [59].
Patkányokban a barna adipocita prekurzorok a kapillárisok hálózatához szorosan kapcsolódó parenhimális orsósejtek [60]. Amint a sejtek és az erek szaporodnak, a kötőszöveti septák lebenyekké szerveződnek. Amikor a sejtek elkezdik felhalmozni a lipideket, kezdetben egyszeműek, de további lipidfelhalmozódással több citoplazmatikus lipid vakuola jelenik meg. A BAT képződése a patkány lapockájában zajlik a vemhesség 15–17. Napja között [60, 61], és az egész életen át jelen van [50]. Az emberi vizsgálatok nem olyan specifikusak, mint patkányokon; tanulmányok azonban azt sugallják, hogy a magzati BAT a terhesség körülbelül 23. hetében megfigyelhető a nyaki, mellkasi és hasi zsigerekben, valamint a vállövben és a nyakon [62].
A posztnatális környezetben a zsírszövet kitágulása főként születés után következik be az adipocita méretének növekedésével és a zsíros kapillárisok megnövekedésével (1. ábra) olyan enzimek hatására, mint a lipoprotein lipáz, amely az adipocita lipid töltés szabályozója [63, 64]. A születést követő adipocita hiperplázia korlátozottnak tűnik; A tanulmányok azonban beszámolnak az adipociták megújulásának aktiválódásáról [65], ami arra utal, hogy a WAT és a BAT emberekben, valamint rágcsálókban továbbra is tartalmaznak prekurzor sejteket, amelyek felnőttkorban képesek differenciálódni adipocitákká [66–68].
4. Az IUGR hosszú távú következményei a zsírszövet fejlődésére
Az IUGR-t vagy a magzati növekedési korlátozást (FGR), amely olyan magzatra utal, amely nem képes kielégíteni genetikai növekedési potenciálját, a terhességi életkor 10-es vagy annál alacsonyabb súlya jellemzi, és világszerte a terhességek körülbelül 7–15% -át érinti [69]. Az IUGR és az elhízás posztnatális fejlődése közötti összefüggést emberi epidemiológiai vizsgálatokban és állatmodellekben jelentették [70, 71], és ezek kölcsönhatását feltételezik, hogy jelentősen hozzájárulnak a jelenlegi globális elhízási járványhoz [5, 70].
4.1. Az IUGR és az alacsony születési súly hatása a zsírszövet hosszú távú expanziójára állatmodellekben
4.2. Az ember alacsony születési súlya és későbbi zsírszövet felhalmozódása
Az első tanulmányok a magzati növekedés korlátozása következtében az alacsony születési súlyt vizsgálták, ami a zsírszövet későbbi növekedését eredményezte felnőtteknél, az 1944-1945 közötti holland éhínség nyomán született utódok tanulmányaiból származó adatokat használták fel [87]. A terhesség első felében az éhínségnek való kitettség alacsony születési súlyt eredményezett, és ez szignifikánsan összefüggésbe hozható a magasabb elhízási arányokkal, valamint a csonka- és hasi zsírok nagyobb eloszlásával a 19 éves férfiaknál. Ennek a kohorsznak egy későbbi tanulmánya azt jelentette, hogy a terhesség korai szakaszában (az első trimeszterben) éhínségnek kitett 50 éves nőknél magasabb a BMI és a derékbőség, mint a nem kitett nőknél [12]. Az alacsony születési súly és a későbbi zsírosság közötti összefüggést kiemelik az Egyesült Államok bietnikus (mexikói-amerikai és nem spanyol fehér) populációján végzett vizsgálatok is. Ezekben a vizsgálatokban azoknak a normotenzív és nem cukorbeteg felnőtteknek, akiknek születési súlya a legalacsonyabb tertilitásban volt, szignifikánsan nagyobb a csonk zsírlerakódás mintázata (+ 14%, a szubkapsularis-tricepsz bőrhajtási arányon keresztül mérve), mint azoknál, akiknek születési súlya a legmagasabb volt nemi, etnikai hovatartozástól és jelenlegi társadalmi-gazdasági állapottól függetlenül tercilis [88].
5. Méhen belüli mechanizmusok A méhben A későbbi zsírosság programozása
Állat- és emberkutatások több intrauterin mechanizmusra összpontosítottak, amelyek programozhatják a magzati zsírszövetet a későbbi elhízásra. Konkrétan a magzati zsírszövet morfológiájában és anyagcseréjében bekövetkezett változásokat, az étvágyat szabályozó megváltozott utakat, valamint a magzat hormonszintjének és epigenómájának módosítását emelték ki kritikus szabályozóként az elhízás kialakulásában az IUGR után (2. ábra).
5.1. A magzati zsírfejlődés szerepe a zsírszövet későbbi terjeszkedésében
5.2. Leptin, IUGR és későbbi zsírszövet-fejlesztés
5.3. A méhben Glükokortikoidok és posztnatális zsírszövet kitettsége
A hypothalamo-hipofízis-mellékvese (HPA) tengely felajánlotta, hogy részt vegyen a későbbi élet-elhízás patofiziológiájában az IUGR születése után [109]. A mechanizmusok nincsenek pontosan meghatározva, de az állatkísérletek bizonyítékai azt sugallják, hogy a korai életkorban bekövetkező nemkívánatos események befolyásolhatják a magzat neuroendokrin fejlődését, ami hosszú távú változásokat eredményezhet számos fő hormonális tengely alapjelében, beleértve a mellékvese glükokortikoid szekréciójának növekedését. Valóban, a korai tápanyag-korlátozott juhmagzatok zsírszövetében megváltozik a glükokortikoid jelátvitel (megnövekedett glükortikoid receptor és 11-
-hidroxi-szteroid-dehidrogenáz 1 (11β-HSD1) expresszió, de csökkent 11β-HSD2 bőség) a terhesség 140. napján és a szülés utáni 6 hónapban [110]. Mint 11β-A HSD2 a kortizolt inaktív kortizon metabolittá alakítja [111], és úgy gondolják, hogy megvéd bizonyos szöveteket a kortizol túlzott expozíciójától [112], ezek az eredmények arra utalnak, hogy a tápanyag-korlátozásnak kitett utódokban fokozódhat a glükokortikoid hatás a méhben, ezáltal növelve a későbbi elhízás iránti fogékonyságukat. Így felvetődött, hogy ez a méhben Az anyai tápanyag-korlátozott juhmagzatokban rövid időn belül megfigyelt fokozott zsírglükokortikoid érzékenység később a zsigeri elhízás patofiziológiai fejlődéséhez vezethet a későbbi életben azáltal, hogy postnatálisan elindítja a fehér zsírszövet jellemzőinek elsajátítását [110].
5.4. Magzati epigenom és posztnatális zsírfejlődés
6. Következtetés és perspektívák
Ez a cikk keretet nyújt ahhoz, hogy az adipogenezis és a lipogenezis folyamatait hogyan lehet megváltoztatni az IUGR-ben és az alacsony születési súlyban, meghatározva az elhízás színterét a későbbi életben. Állat- és humán vizsgálatokból származó bizonyítékokat mutat be, amelyek arra utalnak, hogy az adipociták fokozott lipogén és adipogén képessége, hipoleptinémia, megváltozott glükokortikoid jelátvitel és a magzati élet során fellépő epigenetikai módosítások valószínűleg nagy szerepet játszanak a a méhben a későbbi életbeli elhízás eredete. Tekintettel arra, hogy a magzati zsírszövet diszkrét molekuláris változásai az élet későbbi szakaszaiban hátrányosan befolyásolják az IUGR egyedek zsírszövet fejlődését, valóban szükség van longitudinális vizsgálatok elvégzésére (születés előtt, a korai posztnatális életkorban és a felnőttkorban) a zsírszövet fejlődéséről és határozottan meg kell állapítani, hogy a szövet mely génjeinek és útjainak van oksági szerepe a a méhben az elhízás eredete.
Hivatkozások
- Meghatározza az élettartamot a méhen belüli ADC Magzatban; Újszülött kiadás
- Méhen belüli növekedés korlátozása és túlsúlya, elhízása és megrekedése az őslakos serdülőknél
- A hipoxia okozta méhen belüli növekedés korlátozása növeli a patkányok érzékenységét a magas zsírtartalomra
- Az anya magas terhesség korai vércukorszintje a magzat növekedésének megváltozásával és
- A normális súlyú megnövekedett zsigeri zsírosság hatása az artériás merevség progressziójára