A kis zsírsejtek megnövekedett aránya az inzulinrezisztens és az inzulinérzékeny elhízott egyéneknél a károsodott adipogenezist vonja maga után
Absztrakt
Célok/hipotézis
Nem világos az a biológiai mechanizmus, amely révén az elhízás hajlamos az inzulinrezisztenciára. Az egyik hipotézis szerint a nagyobb zsírsejtek fokozott lipolízissel zavarják az anyagcserét. Míg a vizsgálatok kimutatták, hogy a sejtméret a BMI-vel arányosan növekszik, nem egyértelműen bebizonyosodott, hogy a BMI-től független zsírsejtméret összefügg az inzulinrezisztenciával. A tanulmány célja ennek a széles körben elterjedt feltételezésnek a tesztelése volt, összehasonlítva a zsírsejtek méretének eloszlását 28 egyformán elhízott, egyébként egészséges egyénnél, akik az inzulinérzékenység spektrumának szélső végeit jelentették, amint azt a módosított inzulinszuppressziós teszt meghatározza.
Tantárgyak és módszerek
A szubkután periumbilicalis zsírszövet-biopszia mintákat ozmium-tetroxidban rögzítettük, és a Beckman Coulter Multisizer-en átengedtük a sejtméret-eloszlás eléréséhez. Az inzulinérzékenységet a módosított inzulinelnyomási teszttel számszerűsítettük. A zsírsejt-differenciálódási gének kvantitatív valós idejű PCR-jét 11 alany esetében végeztük el.
Eredmények
Minden egyén bimodális sejtméret-eloszlást mutatott. A várakozásokkal ellentétben a nagyobb sejtek átlagos átmérője nem különbözött szignifikánsan az inzulinérzékeny és az inzulinrezisztens egyedek között. Ezenkívül az inzulinrezisztencia a kis és nagy sejtek nagyobb arányával társult (1,66 ± 1,03 vs 0,94 ± 0,50, o = 0,01). Hasonló sejtméret-eloszlást figyeltünk meg az izolált zsírsejtek esetében is. A valós idejű PCR eredmények két-háromszor alacsonyabb expressziót mutattak a zsírsejt-differenciálódás markereit kódoló génekben (peroxiszóma proliferátor-aktivált receptor γ1 [PPARγ1], PPARγ2, GLUT4, adiponektin, szterin-receptor elem kötő fehérje 1c) inzulinrezisztens összehasonlításban inzulinérzékeny egyénekkel.
Következtetések/értelmezés
Ezek az eredmények azt sugallják, hogy az elhízás szabályozása után az inzulinrezisztencia a kis zsírsejtek kibővített populációjával és a differenciálódási markerek csökkent expressziójával jár, ami arra utal, hogy a zsírsejtek differenciálódásának károsodása hozzájárulhat az elhízáshoz társuló inzulinrezisztenciához.
Bevezetés
Annak ellenére, hogy minden bizonyíték [1–6] arra utal, hogy a túlzott zsírosság az inzulin által közvetített glükózfelvétel károsodásával jár együtt, az a sejt-/anyagcsere-mechanizmus, amely megmagyarázza, hogyan vezet a zsírtömeg növekedése ehhez az elváltozáshoz, nem egyértelmű. A megnövekedett zsírtömeg és az izom inzulinrezisztencia közötti mechanizmus közötti egyértelműség hiányát tovább fokozzák annak bizonyítékai, hogy nem minden túlsúlyos/elhízott egyén inzulinrezisztens, és hogy az ugyanolyan elhízott egyének lehetnek inzulinérzékenyek, valamint inzulinrezisztensek [7– 10].
Az elhízás és az izom inzulinrezisztencia között feltételezhető összefüggés az, ahogyan a zsírsejtek növelik zsírtartó képességüket. Az 1970-es évekre visszavezethető tanulmányok az elhízás szempontjából értékelték a zsírsejtek méretét, és kimutatták, hogy az elhízott, megnagyobbodott szubkután hasi zsírsejtekkel rendelkező egyének nagyobb valószínűséggel hiperinsulinaemiásak és glükóz-intoleránsak, mint a kisebb zsírsejtekkel rendelkezők [11–18]. Ezek a megállapítások ahhoz a felfogáshoz vezettek, hogy a hipertrófiás és a hiperplasztikus elhízással küzdő egyének nagyobb valószínűséggel inzulinrezisztensek és cukorbetegség alakulnak ki [12].
Azonban ezekben a vizsgálatokban az összes zsírsejtet megszámolták, és az összes lipidet kivonták az átlagos sejtméret meghatározásához [18]. Továbbá a vizsgálatok többségében hiányzott a BMI szempontjából egyeztetett kontrollalanyok, ami a megfigyelt asszociációk nyilvánvaló megalapítója. Az újabb Beckman Coulter (Miami, FL, USA) Multisizer technológiával és szoftverrel megállapítottuk, hogy a Zucker zsíros patkányok zsírszövete a zsírsejtek méretének összetett eloszlását mutatja, úgy tűnik, hogy mind a kis, mind a nagy sejtek populációit magában foglalja, így a meghatározás átlagos sejtátmérője nem írja le megfelelően a sejtpopulációt (DG Hunt, X. Chen, M. Santos, N. Tserentsoodol, S. Cushman; nem publikált adatok). Ezen megfigyelések alapján úgy döntöttünk, hogy tovább vizsgáljuk a zsírsejtméret és az inzulinrezisztencia közötti kapcsolatot. Vizsgálatunk abban különbözik a korábbi vizsgálatoktól, hogy (1) a sejtek méretét és eloszlását a Multisizer technológiával számszerűsítettük, és (2) kísérleti populációnk közepesen elhízott egyénekből állt, akik vagy nagyon inzulinrezisztensek vagy nagyon inzulinérzékenyek voltak, de a BMI szempontjából megfeleltek.
Tantárgyak és módszerek
Tárgyak
A plazma glükóz-, inzulin- és lipid/lipoprotein-koncentrációit egy éjszakai böjt után mértük, az előzőekben leírtak szerint [20, 23]. Egyéb kísérleti mérések között szerepelt a súly; magasság; BMI, súlyként kilogrammban/(magasság méterben kifejezve) 2; derék kerülete, amelyet a véglejáratkor mérnek, mint a csípőcsík és az alsó bordarés közötti távolságot; aerob edzés, percben/hétben kifejezve; faj/etnikum; és vérnyomás (hat leolvasás átlaga).
A zsírszövet biopsziája és a sejtméret elemzése
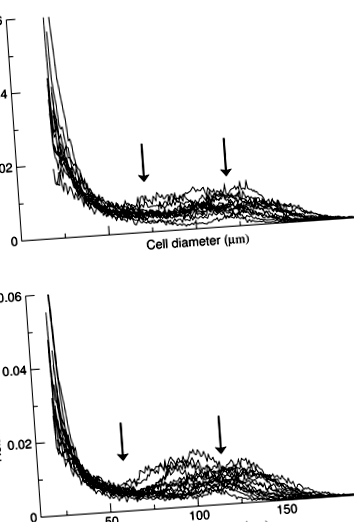
A zsírszövetet steril körülmények között állítottuk elő, 0,25 bupivokain adrenalin (epinefrin) beadásával helyi érzéstelenítés céljából. A köldökhöz képest 1 cm-es szike metszést végeztek, amelyből 2 g szubkután zsírszövetet távolítottak el. Két 20–30 mg szövetmintát azonnal rögzítettünk ozmium-tetroxidban, és inkubáltuk 37 ° C-os vízfürdőben 48 órán át, az előzőekben leírtak szerint [14], majd a zsírsejtek méretét egy Beckman Coulter Multisizer III, egy 400 μm-es rekesz. Az ezzel a nyílással hatékonyan mérhető sejtméretek tartománya 20–240 μm. A műszert 6000 részecske számlálására állítottuk be, és a rögzített sejtes szuszpenziót úgy hígítottuk, hogy az egybeeső számlálás az 1. ábra legyen.
Inzulinrezisztens multisizer zsírsejtprofilok (a) és inzulinérzékeny (b) alanyok, ábrázolva a sejtek átmérőjét lineáris tartályok alkalmazásával a relatív gyakorisággal szemben. Az AUC értékeket normalizáljuk 1,0-re, és a frekvenciaprofilokat csonkoljuk y = 0,06 az érthetőség kedvéért. A nadír a két sejtpopuláció közötti mélypont (gyakoriságban), vagyis ahol a görbe a két populáció között lapos volt, a középpontot nadírnak nevezték. A csúcsátmérő a legalacsonyabb, vagyis a „nagy” sejtek fölötti sejtek átlagos átmérője. A nyilak a nadír (bal) és a csúcsátmérő (jobb) minden csoportra
Kvantitatív valós idejű PCR a zsírsejt-differenciálódás markereihez
Statisztikai analízis
Diák párostalan t teszteket vagy a χ 2 tesztet (kategorikus változók esetében) használtuk a két csoport klinikai és laboratóriumi jellemzőinek összehasonlítására, valamint az elsődleges végpontok értékelésére a két csoport közötti sejtméret-eloszlás tekintetében. Ezek a végpontok voltak a legalacsonyabb érték, a kis és nagy sejtek aránya, valamint a nagy sejtek populációjának csúcsátmérője. A lehetséges zavarókat (nem, BMI vagy derékbőség és testmozgás) bevontuk a kovariancia (ANCOVA) modellek elemzésébe, amelyekben a sejtméret-eloszlás végpontjai függő változók voltak, és az inzulinrezisztens csoport volt az elsődleges csoportosító változó, Scheffe többszörös kiigazításával. összehasonlítások. A valós idejű PCR-rel (alább) számszerűsített relatív génexpresszió összehasonlítását összehasonlítottuk a nem párosított Student-szel t tesztek. Ezeket az elemzéseket a Systat 10.0 (SPSS, Chicago, IL, USA) alkalmazásával hajtottuk végre.
További kvantitatív elemzéseket matematikai modellezéssel (nemlineáris legkisebb négyzetek függvénye nls, R 1,9; elérhető: http://www.r-project.org, utoljára 2007 májusában látogattunk) végeztünk, amelyben egyetlen képletet használtunk hét cellaméret-paraméter írhatja le az egyes alanyok egyedi adatpontjait:
hol x = cellaátmérő és x 0 = a legkisebb átmérő; h 1 és w 1 = az első exponenciál magassága és szélessége; h 2 és w 2 = a második exponenciális magassága és szélessége; és h o, c p és w p = a Gauss-görbe magassága, középpontja és szélessége. Az ezen egyenlet által megfogalmazott görbében a kis cellákat két exponenciál összege, a nagy cellákat pedig Gauss-görbe képviseli (Elektronikus kiegészítő anyag [ESM] 1. ábra). A két csoport görbe profiljai közötti összetett különbséget többváltozós varianciaanalízissel (MANOVA) értékeltük. Az egyenlet hét cellaméret-paraméterének csoport közötti különbségét párosítatlan Student-on keresztül értékeltük t teszt. Minden elemzéshez a o A 0,05 vagy annál kisebb értéket statisztikailag szignifikánsnak tekintettük.
Eredmények
Tizenhárom inzulinrezisztens és 15 inzulinérzékeny túlsúlyos vagy elhízott alanyon végeztek zsírszöveti biopsziát. A két alany klinikai és laboratóriumi jellemzőit az 1. táblázat mutatja be. Szelekció alapján az inzulinrezisztencia különbsége drámai volt, az átlagos SSPG az inzulinrezisztens alcsoportban körülbelül háromszorosa volt az inzulinérzékeny alcsoport értékeinek. Szelekció alapján a két csoport jól illeszkedett a BMI (30,6 ± 4,1 vs 29,4 ± 2,7) és a derék kerülete (102 ± 12 vs 989) szempontjából. Nem észleltünk statisztikailag szignifikáns különbséget a csoportok között az életkor, a nem, a testmozgás jelentett szintje, a vérnyomás, az éhgyomri glükóz vagy az összes koleszterin vagy az LDL-koleszterin tekintetében. Az inzulinrezisztens elhízott résztvevőknél a plazma triacil-glicerin-koncentrációk magasabbak és a HDL-koleszterin-koncentrációk alacsonyabbak voltak.
Az 1. ábra mind a 28 alany zsírsejt-eloszlását szemlélteti, multisizer-analízissel meghatározva, ozmium-fixált zsírszövetből izolált sejteket használva. A zsírsejt-eloszlás minden alanyban bimodális volt, a kisméretű sejtek változó, de általában nagy arányának eredményeként. Azt, hogy a Multisizer által azonosított kis sejtek valóban zsírsejtek voltak, alátámasztja mind a paraformaldehid-fixált szövet, mind a multisizer-elemzéshez feldolgozott ozmium-fixált sejtek pásztázó elektronmikroszkópiája, amely a 2. ábrán látható, amely egyértelműen bizonyítja a kis zsírsejtek jelenlétét, amelyek gömb alakú tárgyakként megjelennek a sztrómás vaszkuláris sejtek (rúd vagy ujjszerű sejtek, csak a 2a. ábra) és monociták (a gömb alakú zsírsejtekhez tapadó nagyon kicsi tárgyak). Hogy kvantitatív módon megerősítsük, hogy a kis sejtek populációja valóban zsírsejt volt, közvetlen kvantitatív összehasonlítást végeztünk a szöveti rögzítéssel előállított ozmium-fixált sejtek és a izolált zsírsejtek rögzítésével előállított sejtméret-eloszlásokról, amelyeket a ugyanaz a szövetbiopszia. A 3. ábra grafikonjai azt mutatják, hogy az izolált sejtek eloszlási görbéi megközelítik a zsírszövetét.
Fotópéldák humán zsírsejtekről, amelyek nagyon eltérő méretűek. a A paraformaldehid-fixált szövet pásztázó elektronmikroszkópiája, amely apró és nagyon kicsi zsírsejteket mutat (a nyilak körülbelül 45 és 10 μm átmérőjű sejteket mutatnak). b Oszmium-fix sejtek pásztázó elektronmikroszkópiája, nagy és kicsi zsírsejteket mutatva
Az intakt zsírszövet biopsziás mintáinak zsírsejtméret-eloszlásának multisizer profiljai (nyitott körök) és izolált zsírsejtek (zárt körök) két különböző alany azonos szövetéből
A 2. táblázat bemutatja a zsírsejt-átmérő átlagát, mediánját és módját az inzulinérzékeny és inzulinrezisztens csoportokban. Míg ezek az értékek nem különböztek szignifikánsan a két csoport között, az inzulinrezisztens csoportot magasabb mélypont jellemezte (72 ± 13 vs 59 ± 10 μm, o 2. táblázat A zsírsejtek méretének eloszlása inzulinrezisztens és inzulinérzékeny elhízott egyéneknél
A zsírsejtméret multisizer profiljai az inzulinérzékeny görbeillesztési képlet átlagparamétereinek felhasználásával (folytonos vonal) és inzulinrezisztens (szaggatott vonal) tantárgyak (o = 0,03 a MANOVA használatával)
Annak vizsgálatára, hogy az inzulinrezisztens alanyokban lévő kis zsírsejtek viszonylag differenciálatlan zsírsejteket képviselnek-e, a két alcsoportban (hat inzulinrezisztens és öt inzulinérzékeny résztvevő) megmértük a zsírsejtek differenciálódásával kapcsolatos gének relatív expresszióját. A hat inzulinrezisztensből négy és az öt inzulinérzékeny résztvevőből négy részt vett a sejtméret-elemzésben. Az inzulinrezisztens és inzulinérzékeny csoportok demográfiai/metabolikus jellemzői ebben az elemzésben a következők voltak: SSPG 12,72 ± 2,17 vs 3,44 ± 0,56 mmol/l (o 2 (o = 0,15); derék kerülete 100 ± 13 vs 97 ± 14 cm (p = 0,75). A 3. táblázat bemutatja, hogy az SREBP1c, PPARγ1 és PPARγ2 differenciálódási faktorokat kódoló gének expressziója, valamint az érett sejtfehérjék, az adiponektin és a GLUT4 mind legalább kétszer magasabbak voltak az inzulinérzékeny csoportban.
Vita
Értelmezzük ezeket az adatokat arra utalva, hogy az elhízott egyének inzulinrezisztenciája nem azért következik be, mert nagyobb zsírsejtjeik vannak, amint azt korábban már javasolták [13, 15], hanem legalábbis részben annak következtében, hogy képtelenek reagálni a szükség van a felesleges energia (triacil-glicerin) tárolására a teljesen differenciált, érett zsírsejtek termelésének növelésével. Megállapítottuk a kis zsírsejtek arányának növekedését, ami azt sugallja, hogy a prekurzor sejtek annyi triacil-glicerint felhalmoznak, hogy lebegés vagy relatív méret alapján zsírsejtekké váljanak, de a triacil-glicerin tárolási folyamatában nem tudnak tovább működni, összhangban azokkal a megfigyelésekkel, amelyek szerint az inzulinrezisztens egyének viszonylag nagyobbak a májban és a vázizomban tárolt zsírmennyiség [25, 26]. Ezenkívül az érett zsírsejtek relatív hiánya összefüggésbe hozható a végső adipocita eredetű fehérjék, például az adiponektin szekréciójának rendellenességeivel, amelyek koordinálják a zsírsejteket és a szisztémás anyagcserét. Eredményeink összhangban vannak egy korábbi jelentéssel, amely azt mutatja, hogy az adiponektin plazmakoncentrációja lényegesen alacsonyabb az elhízott inzulinrezisztens egyéneknél, mint a hasonlóan elhízott inzulinérzékenyeknél [27].
Molekuláris szinten eredményeinket számos jelentés alátámasztja. Először is, egy 3T3-L1 adipocita tenyész sejtrendszerben bebizonyosodott, hogy az IL-6 és a TNF-a gyulladásos citokinekkel együtt tenyésztve a korai differenciálódás megengedett, de a terminális stádiumig való érlelés megakadályozott [28]. Ezek a diszfunkcionális adipociták kevesebb triacil-glicerint felhalmoztak és gyulladásos fenotípust expresszáltak. Egy másik jelentésben a HIV-1-hez kapcsolódó lipoatrophiában szenvedő betegek zsírszövete csökkent differenciálódást és fokozott gyulladást mutatott a kontrollokhoz képest az inzulinrezisztenciával összefüggésben [29]. Ebben a vizsgálatban nem számszerűsítettük a gyulladásos markereket, de az emberi elhízással kapcsolatos jövőbeni vizsgálatok során érdemes lenne meghatározni, hogy a sejtméret és/vagy a differenciálódás különbségei összefüggenek-e gyulladással molekuláris szinten, különösen mivel korábban kimutattuk, hogy több keringő a gyulladásos markerek az inzulinérzékenység függvényében változnak, az elhízástól függetlenül [30, 31].
Eredményeink és feltételezett patofiziológiai következményeik összhangban vannak az emberi és az állati lipodisztrófia modellekkel, amelyekben a szubkután zsírszövet szinte abszolút hiánya az inzulinrezisztenciával társul, megnövekedett triacil-glicerin-lerakódással az izmokban és a májban [36, 37]. Hasonlóképpen állítható, hogy az elhízás kialakulása olyan személyeknél, akiknek egyelőre tisztázatlan okokból hiányosságuk van abban, hogy növeljék a zsírsejtek triacil-glicerin tartalmát a teljesen differenciált zsírsejtek populációjának növelésével, inzulinrezisztensebb lesz, mint egyformán elhízott egyének, akik megtartották ezt a képességüket. Eredményeink magyarázatot adnak arra a mechanizmusra is, amellyel a tiazolidenedion-vegyületek fokozhatják az inzulinhatásokat a vázizomzatban: a zsírsejt-differenciálódás serkentésével [38] a triacil-glicerin zsírszövetben való tárolásának képességében bekövetkező relatív hiány maladaptív metabolikus következményei enyhülnek., ennek következtében csökken a máj [39] és a vázizom zsírtartalma [40].
Vizsgálatunkat kis mérete korlátozza. Ezenfelül nem tudjuk bizonyítani az okozati összefüggést, csupán beszámolunk az asszociációkról ebben az emberi vizsgálatban. Ne feledjük, hogy nem állítjuk, hogy a kis sejtek a génexpresszió és a zsíranyagcsere szempontjából különböznek a nagysejtektől. Inkább azt javasoljuk, hogy inzulinérzékeny és inzulinrezisztens alanyokban létezzenek különbségek a zsírsejtek között, amelyek a sejtméret-eloszlás számszerűsíthető különbségével járnak. További metabolikus különbségek lehetnek a kis és nagy sejtek között, amelyek hozzájárulhatnak a sejtméret-eloszlások különbségeinek az egész test metabolizmusára gyakorolt hatásához, de egy ilyen meghatározás további munkát igényel a sejtek méret szerinti elkülönítésére.
Korrigáltuk a BMI és a derékkörfogat, valamint a nem és a testmozgás enyhe eltéréseinek lehetséges zavaró hatásait. A vizsgálati alanyok elsősorban fehérek voltak, és ezért eredményeink nem feltétlenül általánosíthatók minden faji csoportra. Végül, mivel vizsgálatunk résztvevői csak a szubkután zsírszöveti biopsziához voltak elérhetőek, nem tudtuk felmérni a zsigeri zsírszövet inzulinrezisztenciához való hozzájárulását. A rágcsálókon végzett párhuzamos vizsgálatok azonban kimutatták, hogy a zsírsejtek méretének eloszlása hasonló a depókon (D.G. Hunt, X. Chen, M. Santos, N. Tserentsoodol, S. Cushman; publikálatlan eredmények). Az erősségek közé tartozik két hasonlóan elhízott csoport jellemzése, amelyek anyagcserében különböznek egymástól, és egy újabb technológia alkalmazása a sejtméret-eloszlás kifinomultabb jellemzésére.
- Minden, amit tudnia kell, ha van egy kis pénisz izma; Fitness
- A kis bolygó étrendje megismertette az ikervárosok napi bolygóját
- Diéta fogyás és anyagcsere-egészség fenntartására elhízott posztmenopauzás nőknél - teljes
- Sejtmentes, teljes szövegű molekuláris és funkcionális jellemzés a szomatikus PIWIL1piRNS útvonalon
- A testmozgás csökkenti a terhességi cukorbetegséget elhízott terhes nőknél Három 60 perces közepes intenzitású